- 2021-04-13 发布 |
- 37.5 KB |
- 20页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学刷题冲刺(含最新模拟题)专题八氯及其化合物讲义
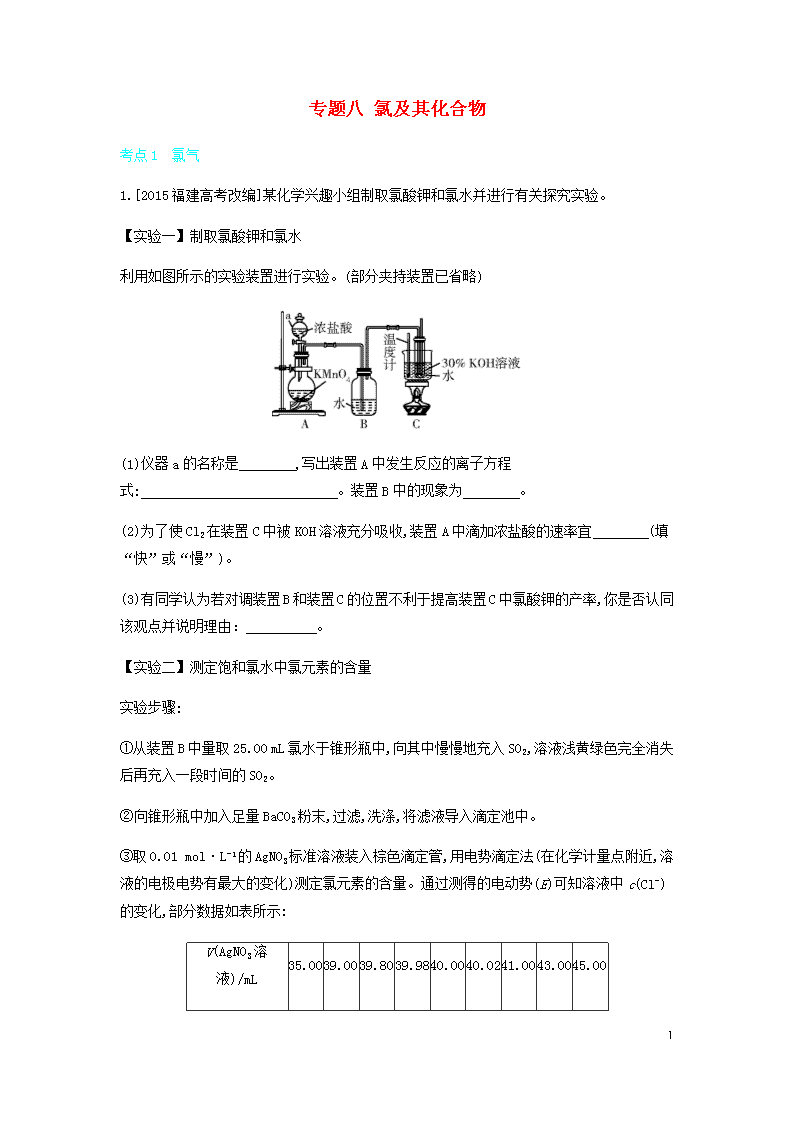
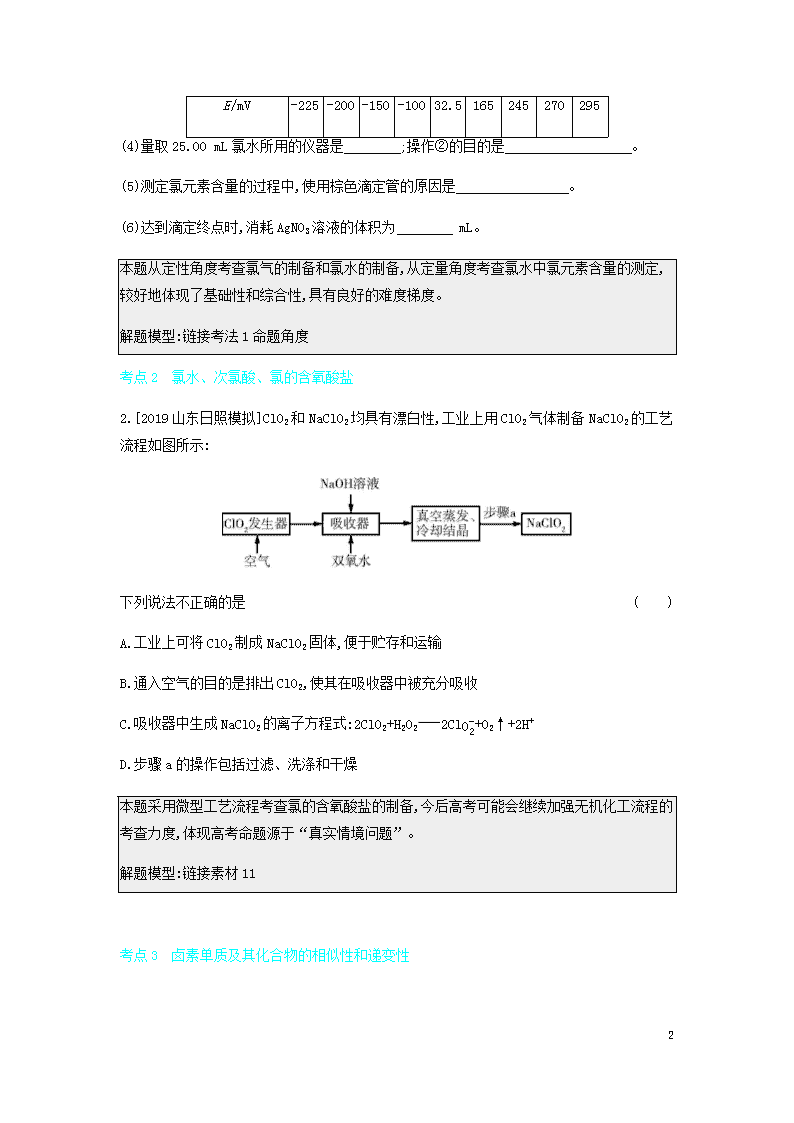
1 专题八 氯及其化合物 考点 1 氯气 1.[2015 福建高考改编]某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。 【实验一】制取氯酸钾和氯水 利用如图所示的实验装置进行实验。(部分夹持装置已省略) (1)仪器 a 的名称是 ,写出装置 A 中发生反应的离子方程 式: 。装置 B 中的现象为 。 (2)为了使 Cl2 在装置 C 中被 KOH 溶液充分吸收,装置 A 中滴加浓盐酸的速率宜 (填 “快”或“慢”)。 (3)有同学认为若对调装置 B 和装置 C 的位置不利于提高装置 C 中氯酸钾的产率,你是否认同 该观点并说明理由: 。 【实验二】测定饱和氯水中氯元素的含量 实验步骤: ①从装置 B 中量取 25.00 mL 氯水于锥形瓶中,向其中慢慢地充入 SO2,溶液浅黄绿色完全消失 后再充入一段时间的 SO2。 ②向锥形瓶中加入足量 BaCO3 粉末,过滤,洗涤,将滤液导入滴定池中。 ③取 0.01 mol·L-1 的 AgNO3 标准溶液装入棕色滴定管,用电势滴定法(在化学计量点附近,溶 液的电极电势有最大的变化)测定氯元素的含量。通过测得的电动势(E)可知溶液中 c(Cl-) 的变化,部分数据如表所示: V(AgNO3 溶 液)/mL 35.0039.0039.8039.9840.0040.0241.0043.0045.00 2 E/mV -225 -200 -150 -100 32.5 165 245 270 295 (4)量取 25.00 mL 氯水所用的仪器是 ;操作②的目的是 。 (5)测定氯元素含量的过程中,使用棕色滴定管的原因是 。 (6)达到滴定终点时,消耗 AgNO3 溶液的体积为 mL。 本题从定性角度考查氯气的制备和氯水的制备,从定量角度考查氯水中氯元素含量的测定, 较好地体现了基础性和综合性,具有良好的难度梯度。 解题模型:链接考法 1 命题角度 考点 2 氯水、次氯酸、氯的含氧酸盐 2.[2019 山东日照模拟]ClO2 和 NaClO2 均具有漂白性,工业上用 ClO2 气体制备 NaClO2 的工艺 流程如图所示: 下列说法不正确的是 ( ) A.工业上可将 ClO2 制成 NaClO2 固体,便于贮存和运输 B.通入空气的目的是排出 ClO2,使其在吸收器中被充分吸收 C.吸收器中生成 NaClO2 的离子方程式:2ClO2+H2O2 2ClO-2+O2↑+2H+ D.步骤 a 的操作包括过滤、洗涤和干燥 本题采用微型工艺流程考查氯的含氧酸盐的制备,今后高考可能会继续加强无机化工流程的 考查力度,体现高考命题源于“真实情境问题”。 解题模型:链接素材 11 考点 3 卤素单质及其化合物的相似性和递变性 3 3.[2018 全国卷Ⅲ,27,14 分]KIO3 是一种重要的无机化合物,可作为食盐中的补碘剂。回答下 列问题: (1)KIO3 的化学名称是 。 (2)利用“KClO3 氧化法”制备 KIO3 工艺流程如图所示: “酸化反应”所得产物有 KH(IO3)2、Cl2 和 KCl。“逐 Cl2”采用的方法是 。“滤 液”中的溶质主要是 。“调 pH”中发生反应的化学方程式 为 。 (3)KIO3 也可采用“电解法”制备,装置如图所示。 ①写出电解时阴极的电极反应式 。 ②电解过程中通过阳离子交换膜的离子主要为 ,其迁移方向 是 。 ③与“电解法”相比,“KClO3 氧化法”的主要不足之处有 (写出 一点)。 该题具有科学的难度梯度,体现命题的基础性、综合性和应用性,设问角度巧妙,如“逐 Cl2” 采用的方法;情境新颖,如给出一元强酸碘酸(HIO 3)的酸式盐 KH(IO3)2。“电解法”制备 KIO3,实际上是制备 IO-3。第(3)题第①小题要求书写碱性条件下阴极的电极反应式,根据电解 原理,阴极上实际是 H2O 电离出的 H+放电。第③小题评价“KClO3 氧化法”的不足之处,增强 环保意识,体现“科学态度与社会责任”的化学学科核心素养。 4 解题模型:链接素材 12 考点 1 氯气 考法 1 氯气的制备、性质及应用 命题角度 氯气的制备和性质实验探究 1 某化学兴趣小组利用如图所示装置制取氯气并探究其有关性质。 (1)装二氧化锰的仪器的名称是 ,发生反应的化学方程式为 。 (2)正确连接装置后,如何检验 A 装置的气密性:。 (3)一定温度下,将多余的 Cl2 用 100 mL 1.7 mol·L-1 的 NaOH 溶液完全吸收。冷却至室温后,对 吸收后的溶液进行分析检测,测得其 pH=13 (不考虑反应前后溶液的体积变化),ClO-和 ClO-3 的物质的量浓度之比为 5∶1。请回答: ①吸收氯气消耗的 NaOH 的物质的量为 mol。 ②被氧化的氯气的物质的量为 mol。 5 (4)通二氧化硫和氯气一段时间后,甲同学实验的过程中品红溶液几乎不褪色,而乙同学实验 的现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回 答问题。 ①试分析甲同学实验的过程中,品红溶液不褪色的原因 为 ,涉及反应的离子方程 式为 。 ②你认为乙同学是怎样做到让品红溶液变得越来越浅 的? 。 (5)请你帮该小组同学设计一个实验,证明 B 装置中的 Na2SO3 已被氧化: 。 (1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水。(2)用止水夹夹住 A、B 装置之间的橡胶管,打开 A 装置中分液漏斗的玻璃塞与活塞,向其中注水。若一段时间 后,液面不再下降,说明气密性良好;反之,则气密性差。(3)①反应前 NaOH 的物质的量为 0.1L×1.7mol·L-1=0.17mol, 反应后溶液 pH=13, 则反应后氢氧化钠的物质的量浓度为 0.1mol·L-1,故反应后 NaOH 的物质的量为 0.1L×0.1mol·L -1=0.01mol,吸收氯气消耗的 NaOH 的物质的量为 0.17mol-0.01mol=0.16mol。②ClO-和 ClO-3的物质的量浓度之比为 5∶1, 发生的反应为 8Cl2+16NaOH 5NaClO+NaClO3+10NaCl+8H2O,则反应掉的氯气的物质的量为 0.16mol× 8 16=0.08mol, 其中被氧化的氯气转化为 ClO- 和 ClO-3, 物质的量为 0.08mol× 6 16 =0.03mol。(4)①氯气、二氧化硫和水反应生成 HCl 和硫酸,HCl 和硫酸没有漂白性,所以控 制 SO2 和 Cl2 的量,使其按物质的量之比为 1∶1 进气,反应的离子方程式为 SO2+Cl2+2H2O S O2-4 +2Cl-+4H+。②让氯气或二氧化硫过量可使品红溶液变得越来越浅,所以应控制 SO2 和 Cl2 的物质的量,使之不相等。 (1)圆底烧瓶 MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O (2)用止水夹夹住 A、B 装置之 间的橡胶管,打开 A 装置中分液漏斗的玻璃塞与活塞,向其中注水。若一段时间后,液面不再 下降,说明气密性良好;反之,则气密性差 (3)①0.16 ②0.03 (4)①控制 SO2 和 Cl2 的量, 使其按物质的量之比为 1∶1 进气 SO2+Cl2+2H2O SO2-4 +2Cl-+4H+ ②控制 SO2 和 Cl2 的物 质的量,使之不相等 (5)取少量 B 装置中溶液于试管中,向其中滴加稀盐酸至不再产生气体, 再向其中滴加氯化钡溶液,若产生白色沉淀,则证明 B 装置中的亚硫酸钠已被氧化(其他合理 答案均可) 1. [2019 山东青岛模拟]如图所示是验证氯气性质的微型实验,a、b、d、e 是浸 有相关溶液的滤纸。向 KMnO4 晶体中滴加一滴浓盐酸后,立即用另一培养皿扣在上面。 6 已知:2KMnO4+16HCl 2KCl+5Cl2↑+2MnCl2+8H2O。 对实验现象的解释或结论正确的是 ( ) 选 项 实验现象 解释或结论 A a 处变蓝,b 处变红棕 色 氧化性:Cl2>Br2>I2 B c 处先变红,后褪色 氯气与水反应生成了酸性物质 C d 处立即褪色 氯气与水反应生成了漂白性物质 D e 处变红 还原性:Fe2+>Cl- 2.[2020 山东烟台质检]实验室用如图所示装置制备无水 AlCl3(180 ℃升华),无 水 AlCl3 遇潮湿空气即产生大量白雾。下列说法错误的是 ( ) A.b、c、f 中依次盛装饱和食盐水、浓硫酸、浓硫酸 B.g 中发生的反应为 Cl2+2NaOH NaCl+NaClO+H2O C.e 中的收集器必须保持干燥 D.实验时,a 和 d 处酒精灯应同时点燃 考点 2 氯水、次氯酸、氯的含氧酸盐 7 考法 2 氯水、次氯酸、氯的含氧酸盐的性质和应用 命题角度 1 新制氯水的成分及性质探究 2 [2014 江苏,13,4 分]在探究新制饱和氯水成分的实验中,下列根据实验现象得出的 结论不正确的是 A.氯水的颜色呈浅黄绿色,说明氯水中含有 Cl2 B.向氯水中滴加硝酸酸化的 AgNO3 溶液,产生白色沉淀,说明氯水中含有 Cl- C.向氯水中加入 NaHCO3 粉末,有气泡产生,说明氯水中含有 H+ D.向 FeCl2 溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有 HClO 氯气是黄绿色气体,因此氯水的颜色呈浅黄绿色,说明氯水中含有Cl2,A项正确;向氯水 中滴加硝酸酸化的 AgNO3 溶液,产生白色沉淀,白色沉淀是氯化银,说明氯水中含有 Cl-,B 项 正确;向氯水中加入 NaHCO3 粉末,有气泡产生,气体是 CO2,这说明氯水中含有 H+,C 项正确;向 FeCl2 溶液中滴加氯水,溶液颜色变成棕黄色,说明反应中有氯化铁生成,因为氯气也能把氯 化亚铁氧化为氯化铁,所以不能说明氯水中含有 HClO,D 项错误。 D 命题角度 2 氯的含氧酸盐的性质 3 [2015 北京,11,6 分]某消毒液的主要成分为 NaClO,还含有一定量的 NaOH。下列用 来解释事实的方程式中,不合理的是(已知:饱和 NaClO 溶液的 pH 约为 11) A.该消毒液可用 NaOH 溶液吸收 Cl2 制备:Cl2+2OH- ClO-+Cl-+H2O B.该消毒液的 pH 约为 12:ClO-+H2O HClO+OH- C.该消毒液与洁厕灵(主要成分为 HCl)混用,产生有毒 Cl2:2H++Cl-+ClO- Cl2↑+H2O 8 D.该消毒液加白醋生成 HClO,可增强漂白作用:CH3COOH+ClO- HClO+CH3COO- 已知饱和 NaClO 溶液的 pH 约为 11,这是由于 ClO-的水解,而该消毒液的 pH 约为 12,主 要是因为其中含有一定量的 NaOH,B 项错误。 B 考点扫描 1.[2018江苏,7C]KClO碱性溶液与Fe(OH) 3反应:3ClO-+2Fe(OH)3 2FeO2-4 +3Cl-+4H++H2O( ) 2.[2016 全国卷Ⅱ,26(2)]实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式 为 。 提示:1.✕ 2.NaClO+2NH3 N2H4+NaCl+H2O 考点 3 卤素单质及其化合物的相似性和递变性 考法 3 卤素单质及其化合物的性质 命题角度 用实验探究卤素单质的性质 4 为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已 略去,气密性已检验)。 实验过程: 9 Ⅰ.打开弹簧夹,打开活塞 a,滴加浓盐酸。 Ⅱ.当 B 和 C 中的溶液都变为黄色时,夹紧弹簧夹。 Ⅲ.当 B 中溶液由黄色变为橙色时,关闭活塞 a。 Ⅳ.…… (1)A 中产生黄绿色气体,其电子式是 。 (2)验证氯气的氧化性强于碘的实验现象是 。 (3)B 中溶液发生反应的离子方程式 是 。 (4)为验证溴的氧化性强于碘的,过程Ⅳ的操作和现象 是 。 (5)过程Ⅲ实验的目的 是 。 (6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到 下 ,得电子能力逐渐减弱。 (1)A 中产生的黄绿色气体为 Cl2,其电子式为 ∶ ·· Cl ·· ∶ ·· Cl ·· ∶。(2)氯气遇湿润的淀粉 -KI 试纸时,发生反应 Cl2+2KI I2+2KCl,产生的 I2 使淀粉变蓝,可以证明氯气的氧化性强 于碘的。(3)B 中 Cl2 与 NaBr 发生置换反应,离子方程式为 Cl2+2Br- 2Cl-+Br2。(4)C 中 NaBr 与氯气反应生成 NaCl 和 Br2,将 C 中溶液滴入 D 中,振荡,发生反应 Br2+2KI I2+2KBr,静置 后 D 中溶液分层,下层为碘的四氯化碳溶液,显紫红色,可以说明溴的氧化性强于碘的。(5)过 程Ⅲ主要是为了 确认 C 的黄色溶液中无 Cl2,排除对溴置换碘实验的干扰。(6)氯、溴、碘单质的氧化性逐渐 减弱,是因为从 Cl 到 I,原子半径逐渐增大,得电子能力逐渐减弱。 10 (1)∶ ·· Cl ·· ∶ ·· Cl ·· ∶ (2)湿润的淀粉-KI 试纸变蓝 (3)Cl2+2Br- Br2+2Cl- (4)打 开活塞 b,将少量 C 中溶液滴入 D 中,关闭活塞 b,取下 D 振荡,静置后 CCl4 层溶液变为紫红色 (5)确认 C 的黄色溶液中无 Cl2,排除 Cl2 对溴置换碘实验的干扰 (6)原子半径逐渐增大 3. [2014 江苏,19,15 分]实验室从含碘废液(除 H2O 外,含有 CCl4、I2、I-等)中回 收碘,其实验过程如下: (1)向含碘废液中加入稍过量的 Na2SO3 溶液,将废液中的 I2 还原为 I-,其离子方程式 为 ;该操作将 I2 还原为 I-的目的 是 。 (2)操作 X 的名称为 。 (3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH 约为2,缓慢通入Cl2,在40 ℃左右反 应(实验装置如图所示)。实验控制在较低温度下进行的原因 是 ;锥形瓶里盛放的溶液为 。 (4)已知:5SO2-3 +2IO-3+2H+ I2+5SO2-4 +H2O 某含碘废水(pH 约为 8)中一定存在 I2,可能存在 I-、IO-3 中的一种或两种。请补充完整检验 含碘废水中是否含有 I-、IO-3 的实验方案:取适量含碘废水用 CCl4 多次萃取、分液,直到水层 用淀粉溶液检验不出有碘单质存在; 。 实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3 溶液、Na2SO3 溶液。 11 冲刺双一流 疑难 2 从海水中提取氯、溴、碘 1.氯的提取——氯碱工业 海水 粗盐 饱和食盐水 {阳极产物:Cl2 阴极产物:H2、NaOH 化学方程式为 2NaCl+2H2O 2NaOH+H2↑+Cl2↑。 2.海水提取溴 (1)流程 (2)发生反应的化学方程式 ①2NaBr+Cl2 Br2+2NaCl; ②Br2+SO2+2H2O 2HBr+H2SO4; ③2HBr+Cl2 2HCl+Br2。 3.海带中提取碘 (1)流程 (2)发生反应的离子方程式:Cl2+2I- I2+2Cl-(或 H2O2+2I-+2H+ I2+2H2O)。 5 [2015 新课标全国卷Ⅱ,12,6 分]海水开发利用的部分过程如图所示。下列说法错误 的是 12 A.向苦卤中通入 Cl2 是为了提取溴 B.粗盐可采用除杂和重结晶等过程提纯 C.工业生产中常选用 NaOH 作为沉淀剂 D.富集溴一般先用空气和水蒸气吹出单质溴,再用 SO2 将其还原吸收 苦卤中含有 Br-,通入 Cl2 可将 Br-氧化成 Br2,A 项正确;粗盐中含有 Ca2+、SO2-4 等杂质离 子,故先除杂得 NaCl 的饱和溶液,而 NaCl 的溶解度随温度变化不大,采用重结晶可以得到较 纯净的 NaCl,B 项正确;工业上沉淀海水中的 Mg2+,采用 Ca(OH)2,不用 NaOH,因为 NaOH 的价格 较贵,C 项错误;Br2 易挥发,先用热空气和水蒸气吹出后,再用 SO2 吸收,生成 H2SO4 和 HBr,富集后再用 Cl2 将 HBr 氧化成 Br2,D 项正确。 C 4.[2014 新课标全国卷Ⅱ,36,15 分]将海水淡化与浓海水资源化结合起来是综 合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系 列工艺流程提取其他产品。 回答下列问题: (1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。 ①用混凝法获取淡水 ②提高部分产品的质量 ③优化提取产品的品种 ④改进钾、溴、镁等的提取工艺 (2)采用“空气吹出法”从浓海水中吹出 Br 2,并用纯碱吸收。碱吸收溴的主要反应是 B r 2 + N a 2 C O 3 + H 2 O N a B r + N a B r O 3 + NaHCO3,吸收 1 mol Br2 时,转移的电子为 mol。 (3)海水提镁的一段工艺流程如图所示: 13 浓海水的主要成分如下: 离子 Na+ Mg2+ Cl- SO2-4 质量浓度/(g·L-1) 63.7 28.8 144.6 46.4 该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品 2 的化学式 为 ,1 L 浓海水最多可得到产品 2 的质量为 g。 (4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式 为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关 反应的化学方程式: 。 素材 10 ClO2 的性质、制备和含量测定 1.物理性质 常温常压下,ClO2 是一种黄绿色气体,沸点为 11 ℃。 2.化学性质 ClO2 能与热水反应生成次氯酸、氯气、氧气,其水溶液受热或见光易分解。ClO2 主要表现出 氧化性,作氧化剂时,本身被还原为 Cl-,可作消毒剂、漂白剂。 (1)氧化+2 价 Mn:2ClO2+5Mn2++6H2O 5MnO2↓+12H++2Cl-。 (2)在 pH 为 5~9 的溶液中快速氧化 S2-:8ClO2+5S2-+4H2O 5SO2-4 +8Cl-+8H+。 (3)将 CN-氧化成 CO2 和 N2:2ClO2+2CN- 2CO2+N2+2Cl-。 3.制备 14 (1)还原法 ①氯酸钠与稀盐酸反应法:2NaClO3+4HCl 2NaCl+Cl2↑+2ClO2↑+2H2O。 ②草酸还原法:H2C2O4+2NaClO3+2H2SO4 2NaHSO4+2CO2↑+2ClO2↑+2H2O。 ③KClO3 与 SO2 反应法:2KClO3+SO2 2ClO2+K2SO4。 ④实验室常将NaClO 3和Na 2SO3用硫酸酸化,在加热条件下制备ClO 2:2NaClO3+Na2SO3+H2SO4 2ClO2↑+2Na2SO4+H2O。 (2)氧化法 ①亚氯酸钠与氯气反应法:2NaClO2+Cl2 2NaCl+2ClO2。 ②亚氯酸钠与盐酸反应法:5NaClO2+4HCl 4ClO2↑+5NaCl+2H2O。 考点扫描 1.[2018 全国卷Ⅲ,13C 改编]Na2O2 与 ClO2 均含有非极性共价键( ) 2.[2017 江苏,3B]ClO2 具有还原性,可用于自来水的杀菌消毒( ) 3.[2017 浙江 4 月选考,31 改编]ClO2 是一种优良的消毒剂,可用氯酸钠和过氧化氢在酸性条 件下制备,其反应方程式为 NaClO3+ H2O2+H2SO4 ClO2↑+ O2↑+Na2SO4+ 。 4.[2016 全国卷Ⅰ,28(4)改编]ClO2 尾气可用过氧化氢和氢氧化钠溶液吸收,产物之一为 NaClO2,则氧化剂与还原剂的物质的量之比为 ,该反应中氧化产物是 。 5.[2015 重庆,9(4)节选]已知在酸性条件下 NaClO2 可发生反应生成 NaCl 并释放出 ClO2,该 反应的离子方程式为 。 提示:1.✕ 2.✕ 3.2 1 2 1 2H2O 4.2∶1 O2 5.4H++5ClO-2 Cl-+4ClO2↑+2H2O 5. [2015 新课标全国卷Ⅱ,28(2)(3)(4),14 分]二氧化氯(ClO2,黄绿色易溶于水 的气体)是高效、低毒的消毒剂。回答下列问题: (1)实验室用 NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备 ClO2: 15 ①电解时发生反应的化学方程式为 。 ②溶液 X 中大量存在的阴离子有 。 ③除去 ClO2 中的 NH3 可选用的试剂是 (填标号)。 a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水 (2)用如图装置可以测定混合气中 ClO2 的含量: Ⅰ.在锥形瓶中加入足量的碘化钾,用 50 mL 水溶解后,再加入 3 mL 稀硫酸; Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口; Ⅲ.将一定量的混合气体通入锥形瓶中吸收; Ⅳ.将玻璃液封装置中的水倒入锥形瓶中; Ⅴ.用 0.100 0 mol·L-1 硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O2-3 2I-+S4O2-6 ), 指示剂显示终点时共用去 20.00 mL 硫代硫酸钠溶液。在此过程中: ①锥形瓶内 ClO2 与碘化钾反应的离子方程式为 。 ②玻璃液封装置的作用是 。 ③Ⅴ中加入的指示剂通常为 ,滴定至终点的现象是 。 ④ 测得混合气中 ClO2 的质量为 g。 16 (3)用 ClO2 处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质 最适宜的是 (填标号)。 a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁 素材 11 NaClO2、KClO3 的性质和应用 1.NaClO2:高效漂白剂和氧化剂。 制备:2NaOH+2ClO2+H2O2 2NaClO2+2H2O+O2。NaClO2 在溶液中受热易分解:3NaClO2 2NaClO3+NaCl。 用途: NaClO2 中的氯元素为+3 价,具有强氧化性,可用于纺织品的漂白及工业上处理 SO2、NO 等废气,如 3ClO-2+4NO+4OH- 3Cl-+4NO-3+2H2O。 2.KClO3:强氧化剂,常温下稳定,400 ℃时开始分解并放出 O2(可用于制备 O2)。制 备:3Cl2+6KOH KClO3+5KCl+3H2O。 考点扫描 1.[2018 江苏,19(1)节选]制备 NaClO 溶液时,若温度超过 40℃,Cl 2 与 NaOH 溶液反应生成 NaClO3 和 NaCl, 其 离 子 方 程 式 为 。 2.[2017 海南,4 改编]在酸性条件下,可发生如下反应:ClO-3+2M3++4H2O M2On-7 +Cl-+8H+,M2On-7 中 M 的化合价是 。 3.[2016 全国卷Ⅰ,28 改编]NaClO2 中 Cl 的化合价为 。利用氯酸钠、硫酸和 SO2 制备 ClO2,反应中有副产物 NaHSO4 生成,该反应的化学方程式 为 。 4.[2016 全国卷Ⅲ,27 改编]NaClO2 的化学名称为 ,NaClO2 溶液是脱硝反应的吸 收剂,其与 NO 反应生成的产物之一为 NO-3的离子方程式 为 。 提示:1.3Cl2+6OH- 5Cl-+ClO-3+3H2O 2.+6 3.2NaClO3+SO2+H2SO4 2NaHSO4+2ClO2 4.亚 氯酸钠 4NO+3ClO-2+4OH- 4NO-3+2H2O+3Cl- 17 6. 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、 油脂的漂白与杀菌。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。 已知:NaClO2饱和溶液在温度低于 38 ℃时析出的晶体是 NaClO2·3H2O,高于 38 ℃时析出的晶 体是 NaClO2,高于 60 ℃时 NaClO2 分解成 NaClO3 和 NaCl。Ba(ClO)2 可溶于水。 利用如图所示装置进行实验。 (1)仪器 a 的名称为 ,装置①的作用是 ,装置③的作用 是 。 (2)装置②中产生 ClO2,涉及反应的化学方程式 为 ;装置④中反应生成 NaClO2 的化学方程式 为 。 (3)从装置④反应后的溶液中获得晶体 NaClO2 的操作步骤:①减压,55 ℃蒸发结晶;②趁热过 滤;③ ;④低于 60 ℃干燥,得到成品。如果撤去装置④中的冷水浴,可能导致 产品中混有的杂质是 。 (4)设计实验检验所得 NaClO2 晶体中是否含有杂质 Na2SO4,操作与现象是取少量晶体溶于蒸 馏水, 。 (5)为了测定 NaClO2 粗品的纯度,取上述粗产品 10.0 g 溶于水配成 1 L 溶液,取出 10 mL 溶液 于锥形瓶中,再加入足量酸化的 KI 溶液,充分反应后(NaClO2 被还原为 Cl-,杂质不参加反应), 加入 2~3 滴淀粉溶液,用 0.20 mol·L-1Na2S2O3 标准液滴定,达到滴定终点时用去标准液 20.00 mL,则 NaClO2 粗品的纯度为 。(提示:2Na2S2O3+I2 Na2S4O6+2NaI) 素材 12I-、I2、I-3、KIO3 的性质 1.I-、I2、I-3 (1)I2易溶于酒精,可制成碘酒;I2在水中的溶解度较小,但有 I-存在时,I2的溶解性增强:I2+I- I-3。 18 (2)I-3具有 I-和 I2 的性质;I-、I-3均具有还原性,能被 Fe3+、HNO3 等氧化。 2.KIO3 用单质碘与热的 KOH 溶液反应可制取 KIO3,3I2+6KOH KIO3+5KI+3H2O。医药上作防治地方 甲状腺肿病的加碘剂。 3.碘量法在定量分析中的应用 碘量法是氧化还原滴定中应用较为广泛的一种方法,在近年的高考试题中多次出现,用于测 定物质纯度等。碘量法可用淀粉作指示剂指示反应终点。 (1)直接碘量法 直接碘量法是用标准碘滴定液直接滴定具有还原性物质(待测样品)的方法。在滴定过程 中,I2 被还原为 I-;直接碘量法只能在弱酸性、中性或弱碱性溶液中进行,在强酸性条件下发 生反应 4I-+O2+4H+ 2I2+2H2O;在强碱性条件下发生反应 3I2+6OH- IO-3+5I-+3H2O,从而使 测定结果不准确。直接碘量法测定 Na2S2O3 溶液的浓度的滴定原理:I2+2S2O2-3 S4O2-6 +2I-。 (2)剩余碘量法 剩余碘量法是先在具有还原性物质(待测样品)中加入定量、过量的标准碘滴定液,待 I2 与待 测样品组分反应完全后,再用硫代硫酸钠标准溶液滴定剩余的碘,以求出待测样品纯度等的 方法。滴定原理:I2(定量、过量)+还原性物质(待测样品) I-+氧化产物,I2(剩余)+2S2O2-3 2I-+S4O2-6 。 (3)置换碘量法 置换碘量法亦称为滴定生成物法,是先在具有氧化性物质(待测样品)中加入过量碘化钾溶液, 待测样品将碘化钾氧化,析出定量的碘,再用硫代硫酸钠标准溶液滴定析出的碘,从而可求出 待测样品纯度等。滴定原理:氧化性物质(待测样品)+I - I2+还原产物,I2+2S2O2-3 S4O2-6 +2I-。 考点扫描 1.[2018 全国卷Ⅲ,26(2)改编]取 0.00950mol·L-1 的 K2Cr2O7 标准溶液 20.00mL,硫酸酸化后 加入过量 KI,发生反应:Cr2O2-7 +6I-+14H+ 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定 至淡黄绿色,发生反应:I 2+2S2O2-3 S4O2-6 +2I-。加入淀粉溶液作为指示剂,继续滴定,当溶 液 , 即为终点。平行滴定 3 次, 样品溶液的平均用量为 24.80mL, 则样品纯度 为 %(保留 3 位有效数字)。 19 2.[2018 江苏,7B]酸化 NaIO3 和 NaI 的混合溶液:I-+IO-3+6H+ I2+3H2O( ) 3.[2017 全国卷Ⅲ,9B 改编]清洗碘升华实验所用试管,先用酒精清洗,再用水清洗( ) 4.[2017 海南,7B]碘化钾与浓硫酸反应可制备碘化氢( ) 提示:1.蓝色褪去 95.0 2.✕ 3.√ 4.✕ 7.[2019 安徽江淮十校三联]某实验小组欲探究 Cl2 与 KI 溶液的反应,设计的实 验装置如图所示。已知:I2 在水中溶解度很小,在 KI 溶液中溶解度显著增大,其原因为 I2+I- I-3。 回答下列问题: (1)仪器 A 使用前必须进行的操作是 ,仪器 B 的名称是 。 (2)该实验装置存在的明显缺陷是 ,改进之后,进行后续实验。 (3)仪器 C 中的试剂是 ,当仪器 E 中出现 时,停止加热。 (4)当氯气开始进入仪器 D 中时,观察到仪器 D 中的现象是 ;不断向仪器 D 中通入氯 气,看到溶液颜色逐渐加深,后来出现深褐色沉淀,试运用平衡移动原理分析产生这些现象的 原因: 。 (5)持续不断地向仪器 D 中通入氯气,观察到仪器 D 中液体逐渐澄清,最终呈无色。实验小组 同学猜想,仪器 D 中无色溶液里的含碘物质可能是 HIO3。 ①按照实验小组同学的猜想,用化学方程式解释“仪器 D 中液体逐渐澄清,最终呈无色”的原 因: 。 ②为了验证猜想是否正确,实验小组又进行了如下实验: 20 i.取反应后仪器 D 中溶液 5.00 mL 于锥形瓶中,加入过量 KI 和足量稀硫酸。 ii.向上述锥形瓶中滴加淀粉,溶液变蓝,用0.625 mol/L的Na 2S2O3溶液滴定至蓝色刚好褪去, 消耗 Na2S2O3 溶液 V mL。 已知:2HIO3+10KI+5H2SO4 6I2+5K2SO4+6H2O、I2+2S2O2-3 2I-+S4O2-6 。若 V= 时,说 明实验小组同学的猜想正确。 (6)欲检验某溶液中是否含有 I-,可使用的试剂为溴水和四氯化碳。合理的实验操作为 。查看更多