- 2021-04-13 发布 |
- 37.5 KB |
- 17页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习难溶电解质的溶解平衡作业(1)
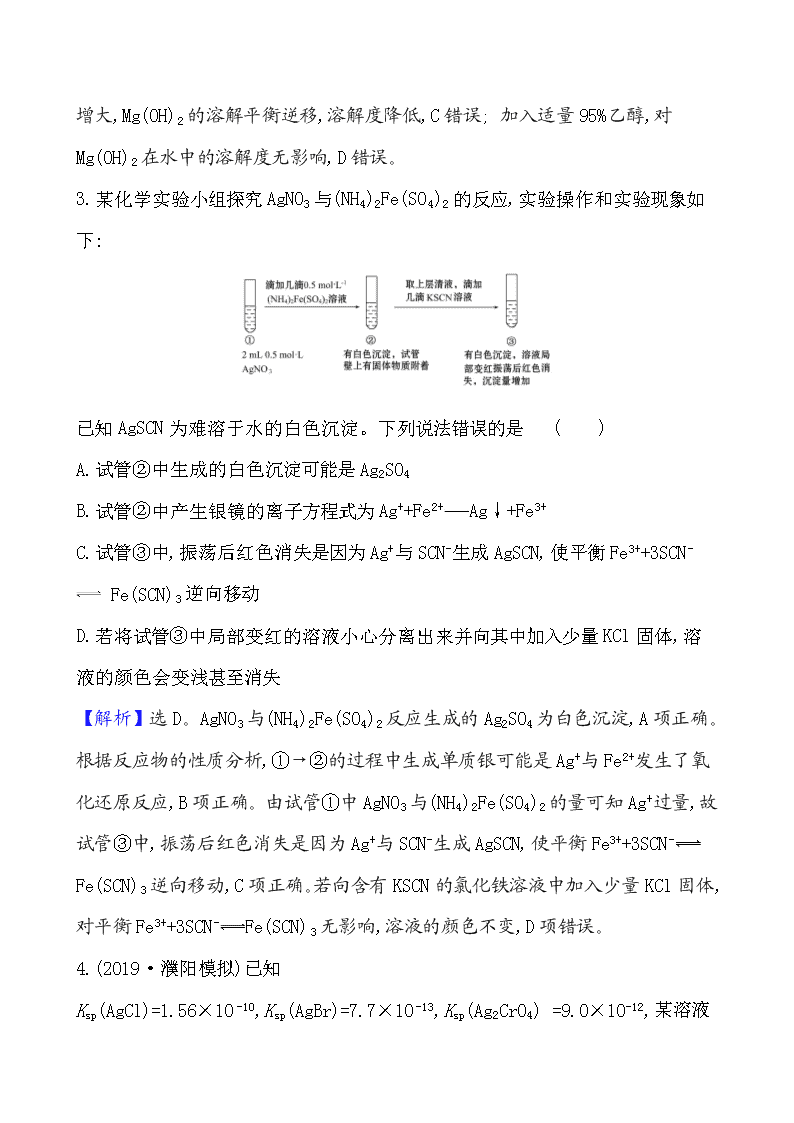
课时分层提升练 二十七 难溶电解质的溶解平衡 一、选择题 1.(2019·玉溪模拟)下列说法中,正确的是 ( ) A.两种难溶盐电解质,其中Ksp小的溶解度一定小 B.溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉淀 C.难溶盐电解质的Ksp与温度有关 D.同离子效应使难溶盐电解质的溶解度变小,也使Ksp变小 【解析】选C。只有相同类型的难溶电解质,Ksp越小,溶解度可能会小,不同类型的难溶电解质,不能根据Ksp判断溶解度的大小,A错误; 生成沉淀的先后还与离子的浓度有关,B错误;化学反应平衡常数只与反应本身的性质和温度有关,当难溶物确定时就只和温度有关了,与溶液中离子浓度无关,C正确;Ksp只与温度有关,D错误。 2.(2019·铜川模拟)欲增大Mg(OH)2在水中的溶解度,可采用的方法是( ) A.增大pH B.加入2.0 mol·L-1 NH4Cl C.加入0.1 mol·L-1MgSO4 D.加入适量95%乙醇 【解析】选B。增大溶液pH,溶液中c(OH-)增大,Mg(OH)2的溶解平衡逆移,溶解度降低,A错误; 加入2.0 mol·L-1NH4Cl,由于N与OH-结合使溶液中c(OH-)减小,Mg(OH)2的溶解平衡正移,溶解度增大,B正确;加入0.1 mol·L-1MgSO4,c(Mg2+) 增大,Mg(OH)2的溶解平衡逆移,溶解度降低,C错误; 加入适量95%乙醇,对Mg(OH)2在水中的溶解度无影响,D错误。 3.某化学实验小组探究AgNO3与(NH4)2Fe(SO4)2的反应,实验操作和实验现象如下: 已知AgSCN为难溶于水的白色沉淀。下列说法错误的是 ( ) A.试管②中生成的白色沉淀可能是Ag2SO4 B.试管②中产生银镜的离子方程式为Ag++Fe2+Ag↓+Fe3+ C.试管③中,振荡后红色消失是因为Ag+与SCN-生成AgSCN,使平衡Fe3++3SCN- Fe(SCN)3逆向移动 D.若将试管③中局部变红的溶液小心分离出来并向其中加入少量KCl固体,溶液的颜色会变浅甚至消失 【解析】选D。AgNO3与(NH4)2Fe(SO4)2反应生成的Ag2SO4为白色沉淀,A项正确。根据反应物的性质分析,①→②的过程中生成单质银可能是Ag+与Fe2+发生了氧化还原反应,B项正确。由试管①中AgNO3与(NH4)2Fe(SO4)2的量可知Ag+过量,故试管③中,振荡后红色消失是因为Ag+与SCN-生成AgSCN,使平衡Fe3++3SCN- Fe(SCN)3逆向移动,C项正确。若向含有KSCN的氯化铁溶液中加入少量KCl固体,对平衡Fe3++3SCN-Fe(SCN)3无影响,溶液的颜色不变,D项错误。 4.(2019·濮阳模拟)已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4) =9.0×10-12, 某溶液中含有Cl-, Br-和Cr,浓度均为0.010 mo1·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( ) A.Cl- 、Br-、Cr B.Cr、Br-、Cl- C.Br-、Cl-、Cr D.Br- 、Cr、Cl- 【解析】选C。析出沉淀时,AgCl溶液中c(Ag+)==mol·L-1 =1.56×10-8 mol·L-1;AgBr溶液中c(Ag+)== mol·L-1=7.7× 10-11 mol·L-1;Ag2CrO4溶液中c(Ag+)== mol·L-1=3× 10-5 mol·L-1;c(Ag+)越小,则越先生成沉淀,所以这三种阴离子产生沉淀的先后顺序为Br-、Cl-、Cr,C项正确。 5.可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:某温度下,Ksp(BaCO3)=5.1×10-9;Ksp(BaSO4)=1.1×10-10。下列推断正确的是 ( ) A.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4) B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替 C.若误饮c(Ba2+)=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒 D.可以用0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃 【解析】选D。胃液中为盐酸环境,难溶的碳酸盐在胃液中会溶解,故A、B错误;硫酸钡作内服造影剂,说明硫酸钡电离出的钡离子浓度是安全的,此时c(Ba2+) ==1.05×10-5mol·L-1>1.0×10-5mol·L-1,故误饮c(Ba2+)=1.0 ×10-5mol·L-1的溶液时,不会引起钡离子中毒,故C错误;用0.36 mol·L-1的Na2SO4溶液洗胃时,胃液中:c(Ba2+)== mol·L-1=3.1×10-10mol·L-1 <1.05×10-5mol·L-1,故D正确。 6.(2019·潍坊模拟)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是 ( ) A.溴酸银的溶解是放热过程 B.温度升高时溴酸银溶解速度加快 C.60 ℃时溴酸银的Ksp约等于6×10-4 D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 【解析】选A。随着温度升高溶解度逐渐增大,所以溴酸银的溶解是吸热过程,A选项错误;温度升高时,溴酸银溶解度增大,所以温度升高时溴酸银的溶解速度加快,B选项正确;C选项,60 ℃时1 L水中约溶解6 g AgBrO3,c(Ag+)=c(Br) =c(AgBrO3)=≈0.025 mol·L-1,Ksp=c(Ag+)·c(Br)≈6×10-4,正确;根据图象可知,溴酸银的溶解度受温度的影响不大,而硝酸钾的溶解度受温度影响较大,所以硝酸钾中含有少量溴酸银,可用重结晶方法提纯。 7.(2019·长沙模拟)已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12如图是向10 mL AgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线)。根据图象所得下列结论正确的是 ( ) (提示:KspAgCl>KspAgI) A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1 B.图中x点的坐标为(100,6 ) C.图中x点表示溶液中Ag+ 被恰好完全沉淀 D.把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图象在终点后变为虚线部分 【解析】选B。当氯化钠溶液的体积是0时,pAg=0,所以硝酸银溶液的浓度是 1.0 mol·L-1的,A错误;pAg=6时,二者恰好反应,所以氯化钠溶液的体积是 100 mL,B正确;当溶液中离子的浓度小于1.0×10-5mol·L-1时即可以认为沉淀达到完全,而x点溶液中银离子的浓度是1.0×10-5mol·L-1,C错误;由于碘化银的溶解度小于氯化银的,所以如果换成0.1 mol·L-1 NaI,则图象在终点后变为应该再实线的左侧,D错误。 二、非选择题 8.(2019·南昌模拟)已知25℃时,Ksp[Cu(OH)2]=2×10-20。 (1)某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。 (2)要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________。 【解析】 (1)根据题意:当c(Cu2+)·c(OH-)2=2×10-20时开始出现沉淀,则c(OH-)= = =10-9 mol·L-1,c(H+)=10-5 mol·L-1,pH=5,所以要生成Cu(OH)2沉淀,应调整pH>5。 (2)要使Cu2+浓度降至0.2 mol·L-1/1 000=2×10-4 mol·L-1,c(OH-)== 10-8 mol·L-1,c(H+)=10-6 mol·L-1。此时溶液的pH=6。 答案: (1)5 (2)6 9.(2019·武汉模拟)某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知: 物质 BaSO4 BaCO3 AgI AgCl 溶解度/g (20℃) 2.4×10-4 1.4×10-3 3.0×10-7 1.5×10-4 (1)探究 BaCO3和 BaSO4之间的转化 试剂A 试剂B 试剂C 加入盐酸后的现象 实验Ⅰ BaCl2 Na2CO3 Na2SO4 …… 实验Ⅱ Na2SO4 Na2CO3 有少量气泡产生, 沉淀部分溶解 ①实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,__________ ______。 ②实验Ⅱ中加入稀盐酸后发生反应的离子方程式是 ____________________。 ③实验Ⅱ 中加入试剂C后,沉淀转化的平衡常数表达式K=________。 (2)探究AgCl和AgI之间的转化 实验Ⅲ: 实验 Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b >0)。 装置 步骤 电压表读数 ⅰ.如图连接装置并加入试剂,闭合K a ⅱ.向B中滴入AgNO3(aq),至沉淀完全 b ⅲ.再向B中投入一定量NaCl(s) c ⅳ.重复ⅰ,再向B中加入与ⅲ等量的NaCl(s) d 注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。 ①实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是 (填字母)。 a.AgNO3溶液 b.NaCl溶液 C.KI溶液 ②实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是 ____________________。 ③结合信息,解释实验Ⅳ中b查看更多