- 2021-04-13 发布 |
- 37.5 KB |
- 31页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习化学常用计量课件(31张)(全国通用)
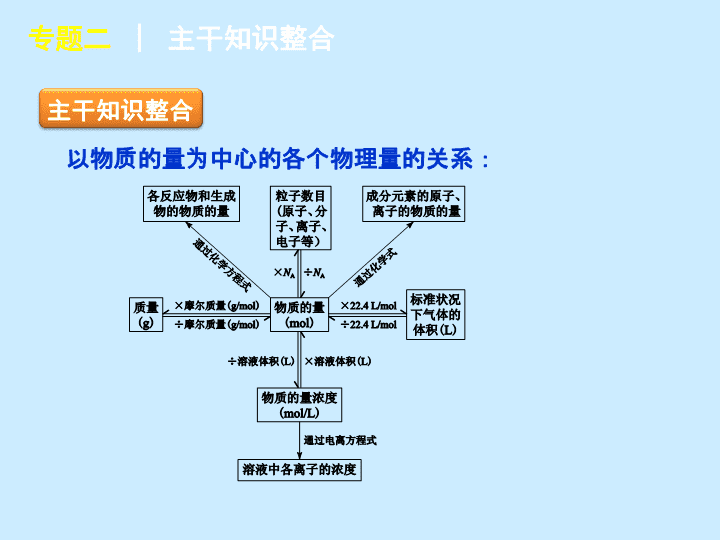
专题二 化学常用计量 专题二 化学常用计量 主干知识整合 专题二 │ 主干知识整合 以物质的量为中心的各个物理量的关系: 要点热点探究 专题二 │ 要点热点探究 ► 探究点一 阿伏加德罗常数的应用 有关阿伏加德罗常数的应用问题,需要特别注意的有: 1 .条件:考查气体时经常给定非标准状况,如常温常压下 (1.0 × 10 5 Pa 、 25 ℃ 时 ) 等。 2 .物质状态:考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如 H 2 O 、 SO 3 、己烷、 CHCl 3 等。 3 .物质结构:考查一定物质的量的物质中含有多少微粒 ( 分子、原子、电子、质子、中子等 ) 时常涉及稀有气体 He 、 Ne 等单原子分子, Cl 2 、 N 2 、 O 2 等双原子分子,以及 O 3 、 P 4 等。 专题二 │ 要点热点探究 4 .氧化还原反应:考查指定物质参加氧化还原反应时,常设置氧化还原反应中氧化剂、还原剂、氧化产物、还原产物、电子转移 ( 得失 ) 数目方面的陷阱。如: Na 2 O 2 + H 2 O 、 Cl 2 + NaOH 、电解 AgNO 3 溶液、 Cu 与 S 反应等。 5 .电离、水解:考查电解质溶液中粒子数目或浓度时常设置弱电解质的电离、盐类水解方面的陷阱。 6 .一些物质中的化学键数目:如 SiO 2 、 Si 、 CH 4 、 P 4 、 S 8 、烃 ( 如烷烃中单键数 ) 等。 7 .常见的可逆反应:如 2NO 2 N 2 O 4 ,弱电解质的电离平衡等。 8 .摩尔质量:特殊物质如 D 2 O 、 18 O 2 等。 专题二 │ 要点热点探究 例 1 设 N A 为阿伏加德罗常数的值。下列叙述正确的是 ( ) A . 1 mol 甲醇中含有 C - H 键的数目为 4 N A B . 25 ℃ , pH = 13 的 NaOH 溶液中含有 OH - 的数目为 0.1 N A C .标准状况下, 2.24 L 己烷含有分子的数目为 0.1 N A D .常温常压下, Na 2 O 2 与足量 H 2 O 反应,共生成 0.2 mol O 2 ,转移电子的数目为 0.4 N A 专题二 │ 要点热点探究 D 【 解析 】 1 mol 甲醇中含有 3 mol C - H 键, A 错; pH = 13 的 NaOH 溶液 c (OH - ) = 0.1 mol/L ,由于没有提供溶液体积, OH - 的数目无法确定, B 错;己烷在标准状况下为液体,不适用气体摩尔体积, C 错; 2Na 2 O 2 + 2H 2 O==4NaOH + O 2 ↑ 中,生成 0.2 mol O 2 ,转移 0.4 mol e - , D 对。 专题二 │ 要点热点探究 【 点评 】 本题为阿伏加德罗常数应用的常见题型,这类试题的知识覆盖面和综合性较强,但难度往往不大。解决该类试题的要点就是“细心、防陷阱”,注意一些平时易忽视的知识点。 专题二 │ 要点热点探究 变式题 设 N A 是阿伏加德罗常数的数值,下列说法正确的是 ( ) A . 1 mol Al 3 + 离子含有的核外电子数为 3 N A B . 1 mol Cl 2 与足量的铁反应,转移的电子数为 3 N A C . 10 L pH = 1 的硫酸溶液中含有的 H + 离子数为 2 N A D . 10 L pH = 13 的 NaOH 溶液中含有的 OH - 离子数为 N A 专题二 │ 要点热点探究 D 【 解析 】 Al 3 + 离子核外电子数为 10 个, 1 mol Al 3 + 离子含有的核外电子数应为 10 N A ,故 A 错; 2Fe + 3Cl 2 ===2FeCl 3 ,反应中转移 6 个电子, 1 mol Cl 2 反应转移的电子数应为 2 N A ,故 B 错; pH = 1 时 c (H + ) = 0.1 mol·L - 1 , n (H + ) = 1 mol ,故 C 错; pH = 13 时 c (OH - ) = 0.1 mol·L - 1 , n (OH - ) = 1 mol, 故 D 对。 专题二 │ 要点热点探究 例 2 用 N A 表示阿伏加德罗常数的值。下列说法正确的是 ( ) A . 1.8 g 重水 (D 2 O) 中含有的质子数为 N A B . 500 ℃ 、 30 MPa 下: N 2 (g) + 3H 2 (g)2NH 3 (g) Δ H =- 38.6 kJ·mol - 1 ,将 1.5 N A 个 H 2 和过量 N 2 在此条件下充分反应,放出热量为 19.3 kJ C .标准状况下, 11.2 L Cl 2 通入足量的石灰乳中制备漂白粉,转移的电子数为 0.5 N A D . 0.1 mol·L - 1 氯化铝溶液中含有 Al 3 + 数为 0.1 N A 专题二 │ 要点热点探究 C 【 解析 】 重水的摩尔质量为 20 g·mol - 1 ,一个重水分子中含有 10 个质子,故 1.8 g 重水中含有的质子数为 0.9 N A , A 项错误; 1.5 mol H 2 在合成氨反应中不可能完全转化,放出的热量小于 19.3 kJ , B 项错误;制取漂白粉的反应中,氯气既是氧化剂又是还原剂, 1 mol Cl 2 参加反应转移电子 1 mol , C 项正确;氯化铝溶液中 Al 3 + 能发生水解且题中未告知溶液的体积,故无法求算 Al 3 + 的数目, D 项错误。 专题二 │ 要点热点探究 ► 探究点二 以物质的量为核心的有关计算 1 .一定物质的量的物质溶于水求算溶质的物质的量浓度时要注意以下两点: (1) 溶液的体积不能用溶剂水的体积和溶质的体积之和来代替,应该用溶液的质量除以溶液的密度; (2) 物质溶于水后注意看溶质是否发生了变化。如 Na 、 Na 2 O 2 、 NO 2 、 SO 3 等溶于水,由于它们与水反应,所以溶质发生了变化。 2 .用气体摩尔体积 22.4 L·mol - 1 进行气体的物质的量与体积的换算时,要注意气体所处的状态是否是在标准状况下。 专题二 │ 要点热点探究 3 .相同溶质的溶液混合时,有以下两种情况: (1) 溶质相同的两溶液等质量混合时,混合溶液的溶质的质量分数为两溶液溶质质量分数之和的一半。 (2) 溶质相同的两溶液等体积混合时: ① 对于密度小于 1 g·cm - 3 的溶液,如氨水、乙醇的水溶液,等体积混合时溶质的质量分数小于两溶液溶质质量分数之和的一半; ② 对于密度大于 1 g·cm - 3 的溶液,如硫酸溶液、盐酸,等体积混合时溶质的质量分数大于两溶液溶质质量分数之和的一半。 专题二 │ 要点热点探究 例 3 图 2 - 1 是某学校实验室从化学试剂商店买回来的硫酸试剂标签上的部分内容。据此下列说法正确的是 ( ) A .该硫酸的物质的量浓度为 9.2 mol·L - 1 B .该硫酸 50 mL 与足量的铜反应可得到 标准状况下 SO 2 0.46 mol C .要配制 250 mL 4.6 mol·L - 1 的稀硫 酸需取该硫酸 62.5 mL D .等质量的水与该硫酸混合所得溶液 的物质的量浓度大于 9.2 mol·L - 1 专题二 │ 要点热点探究 【 解析 】 由 c = 可算出该硫酸的物质的量浓度 为 18.4 mol·L - 1 , A 项不正确。随着反应进行,硫酸逐渐变稀而导致反应终止,所以产生 SO 2 小于 0.46 mol , B 项错误;由稀释定律,可得出所用硫酸体积为 62.5 mL , C 项正确;等质量的硫酸和水,硫酸的密度大,硫酸的体积远小于水,二者等质量混合后,硫酸的浓度小于原浓度的一半, D 项错误。 专题二 │ 要点热点探究 【 点评 】 以物质的量为中心的计算需注意的问题: 1 .“一个中心”:必须以物质的量为中心。 2 .“两个前提”:在应用 V m = 22.4 L·mol - 1 时,一定要有“标准状况”和“气体状态”两个前提 ( 混合气体也适用 ) 。 专题二 │ 要点热点探究 3 .“三个关系”:①直接构成物质的粒子与间接构成物质的粒子 ( 原子、电子等 ) 间的关系;②摩尔质量与相对分子质量间的关系;③“强、弱、非”电解质与溶质粒子 ( 分子或离子 ) 数之间的关系。 4 .“七个无关”:物质的量、质量、粒子数的多少均与温度、压强的高低无关;物质的量浓度的大小与所取该溶液的体积多少无关 ( 但溶质粒子数的多少与溶液体积有关 ) 。 专题二 │ 要点热点探究 变式题1 下列叙述正确的是 ( ) A . 1.00 mol NaCl 中含有 6.02×10 23 个 NaCl 分子 B . 1.00 mol NaCl 中,所有 Na + 的最外层电子总数为 8×6.02×10 23 C .欲配制 1.00 L ,1.00 mol·L - 1 的 NaCl 溶液,可将 58.5 g NaCl 溶于 1.00 L 水中 D .电解 58.5 g 熔融的 NaCl ,能产生 22.4 L 氯气 ( 标准状况 ) 、 23.0 g 金属钠 专题二 │ 要点热点探究 B 【 解析 】 NaCl 为离子晶体,是由 Na + 和 Cl - 直接构成的,不存在分子, A 项错误; Na + 最外层电子数为 8 ,因此, 1.00 mol Na + 最外层电子数为 8 × 6.02 × 10 23 , B 项正确;溶液的体积不是 1.00 L , C 项错误; D 项产生氯气的体积应为 11.2 L( 标准状况 ) 。 专题二 │ 要点热点探究 变式题2 标准状况下 V L 氨气溶解在 1 L 水中 ( 水的密度近似为 1 g·mL - 1 ,所得溶液的密度为 ρ g·mL - 1 ,质量分数为 w ,物质的量浓度为 c mol·L - 1 ,则下列关系中不正确的是 ( ) 专题二 │ 要点热点探究 A 【 解析 】 专题二 │ 要点热点探究 例 4 Ⅰ. 磷、硫元素的单质和化合物应用广泛。 (1) 磷元素的原子结构示意图是 ____________ 。 (2) 磷酸钙与焦炭、石英砂混合,在电炉中加热到 1500 ℃ 生成白磷,反应为: 2Ca 3 (PO 4 ) 2 + 6SiO 2 ==6CaSiO 3 + P 4 O 10 10C + P 4 O 10 ===P 4 + 10CO 每生成 1 mol P 4 时,就有 ________ mol 电子发生转移。 专题二 │ 要点热点探究 (3) 硫代硫酸钠 (Na 2 S 2 O 3 ) 是常用的还原剂。在维生素 C( 化学式 C 6 H 8 O 6 ) 的水溶液中加入过量 I 2 溶液,使维生素 C 完全氧化,剩余的 I 2 用 Na 2 S 2 O 3 溶液滴定,可测定溶液中维生素 C 的含量。发生的反应为: 在一定体积的某维生素 C 溶液中加入 a mol·L - 1 I 2 溶液 V 1 mL ,充分反应后,用 Na 2 S 2 O 3 溶液滴定剩余的 I 2 ,消耗 b mol·L - 1 Na 2 S 2 O 3 溶液 V 2 mL 。该溶液中维生素 C 的物质的量是 ________mol 。 专题二 │ 要点热点探究 (4) 在酸性溶液中,碘酸钾 (KIO 3 ) 和亚硫酸钠可发生如下反应: 生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示: 0.01 mol·L - 1 KIO 3 酸性溶液 ( 含淀粉 ) 的体积 / mL 0.01 mol· L - 1 Na 2 SO 3 溶液的体积 / mL H 2 O 的 体积 / mL 实验 温度 / ℃ 溶液出现蓝色时所需时间 /s 实验 1 5 V 1 35 25 实验 2 5 5 40 25 实验 3 5 5 V 2 0 专题二 │ 要点热点探究 该实验的目的是 __________________ ;表中 V 2 = ________ mL 。 Ⅱ. 稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。 (5) 铈 ( Ce ) 是地壳中含量最高的稀土元素,在加热条件下 CeCl 3 易发生水解,无水 CeCl 3 可用加热 CeCl 3 ·6H 2 O 和 NH 4 Cl 固体混合物的方法来制备。其中, NH 4 Cl 的作用是 ________ 。 (6) 在某强酸性混合稀土溶液中加入 H 2 O 2 ,调节 pH≈3 。 Ce 3 + 通过下列反应形成 Ce(OH) 4 沉淀得以分离。完成反应的离子方程式: 专题二 │ 要点热点探究 【 答案 】(1) (2)20 (3) ( 其他合理答案也可 ) (4) 探究该反应的速率与温度、亚硫酸钠溶液浓度的关系 ( 其他合理答案也可 ) 40 (5) 分解出 HCl 气体,抑制 CeCl 3 水解 ( 或其他合理答案 ) (6)2 1 6 2 6H + 专题二 │ 要点热点探究 【 解析 】 (1)P 元素为 15 号元素,根据核外电子排布规律其原子结构示意图为 。 (2) 在 P 4 O 10 中 P 的化合价为+ 5 价,当生成 1 mol P 4 转移电子数为 20 mol 。 (3) 第二个反应消耗 Na 2 S 2 O 3 的物质的量为: b mol·L - 1 × V 2 10 - 3 L = V 2 b 10 - 3 mol ,则第一个反应剩余的 I 2 的物质的量为 0.5 V 2 b 10 - 3 mol ,该过程加入 I 2 总的物质的量为 a mol·L - 1 × V 1 10 - 3 L = V 1 a 10 - 3 mol ,则参加第一个反应的 I 2 的物质的量为 V 1 a 10 - 3 mol - 0.5 V 2 b 10 - 3 mol ,则该溶液中维生素 C 的物质的量为 V 1 a 10 - 3 mol - 0.5 V 2 b 10 - 3 mol = ( V 1 a - 0.5 V 2 b )10 - 3 mol 。 专题二 │ 要点热点探究 (4) 实验 1 和实验 2 温度相同但加水体积不同,而实验 2 和实验 3 温度不同则加水体积应该相同,故 V 2 = 40 ,有 3 个实验所给出的不同对比数据可得出该实验目的为:探究该反应的速率与温度、亚硫酸钠浓度的关系。 (5)CeCl 3 发生水解的方程式为: CeCl 3 + 3H 2 O Ce(OH) 3 + 3HCl , NH 4 Cl 固体加热可分解生成 HCl ,起到抑制 CeCl 3 水解的作用。 (6) 根据电荷守恒:反应物中有阳离子,则生成物中必然要有阳离子,由题意知溶液 pH = 3 ,故最后一个空应为 H + ;根据氧化还原反应方程式的配平原则,分析反应中的化合价变化, H 2 O 2 中两个 O 的化合价从- 1 → - 2 ,得到 2 个电子, Ce 元素的化合价从+ 3 → + 4 ,应该失去两个电子,综合得失电子守恒和质量守恒,可配平出 2Ce 3 + + H 2 O 2 + 6H 2 O===2Ce(OH) 4 + 6H + 。 专题二 │ 教师备用习题 教师备用习题 1 .把 500 mL 含有 BaCl 2 和 KCl 的混合溶液分成 5 等份,取一份加入含 a mol 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含 b mol 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为 ( ) A . 0.1( b - 2 a )mol·L - 1 B . 10(2 a - b )mol·L - 1 C . 10( b - a )mol·L - 1 D . 10( b - 2 a )mol·L - 1 专题二 │ 教师备用习题 专题二 │ 教师备用习题 【 高考命题者说 】 这是一道关于混合溶液中离子浓度计算的概念题,在认知能力要求中,属于理解层次的题目。考生只要对溶液浓度的概念清楚,经过细心分析就可得到正确答案。 本题抽样统计难度为 0.730 ,区分度为 0.482 。查看更多