- 2021-04-13 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】山东省济宁一中2020届高三下学期二轮质量检测
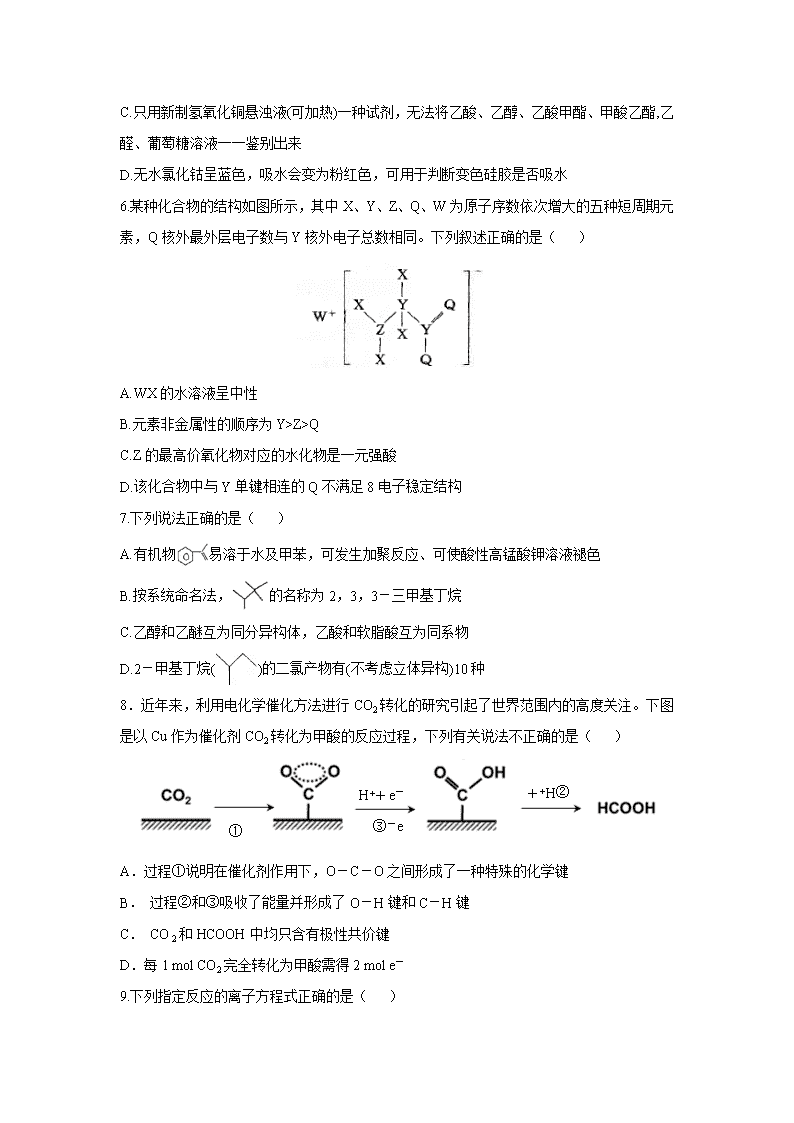
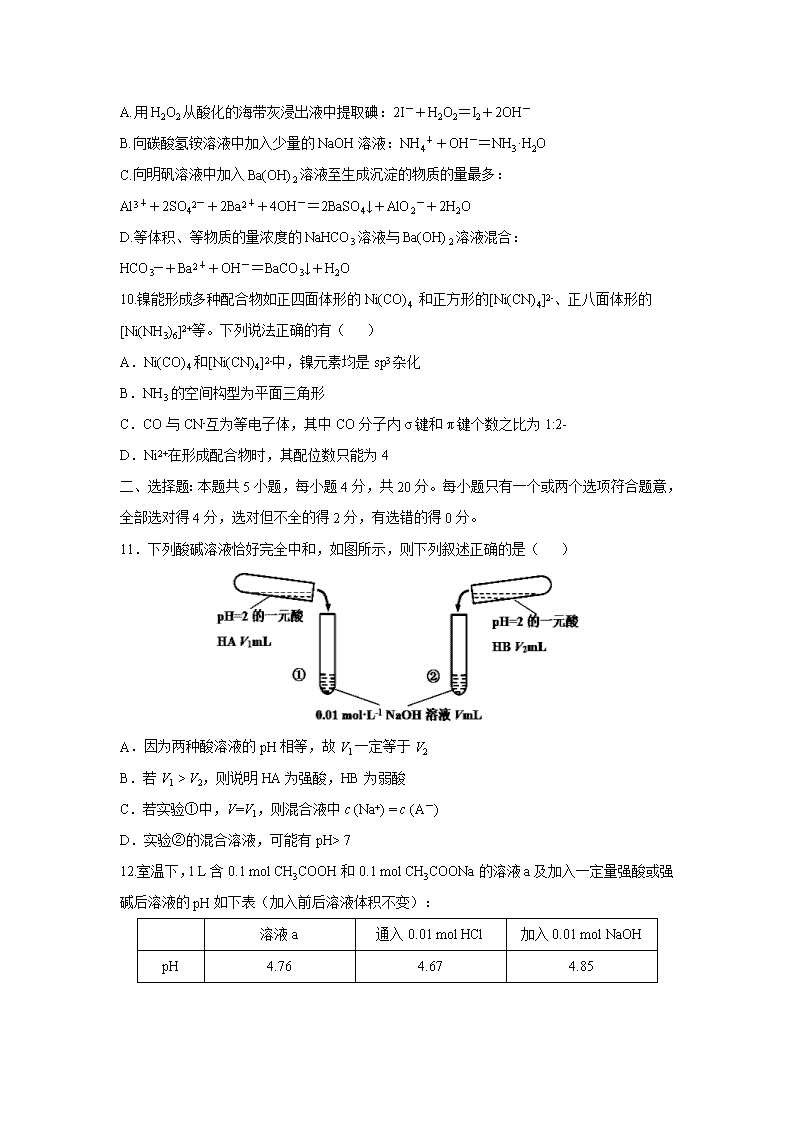
山东省济宁一中2020届高三下学期二轮质量检测 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Zn 65 Fe 56 Cu 64 一、选择题:本题共10小题,每小题2分,共20分.每小题只有—个选项符合题意. 1.《天工开物》曾记载“凡皂(青)、红、黄矾,皆出一种而成,变化其质……乃即炼皂矾,炉侧土墙……冷静之时,其墙上自然爆出此种……刮取下来,名曰黄矾。”这里的皂矾是指( ) A.FeSO4·7H2O B.ZnSO4·7H2O C.Fe2(SO4)3·9H2O D.Fe2O3·nH2O 2.下列有关化学用语表示正确的是( ) A.对硝基甲苯的结构简式: B.离子结构示意图既可以表示35Cl-,也可以表示37Cl- C.NH5的结构与NH4Cl相似,NH5的结构式: D.CO2的比例模型: 3.设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.23 g C2H6O分子中含C-H键数目一定为2.5NA B.常温常压下,22.4 L O2气体的分子数小于NA C.6 g C18O和14CO的混合物中所含电子、中子数目均为2.8NA D.40 mL 10 mol/L盐酸与足量MnO2共热,转移的电子数为0.2NA 4.“太阳能燃料”国际会议于2019年10月在我国武汉举行,旨在交流和探讨太阳能光催化分解水制氢、太阳能光催化二氧化碳转化为燃料等问题。下列说法错误的是( ) A太阳能燃料属于一次能源 B.直接电催化CO2制取燃料时,燃料是阴极产物 C.用光催化分解水产生的H2是理想的绿色能源 D.研发和利用太阳能燃料,有利于经济的可持续发展 5.下列说法不正确的是( ) A.青蒿素的提取及在医学上的应用、第一次人工合成蛋白质结晶牛胰岛素,都是中国化学家的科研成果 B.可用加水溶解后测pH值的方法鉴别氯化钠与亚硝酸钠 C.只用新制氢氧化铜悬浊液(可加热)一种试剂,无法将乙酸、乙醇、乙酸甲酯、甲酸乙酯,乙醛、葡萄糖溶液一一鉴别出来 D.无水氯化钴呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水 6.某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同。下列叙述正确的是( ) A.WX的水溶液呈中性 B.元素非金属性的顺序为Y>Z>Q C.Z的最高价氧化物对应的水化物是一元强酸 D.该化合物中与Y单键相连的Q不满足8电子稳定结构 7.下列说法正确的是( ) A.有机物易溶于水及甲苯,可发生加聚反应、可使酸性高锰酸钾溶液褪色 B.按系统命名法,的名称为2,3,3-三甲基丁烷 C.乙醇和乙醚互为同分异构体,乙酸和软脂酸互为同系物 D.2-甲基丁烷()的二氯产物有(不考虑立体异构)10种 8.近年来,利用电化学催化方法进行CO2转化的研究引起了世界范围内的高度关注。下图是以Cu作为催化剂CO2转化为甲酸的反应过程,下列有关说法不正确的是( ) ① H++e- ③-e++H② A.过程①说明在催化剂作用下,O-C-O之间形成了一种特殊的化学键 B. 过程②和③吸收了能量并形成了O-H键和C-H键 C. CO 2和HCOOH中均只含有极性共价键 D.每1 mol CO2完全转化为甲酸需得2 mol e- 9.下列指定反应的离子方程式正确的是( ) A.用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- B.向碳酸氢铵溶液中加入少量的NaOH溶液:NH4++OH-=NH3·H2O C.向明矾溶液中加入Ba(OH)2溶液至生成沉淀的物质的量最多: Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O D.等体积、等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合: HCO3—+Ba2++OH-=BaCO3↓+H2O 10.镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有( ) A.Ni(CO)4和[Ni(CN)4]2-中,镍元素均是sp3杂化 B.NH3的空间构型为平面三角形 C.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2- D.Ni2+在形成配合物时,其配位数只能为4 二、选择题:本题共5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。 11.下列酸碱溶液恰好完全中和,如图所示,则下列叙述正确的是( ) A.因为两种酸溶液的pH相等,故V1一定等于V2 B.若V1 > V2,则说明HA为强酸,HB为弱酸 C.若实验①中,V=V1,则混合液中c (Na+) = c (A-) D.实验②的混合溶液,可能有pH> 7 12.室温下,1 L含0.1 mol CH3COOH和0.1 mol CH3COONa的溶液a及加入一定量强酸或强碱后溶液的pH如下表(加入前后溶液体积不变): 溶液a 通入0.01 mol HCl 加入0.01 mol NaOH pH 4.76 4.67 4.85 像溶液a这样,加入少量强酸或强碱后pH变化不大的溶液称为缓冲溶液。 下列说法不正确的是 ( ) A.溶液a和 0.1 mol·L−1 CH3COOH溶液中CH3COOH的电离程度前者小于后者 B.向溶液a中通入0.01 mol HCl时,CH3COO−结合H+生成CH3COOH,pH变化不大 C.向溶液a中加入0.1 mol NaOH固体,pH基本不变 D.含0.1 mol·L−1 NH3·H2O与0.1 mol·L−1 NH4Cl的混合溶液也可做缓冲溶液 13.室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是( ) A.Kb2的数量级为10-8 B.X(OH)NO3水溶液显酸性 C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中 c(X2+)>c[X(OH)+] D.在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+) 14 .复旦大学王永刚的研究团队制得一种柔性水系锌电池,该可充电电池以锌盐溶液作为电解液,其原理如图所示。下列说法不正确的是( ) A.放电时,N极发生还原反应 B.充电时,Zn2+向N极移动 C.放电时,每生成1 mol PTO-Zn2+,M极溶解Zn的质量为260g D.充电时,N极的电极反应式为2PTO+8e-+4Zn2+=PTO-Zn2+ 15.反应①是制备SiH4的一种方法,利用其副产物可制备相应物质,有关转化关系如下: 下列说法不正确的是( ) A.A2B的化学式为Mg2Si B.NH3、NH4Cl可以循环使用 C.反应①中参加反应的NH3和NH4Cl的物质的量之比为1∶1 D.反应②中每生成24gMg转移2 mol电子 三、非选择题:本题共5小题,共60分。 16.(12分)叠氮化钠(NaN3)是一种白色剧毒晶体,是汽车安全气囊的主要成分。NaN3易溶于水,微溶于乙醇,水溶液呈弱碱性,能与酸发生反应产生具有爆炸性的有毒气体叠氮化氢。实验室可利用亚硝酸叔丁酯(t-BuNO2,以t-Bu表示叔丁基)与N2H4、氢氧化钠溶液混合反应制备叠氮化钠。 (1)制备亚硝酸叔丁酯 取一定NaNO2溶液与50%硫酸混合,发生反应H2SO4+2NaNO2===2HNO2+Na2SO4。可利用亚硝酸与叔丁醇(t-BuOH)在40 ℃左右制备亚硝酸叔丁酯,试写出该反应的化学方程式:________________________________________________________________________。 (2)制备叠氮化钠(NaN3) 按如图所示组装仪器(加热装置略)进行反应,反应方程式为: t-BuNO2+NaOH+N2H4===NaN3+2H2O+t-BuOH ①装置a的名称是________________; ②该反应需控制温度在65 ℃,采用的实验措施是____________________; ③反应后溶液在0 ℃ 下冷却至有大量晶体析出后过滤,所得晶体使用无水乙醇洗涤。试解释低温下过滤和使用无水乙醇洗涤晶体的原因是______________________________________________。 (3)产率计算 ①称取2.0 g叠氮化钠试样,配成100 mL溶液,并量取10.00 mL溶液于锥形瓶中。 ②用滴定管加入0.10 mol·L-1六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00 mL[发生的反应为2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](假设杂质均不参与反应)。 ③充分反应后将溶液稀释并酸化,滴入2滴邻菲罗啉指示液,并用0.10 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的Ce4+,终点时消耗标准溶液20.00 mL(滴定原理:Ce4++Fe2+===Ce3++Fe3+)。计算可知叠氮化钠的质量分数为__________(保留2位有效数字)。若其他操作及读数均正确,滴定到终点后,下列操作会导致所测定样品中叠氮化钠质量分数偏大的是______(填字母代号)。 A.锥形瓶使用叠氮化钠溶液润洗 B.滴加六硝酸铈铵溶液时,滴加前仰视读数,滴加后俯视读数 C.滴加硫酸亚铁铵标准溶液时,开始时尖嘴处无气泡,结束时出现气泡 D.滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲进瓶内 (4)叠氮化钠有毒,可以使用次氯酸钠溶液对含有叠氮化钠的溶液进行销毁,反应后溶液碱性明显增强,且产生无色无味的无毒气体,试写出反应的离子方程式:____________________________。 17.(14分)工业用黄铜矿(主要成分CuFeS2,含少量锌、铅的硫化物)冶炼铜的一种方法如下: (1)Ⅰ中发生下列反应。 ⅰ.CuFeS2 + 3Cu2+ + 4Cl- = 4CuCl+ Fe2+ +2S ⅱ. CuCl + Cl-CuCl2- I中盐酸的作用是________________________________。 (2)Ⅱ中通入空气,将Fe2+转化FeOOH沉淀。 ①Fe2+转化为FeOOH的离子方程式是________________________________________。 ②溶液A中含金属元素的离子有:Zn2+、Pb2+和______________。 (3)Ⅲ中需控制NaOH溶液的用量,其原因是________________________________。 (4)Ⅳ中加入Na2CO3溶液的目的是______________________________________。 (5)V中反应的离子方程式是__________________________________________________。 (6)从物质循环利用的角度分析,如何处理NaCl溶液才能更好地服务于该冶炼铜的工艺,并说明理由:__________________________________________________。 18..(12分).汽车尾气中含有CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。 (1)已知4CO(g)+2NO2(g)4CO2(g)+N2(g) ΔH=-1200 kJ·mol−1 ①该反应在________________(填“高温、低温或任何温度”)下能自发进行。 ②对于该反应,改变某一反应条件(温度T1>T2),下列图象正确的是_______(填序号)。 ③某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,则该反应的平衡常数为__________;两种方式达平衡时,N2的体积分数:甲______乙(填“>、=、<或不确定”,下同),NO2的浓度:甲______2乙。 (2)柴油汽车尾气中的碳烟(C)和NOx可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图所示。 ①375℃时,测得排出的气体中含0.45mol O2和0.0525mol CO2,则Y的化学式为 。 ②实验过程中采用NO模拟NOx,而不采用NO2的原因是__________________。 19.(11分)周期表中前四周期的元素A、B、C、D,原子序数依次增大,且A、B、C同周期。A共有两个原子轨道上有电子,且电子数目相同。B、C相邻,且C中的未成对电子数为3个,D是人类最早使用的元素,并以这种元素命名了一个时代。请回答下面的问题: (1)A、B、C第一电离能从小到大的顺序为:________(填元素符号),D的价层电子排布图为: _。 (2)在不同的温度下,A以ACl2和二聚体 A2Cl4两种形式存在,二聚体的结构式如下图所示: ①ACl2中A的杂化方式为________。 ②1 mol A2Cl4中含配位键的数目为________。 (3)B元素能形成多种同素异形体,其中一种同素异形体X的晶体结构和晶胞结构如图所示。已知X的密度是a g/cm3,B-B键的键长为r cm,阿伏加德罗常数的值为NA。 X的晶体结构 X的晶体晶胞 ①X中含有的化学键为________。 ②X晶体的层间距离为________。 (4)C元素可以形成两种含氧酸HCO2和HCO3,酸性是HCO3________HCO2(填“强于”或者“弱于”),原因为________________________________________________________。 (5)将二维密置层在三维空间内堆积,可以得到两种金属晶体的最密堆积方式。一种是按照XYXYXYXY……方式堆积,我们称这种堆积方式为“甲”方式。另外一种是按照XYZXYZXYZXYZ……方式堆积,我们称这种堆积方式为“乙”方式。则金属D的堆积方式为________(填“甲”或“乙”)。 20.(11分)麻黄素M是拟交感神经药。合成M的一种路线如图所示: 已知:I.R—CH2OH RCHO II.R1-CHO + IV. V. 请回答下列问题: (1)D的名称是_______;G中含氧官能团的名称是_______。 (2)反应②的反应类型为_______;A的结构简式为_______。 (3)写出反应⑦的化学方程式:______________________________。 (4)X分子中最多有_______个碳原子共平面。 (5)在H的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共振氢谱上有4组峰,且峰面积之比为1∶1∶2∶6的有机物的结构简式为_________________。 (6)已知:仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体的路线________________。 【参考答案】 一、选择题(15个小题,共40分。1~10为单项选择题,每题2分,共20分;11~15为不定项选择题,全部选对的得4分,选对但不全的得1分,有选错的得0分,共20分) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 A B B A C C D B D C CD C BC BD C 二、填空题(共60分) 16.(12)(1)t-BuOH+HNO2 t-BuNO2+H2O(2分) (2)①恒压滴液漏斗(滴液漏斗)(1分) ②水浴加热(1分) ③降低叠氮化钠的溶解度,防止产物损失(2分) (3)65%(2分) AC(2分) (4)ClO-+2N+H2O===Cl-+2OH-+3N2↑(2分) 17.(14分)(1)补充Cl-,促进I中反应,提高铜元素浸出率(2分) (2)①4Fe2+ + O2 + 6H2O = 4FeOOH↓+ 8H+ (2分) ② Cu2+ CuCl2-(2分) (3)防止Zn2+、Pb2+沉淀,同时避免CuCl2- 变成Cu2O沉淀(2分) (4)除去Zn2+和Pb2+(2分) (5)2CuCl2- + 2OH- = Cu2O↓+4Cl- +H2O(2分) (6)电解氯化钠溶液产生H2、Cl2和NaOH;NaOH可用于Ⅲ、Ⅴ中作沉淀剂,H2可用于Ⅵ作还原剂,Cl2可用于Ⅷ作氧化剂。(2分) 18.(12)(1)①低温 (1分)② CD (2分) ③ 10(2分) > (1分) <(2分) (2)①N2O (2分) ②2NO2N2O4,NO2气体中存在N2O4,不便于定量测定 (2分) 19.(11分) (1)Be查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档