- 2021-04-13 发布 |
- 37.5 KB |
- 25页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习化学工艺流程题的解题思路课件(25张)(全国通用)
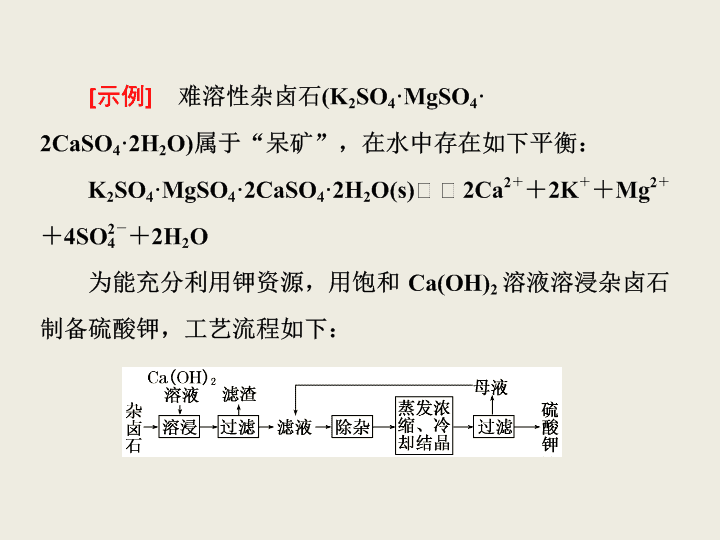
化学工艺流程题的解题思路 [ 题型特点 ] 化学工艺流程题是最近几年出现的并逐步取代无机框图推断题的一种新题型,它以工业生产实际和化学实验密切相关的物质制备、分离和提纯为中心,以流程图为信息背景,以物质的性质和转化为考查点,将实验、元素及其化合物和化学理论等内容有机结合,具有直观、形象、一目了然的特点。此类试题一般难度较大,是 Ⅱ 卷化学实验的重头戏。 (1) 滤渣主要成分有 ________ 和 ____ ____ 以及未溶杂卤石。 (2) 用化学平衡移动原理解释 Ca(OH) 2 溶 液能溶解杂卤石浸出 K + 的原因: ______ ______ 。 (3)“ 除杂 ” 环节中,先加入 ________ 溶液,经搅拌 等操作后,过滤,再加入 ________ 溶液调滤液 pH 至中性。 (4) 不同温度下, K + 的浸出浓度与溶浸时间的关系如右图。由图可得,随着温度升高,① _____________________ ② ____________________ 。 解答工艺流程类试题要从以下五个方面入手 (1) 浏览题中的工艺流程图,提取有用的信息,分析流程中将原料转化为产品的主要生产原理,推断并写出相关化学反应方程式。 (2) 解决分离提纯产品的步骤。选择分离提纯的实验方法 ( 如过滤、蒸发、分液、蒸馏等 ) ,掌握主要仪器和主要操作。 (3) 根据数据,结合化学平衡移动原理,从温度、压强和浓度等方面分析,找到能使反应正向移动的条件,计算出产品的产率和反应物的转化率。 (4) 注意环保,减少污染,发展 “ 绿色化学 ” 。以原料循环使用或废物利用为主线,评价方案的优劣。 (5) 考虑原料的来源和经济成本。通过对原料价位的思考优化方案。 1 .明矾石的主要成分是 K 2 SO 4 ·Al 2 (SO 4 ) 3 ·2Al 2 O 3 ·6H 2 O ,此外还含有少量 Fe 2 O 3 杂质。利用明矾石制备氢氧化铝的流程如图所示。 (2)“ 溶解 ” 时发生反应的离子方程式为 __________________ 。 (3)“ 调节 pH” 后过滤、洗涤 Al(OH) 3 沉淀,证明已洗涤干净的实验操作和现象是 ____________________________ 。 (4)“ 母液 ” 中可回收的物质是 __________________ 。 解析: (1) 根据 “ 焙烧 ” 过程中的反应,遵循质量守恒定律,可知另一产物为 SO 2 ,由化合价变化关系可知, Al 2 (SO 4 ) 3 为氧化剂。 (2)Al 2 O 3 是两性氧化物,加入氢氧化钠能够使其溶解。 (3)“ 调节 pH” 后过滤、洗涤 Al(OH) 3 沉淀,证明已洗涤干净的实验操作和现象是取最后一次洗涤液于试管中,滴加 BaCl 2 溶液,若无白色沉淀生成则说明已洗涤干净。 (4) 母液中有 K 2 SO 4 和 Na 2 SO 4 ,都可以回收。 [ 题型特点 ] 化学工艺流程类试题是高考中将化学原理、实验操作和化学技术融合在一起的一种创新题型。它将化工生产中的生产流程用框图表示出来,并根据生产流程过程中有关的化学知识及混合物分离的方法步步设问;解题时要明确原料和产品 ( 包括副产品 ) ,即箭头进出的方向,其次紧扣信息、依据流程图分析反应原理,搞清流程中每一步发生的反应,最后结合溶液的配制、混合物的分离及定量测定等化学实际的基本操作,准确答题。 [ 示例 ] 一水硫酸亚铁 (FeSO 4 ·H 2 O) 是一种重要的食品和饲料添加剂。某学校兴趣小组选用一包饲料级一水硫酸亚铁测定其中铁元素的含量,实验流程图如下: 请回答下列问题: (1) 步骤 ① 加入过量 H 2 O 2 的目的是 ________________ 。 (2) 步骤 ③ 中的 “ 一系列操作 ” 包括: ________→ 洗涤 → ________→ 冷却 → 称量 ( 两个空格中选填下面操作的字母代号 ) 。 (3) 步骤 ② 中的 X 溶液可以是 ________( 填字母代号 ) 。该反应的离子方程式为 ________________________ 。 A .稀硫酸 B .稀氨水 C . NaOH 溶液 D . Ba(OH) 2 溶液 化工流程类题目中 “ 表述性词汇 ” 的作用 化工生产流程和综合实验题中经常会出现一些表述性词语,这些表述性词语就是隐性信息,它可以暗示我们所应考虑的答题角度。通常用到的表述性词语为: (1)“ 控制较低温度 ” —— 常考虑物质的挥发、物质不稳定易分解和物质转化等。 (2)“ 加过量试剂 ” —— 常考虑反应完全或增大转化率、产率等。 (3)“ 能否加其他物质 ” —— 常考虑会不会引入杂质或影响产物的纯度。 (4)“ 分离 ” 、 “ 提纯 ” —— 常考虑过滤、蒸发、萃取、分液和蒸馏等常规操作。 (5)“ 溶液呈酸性或碱性 ” —— 考虑电离或水解产生的 H + 或 OH - ,是促进还是抑制电离或水解。 (6)“ 利用率 ” —— 常考虑经济性或环保性。 (7)“ 在空气中或在其他气体中 ” —— 主要考虑 O 2 、 H 2 O 、 CO 2 或其他气体是否参与反应或达到防氧化、防水解、防潮解等目的。 (8)“ 判断沉淀是否洗净 ” —— 常取少量最后一次洗涤液于试管中,向其中滴加某试剂,以检验其中的某种离子。 (9)“ 检验某物质的设计方案 ” —— 通常取少量某液体于试管中,加入另一试剂产生某现象,然后得出结论。 (10)“ 控制 pH”—— 常考虑防水解、促进生成沉淀或除去杂质等。 (11)“ 用某些有机试剂清洗 ” —— 常考虑降低物质溶解度有利于析出、减少损耗和提高利用率等。 2 .废弃物的综合利用既有利于节约资源,又 有利于保护环境。实验室利用废旧电池的铜帽 (Cu 、 Zn 总含量约为 99%) 回收 Cu 并制备 ZnO 的部分实验过程如下: (1)① 铜帽溶解时加入 H 2 O 2 的目的是 __________________( 用化学方程式表示 ) 。 ② 铜帽溶解完全后,需将溶液中过量的 H 2 O 2 除去。除去 H 2 O 2 的简便方法是 __________ 。 (3) 已知 pH > 11 时 Zn(OH) 2 能溶于 NaOH 溶液生成 [Zn(OH) 4 ] 2 - 。下表列出了几种离子生成氢氧化物沉淀的 pH( 开始沉淀的 pH 按金属离子浓度为 1.0 mol·L - 1 计算 ) 。 开始沉淀的 pH 沉淀完全的 pH Fe 3 + 1.1 3.2 Fe 2 + 5.8 8.8 Zn 2 + 5.9 8.9 实验中可选用的试剂: 30%H 2 O 2 、 1.0 mol·L - 1 HNO 3 、 1.0 mol·L - 1 NaOH 。由除去铜的滤液制备 ZnO 的实验步骤依次为: ① ________________ ; ② ________________ ; ③ 过滤; ④ _______________ ; ⑤ 过滤、洗涤、干燥; ⑥ 900℃ 煅烧。 解析: (1) 铜与稀硫酸不反应,加入 H 2 O 2 可以将铜氧化为 CuO , CuO 与稀 H 2 SO 4 反应。 H 2 O 2 不稳定,受热分解生成水和氧气,氧气逸出。 (2) 根据碘遇淀粉变蓝色的性质,可用淀粉作指示剂。在锥形瓶中加入淀粉溶液,溶液变为蓝色,滴入 Na 2 S 2 O 3 标准溶液至溶液的蓝色完全褪去,即证明 I 2 全部反应。若溶液中的 H 2 O 2 没有除尽, H 2 O 2 具有强氧化性,会氧化 I - 生成 I 2 ,导致 Na 2 S 2 O 3 标准溶液使用量偏多,从而计算出的 Cu 2 + 含量偏高。 (3)Fe 2 + 与 Zn 2 + 完全沉淀时的 pH 相差不大,直接沉淀会使生成的 Zn(OH) 2 不纯,故可先加入氧化剂 H 2 O 2 ( 使用该氧化剂不引入杂质离子 ) 将 Fe 2 + 氧化为 Fe 3 + ,调节 pH 至 3.2 ~ 5.9 之间,目的是 将 Fe 3 + 全部沉淀,保证 Zn 2 + 不沉淀。过滤后,再调节 pH 大于 8.9 ,使 Zn 2 + 全部沉淀,但是 pH 不能超过 11 ,否则 Zn(OH) 2 会被溶解。最后煅烧 Zn(OH) 2 使其分解得 ZnO 。 答案: (1)①Cu + H 2 O 2 + H 2 SO 4 ===CuSO 4 + 2H 2 O ② 加热 ( 至沸 ) (2)① 淀粉溶液 蓝色褪去 ② 偏高 (3)① 向滤液中加入适量 30% H 2 O 2 ,使其充分反应 ② 滴加 1.0 mol ·L - 1 NaOH ,调节溶液 pH 约为 5( 或 3.2≤pH < 5.9) ,使 Fe 3 + 沉淀完全 ④ 向滤液中滴加 1.0 mol·L - 1 NaOH ,调节溶液 pH 约为 10( 或 8.9≤pH≤11) ,使 Zn 2 + 沉淀完全查看更多