- 2021-04-13 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学第一轮复习课件第2讲 原电池 化学电源-6化学电源
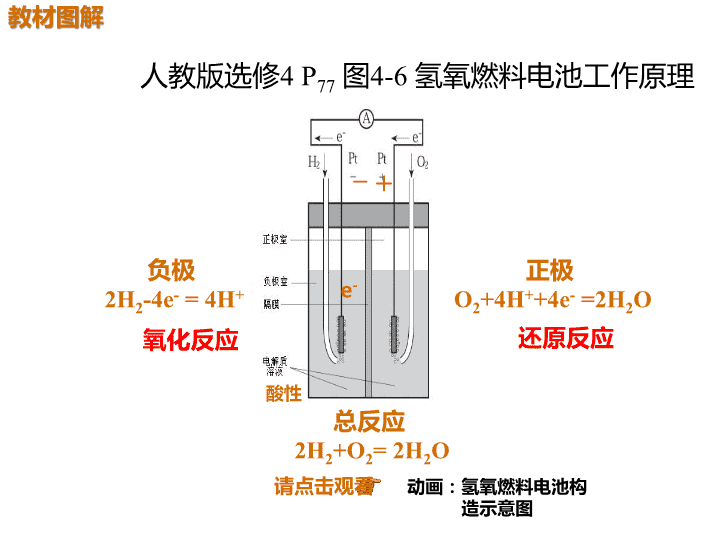
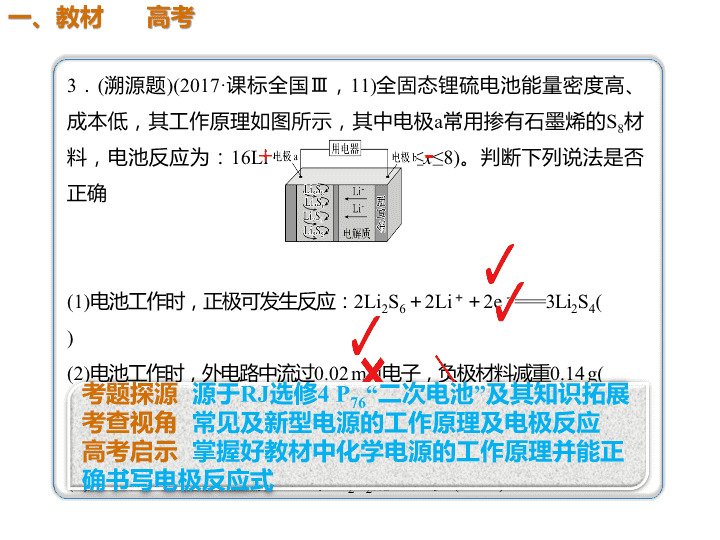
人教版选修4 P77 图4-6 氢氧燃料电池工作原理 负极 2H2-4e- = 4H+ 正极 O2+4H++4e- =2H2O 总反应 2H2+O2= 2H2O 氧化反应 还原反应 请点击观看 动画:氢氧燃料电池构 造示意图 — + 酸性 e- 3.(溯源题)(2017·课标全国Ⅲ,11)全固态锂硫电池能量密度高、 成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材 料,电池反应为:16Li+xS8===8Li2Sx(2≤x≤8)。判断下列说法是否 正确 (1)电池工作时,正极可发生反应:2Li2S6+2Li++2e-===3Li2S4( ) (2)电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g( ) (3)石墨烯的作用主要是提高电极a的导电性( ) (4)电池充电时间越长,电池中Li2S2的量越多( ) + - 1 . 铅 蓄 电 池 的 工 作 原 理 为 : P b + P b O 2 + 2H2SO4===2PbSO4+2H2O,研读下图,下列判断正确 的是( ) A.K闭合时,d电极的电极反应式:PbSO4+2e-===Pb +SO42- B.当电路中通过0.2 mol电子时,Ⅰ中消耗的H2SO4为 0.2 mol C.K闭合时,Ⅱ中SO42-向c电极迁移 D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极 为负极 B 试 题 备 选 原电 池 电解 池 解析 根据图示,K闭合时,Ⅰ为原电池,a为正极, b为负极,Ⅱ为电解池,c为阴极,d为阳极。d为阳 极,发生氧化反应:PbSO4-2e-+2H2O===PbO2+ 4H++SO42-,A项错误;根据铅蓄电池的总反应知, 电路中转移0.2 mol电子时,Ⅰ中消耗0.2 mol H2SO4, B项正确;K闭合时,Ⅱ中SO42-向阳极(d极)迁移, C项错误;K闭合一段时间后,c电极析出Pb,d电 极析出PbO2,电解质溶液为H2SO4溶液,此时可以 形成铅蓄电池,d电极作正极,D项错误。 — + H+ 电 流 (2015·甘肃二诊)右图所示是一 种酸性燃料电池酒精检测仪,具 有自动吹气流量侦测与控制的功 能,非常适合进行现场酒精检测。 下列说法不正确的是( ) A.电流由O2所在的铂电极流 出 B.O2所在的铂电极处发生还 原反应 C.该电池的负极反应式为: CH3CH2OH+3H2O-12e- ===2CO2↑+12H+ D.微处理器通过检测电流大 小而计算出被测气体中酒精的含 量 C CH3CH2OHe- 负极: CH3CH2OH -4e- +H2O==CH3COOH+4H+ 正极:O2+ 4H+ +4e- == 2H2O 总反应: CH3CH2OH+O2==CH3COOH+H2O 【试题备选】 电极反应式书写的三个步骤 看环 境配 守恒 两式 加验 总式 列物 质标 得失查看更多