- 2021-04-13 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020中考化学真题分类汇编 专题分类 酸碱盐综合专项训练(含解析)
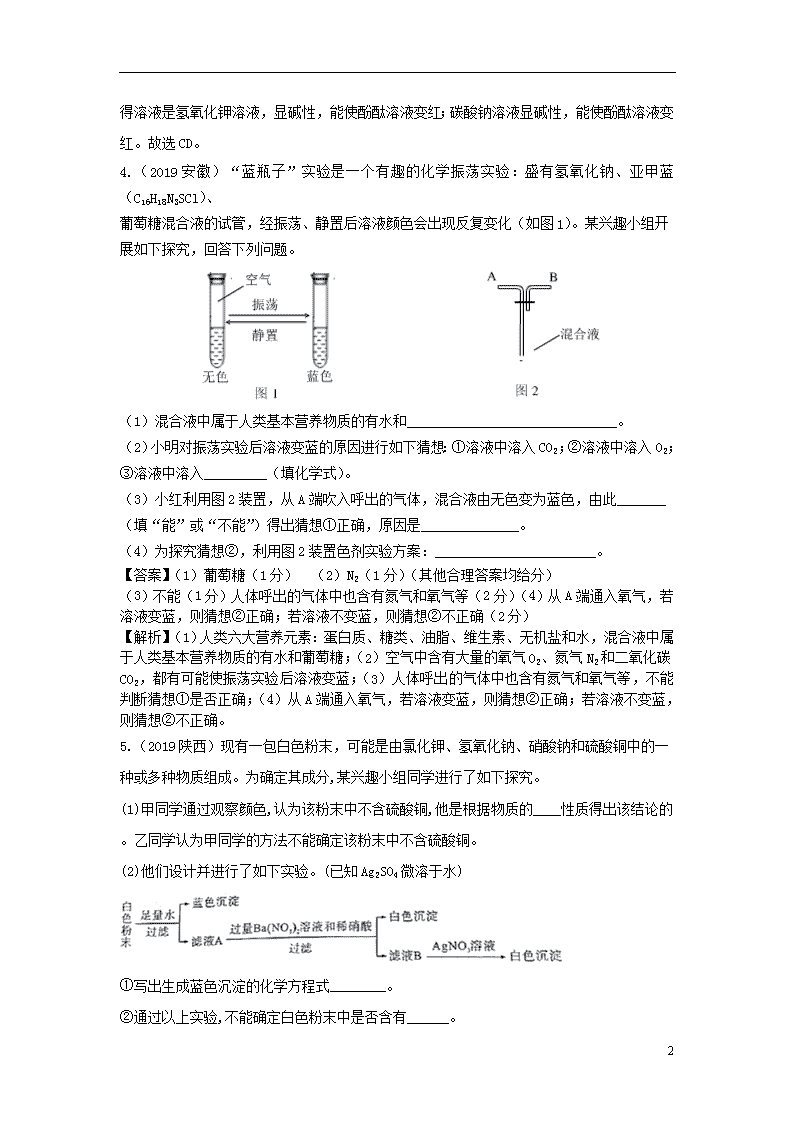
专题分类:酸碱盐 1.(2019北京)下列物质能与NaOH反应的是( ) A.Fe B.CO2 C.Fe2O3 D.NaCl 答案:B 解析:NaOH物质分类属碱,碱的化学性质有四点,其中一点是与非金属氧化物反应,CO2属于非金属氧化物,故选择B。 2.(2019天津)下列有关实验方案设计正确的是( ) 【答案】A 【解析】NaOH与稀盐酸反应无现象,Na2CO3与稀盐酸反应有气泡产生;鉴别纯棉线和羊毛线,用燃烧闻气味的方法;Na2SO4 + Ba(NO3)2 ==BaSO4↓+ 2NaNO3,引入杂质NaNO3;二氧化碳不支持燃烧,少量的一氧化碳在二氧化碳中燃烧不起来。故选A。 3.(2019重庆B )氢氧化钠离液和氨水都能使酚酞溶液变红,其原因是二者的溶液中均含有义种相同的粒 子是( ) A.H+ B.OH- C.H2O D.H 【答案】B 【解析】碱性溶液可以使无色酚酞溶液变红的主要原因是溶液中均含有氢氧根离子(OH-)。故选B。 3.(2019天津)下列各组物质反应,所得溶液能使酚酞溶液变红的是( ) A. 一定量的稀盐酸与适量的氢氧化钠溶液恰好完会反应 B. 相同质量、相同溶质质量分数的氢氧化钾溶液与盐酸相混合 C. 将硫酸钾溶液滴入氢氧化钡溶液中恰好完全反应 D. 将二氧化碳气体通入氢氧化钠溶液中得到碳酸钠溶液 【答案】CD 【解析】一定量的稀盐酸与适量的氢氧化钠溶液恰好完会反应,所得溶液显中性,不能使酚酞溶液变红;相同质量、相同溶质质量分数的氢氧化钾溶液与盐酸相混合,盐酸有剩余,所得溶液显酸性,不能使酚酞溶液变红; 6 将硫酸钾溶液滴入氢氧化钡溶液中恰好完全反应,所得溶液是氢氧化钾溶液,显碱性,能使酚酞溶液变红;碳酸钠溶液显碱性,能使酚酞溶液变红。故选CD。 4.(2019安徽)“蓝瓶子”实验是一个有趣的化学振荡实验:盛有氢氧化钠、亚甲蓝(C16H18N3SCl)、 葡萄糖混合液的试管,经振荡、静置后溶液颜色会出现反复变化(如图1)。某兴趣小组开 展如下探究,回答下列问题。 (1)混合液中属于人类基本营养物质的有水和______________________________。 (2)小明对振荡实验后溶液变蓝的原因进行如下猜想:①溶液中溶入CO2;②溶液中溶入O2;③溶液中溶入_________(填化学式)。 (3)小红利用图2装置,从A端吹入呼出的气体,混合液由无色变为蓝色,由此_______(填“能”或“不能”)得出猜想①正确,原因是______________。 (4)为探究猜想②,利用图2装置色剂实验方案:_______________________。 【答案】(1)葡萄糖(1分) (2)N2(1分)(其他合理答案均给分) (3)不能(1分)人体呼出的气体中也含有氮气和氧气等(2分)(4)从A端通入氧气,若溶液变蓝,则猜想②正确;若溶液不变蓝,则猜想②不正确(2分) 【解析】(1)人类六大营养元素:蛋白质、糖类、油脂、维生素、无机盐和水,混合液中属于人类基本营养物质的有水和葡萄糖;(2)空气中含有大量的氧气O2、氮气N2和二氧化碳CO2,都有可能使振荡实验后溶液变蓝;(3)人体呼出的气体中也含有氮气和氧气等,不能判断猜想①是否正确;(4)从A端通入氧气,若溶液变蓝,则猜想②正确;若溶液不变蓝,则猜想②不正确。 5.(2019陕西)现有一包白色粉末,可能是由氯化钾、氢氧化钠、硝酸钠和硫酸铜中的一种或多种物质组成。为确定其成分,某兴趣小组同学进行了如下探究。 (1)甲同学通过观察颜色,认为该粉末中不含硫酸铜,他是根据物质的____性质得出该结论的。乙同学认为甲同学的方法不能确定该粉末中不含硫酸铜。 (2)他们设计并进行了如下实验。(已知Ag2SO4微溶于水) ①写出生成蓝色沉淀的化学方程式________。 ②通过以上实验,不能确定白色粉末中是否含有______。 6 ③加入过量Ba(NO3)2溶液和稀硝酸的目的是_________。 【答案】 (1). 物理; (2). 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4; (3). NaNO3或硝酸钠; (4). 排除SO42-的干扰 (合理答案即可) 【解析】(1)根据硫酸铜溶液显蓝色,属于物理性质解答;(2) ①根据氢氧化钠溶液与硫酸铜反应生成氢氧化铜和硫酸钠解答;②根据框图中发生的反应和现象分析解答;③根据Ba2+与SO42-不能共存分析解答。(1)甲同学通过观察颜色,认为该粉末中不含硫酸铜,他是根据物质的物理性质得出该结论的;(2) ①氢氧化钠溶液与硫酸铜反应生成氢氧化铜和硫酸钠,反应的化学方程式为2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;②由白色粉末加足量水,过滤得到蓝色沉淀滤液A可知,原固体中含有氢氧化钠和硫酸铜;向滤液A中加过量Ba(NO3)2溶液和稀硝酸得到白色沉淀和滤液B可知,将硫酸铜反应完;再向滤液B中加AgNO3溶液得到白色沉淀可知,原白色固体中含有氯化钾。故通过以上实验,不能确定白色粉末中是否含有NaNO3(或硝酸钠);③加入过量Ba(NO3)2溶液和稀硝酸的目的是排除SO42-的干扰。 6.(2019天津)酸、碱、盐在生产生活中具有广泛的用途。 (1)化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如下表(微溶物视为可辩物): ①写出溶液B、C中溶质的化学式: B________,C________。 ②写出溶液A与D反应的化学方程式________。 (2)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理: NaCl+H2O+NH3+CO2=NaHCO3↓+X; 2NaHCO3Na2CO3+H2O+CO2↑等。 回答下列问题: ①X的化学式为________。 ②将碳酸钠和碳酸氢钠的混合物l0g充分加热至质量不再改变,冷却,称量剩余固休质量为6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为________(写最简比)。 【答案】(1) H2SO4 (2) BaCl2 (3) Na2CO3+Ca(OH)2=CaCO3↓+2NaOH (4)NH4Cl (5) 4∶21 【解析】稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五种溶液,能与两种物质发生反应生成沉淀的是碳酸钠、氯化钡,碳酸钠能与稀硫酸反应生成气体,判断 A是碳酸钠,C是氯化钡,B是稀硫酸,D是氢氧化钙,则E是氢氧化钠。①溶液B、C中溶质分别是H2SO4、BaCl2 6 ②溶液A与D反应的化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;(2)①化学反应前后各种原子个数相等,所以X的化学式为NH4Cl;②设原混合物中碳酸氢钠的质量为x。 2NaHCO3Na2CO3 + H2O + CO2↑ 固体的差量 168 106 168-106=62 x l0g-6.9g=3.1g =,解得x=8.4g,原混合物中碳酸钠的质量是:l0g-8.4g=1.6g 则原混合物中碳酸钠和碳酸氢钠的质量比为:1.6g:8.4g=4:21。 7.(2019吉林)某化学兴趣小组的同学们在实验室里探究某些酸、碱、盐之间是否发生复分解反应。 【查阅资料】硫酸钡(BaSO4)白色固体,不溶于水,也不溶于盐酸、硫酸和硝酸。 【实验与探究】 内容 现象 实验解析 结论 实验一 _____①_____ 化学方程式是: K2CO3+H2SO4=K2SO4+H2O+CO2↑ 生成物中有气体或有___④__或有沉淀生成时,复分解反应可以发生。 实验二 溶液颜色由红色恰好变为无色 实验三 产生白色沉淀 该反应的实质是: Ba2++SO42-=BaSO4↓ 实验三结束后,某同学出于好奇,把实验三试管里的上层清液a倒入另一支洁净的试管中,向清液a中逐滴滴加K2CO3溶液。在滴加过程中,发现先产生气泡,然后又产生白色沉淀。根据上述现象,请你判断原清液a中的溶质是___⑤___。 【拓展与应用】将稀盐酸、Ca(OH)2溶液、NaCl溶液和Na2CO3溶液任意两种溶液相混合,写出能发生反应且有沉淀生成的化学方程式________。 【答案】①有气泡产生(1分);②酚酞(1分);③SO42-(或硫酸根离子或硫酸根均可) (1分);④水(或H2O)(1分);⑤HNO3和Ba(NO3)2(或硝酸和硝酸钡)(1分);⑥Ca(OH)2+Na2CO3==CaCO3↓+2NaOH(2分)。 6 【解析】①K2CO3与H2SO4反应有气泡产生;②氢氧化钠溶液使无色酚酞变红;③酸碱中和的实质是H++OH-=H2O,③是SO42-(或硫酸根离子或硫酸根均可);④复分解反应条件有气体、水(或H2O)或沉淀生成;⑤K2CO3与Ba(NO3)2生成BaCO3沉淀,BaCO3沉淀与HNO3反应生成二氧化碳,即原清液a中的溶质是硝酸和硝酸钡;⑥Ca(OH)2溶液和Na2CO3溶液反应:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH。 8.(2019枣庄)海洋是个巨大的宝藏。人类利用海洋化学资源大体上经历了如图1所示几个阶段。 (1)海水经日晒蒸发水分,变为饱和溶液,再晒析出食盐,这一过程叫 蒸发结晶 ,这样得到的是“粗盐”,不仅含有泥沙,还含有Ca2+、SO42﹣、Mg2+等为去除三种杂质离子,可向粗盐水中依大加入过量的 BaCl2、NaOH、Na2CO3 (填化学式),过滤去除沉淀后再加入适量盐酸,将溶液调至中性。 (2)氯碱工业基本流程(图2): 由图示可知工艺中可循环利用的物质是 NaCl 。 (3)海水提镁流程:海水(MgCl2)氢氧化镁氧化镁镁,写出其中任一个反应的化学方程式 MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2 ,提取氯化镁历经 a、b两步转换的目的是 获得比较纯净的氧化镁 。 (4)下列方法中能淡化海水的是 C (填字母)。 A.过滤法 B.沉淀法 C.多级闪急蒸馏法 D.分解法 解析:(1)海水经日晒蒸发水分,变为饱和溶液,再晒析出食盐,这一过程是蒸发水分析出晶体,叫蒸发结晶,这样得到的是“粗盐”,含有Ca2+、SO42﹣、Mg2+等为去除三种杂质离子,要除去这些杂质离子,加入的试剂要注意后加入的试剂需要把先加入的过量的试剂除去,故可向粗盐水中依大加入过量的 BaCl2、NaOH、Na2CO3;过滤去除沉淀后再加入适量盐酸,将溶液调至中性。故填:蒸发结晶;BaCl2、NaOH、Na2CO3; 6 (2)根据图示可以看出,该工艺中可循环利用的物质是氯化钠,故填:NaCl。 (3)海水提镁中氯化镁能与氢氧化钙反应生成氢氧化镁沉淀和氯化钙,化学方程式为MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,提取氯化镁历经 a、b两步转换是为了获得比较纯净的氧化镁,故填:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;获得比较纯净的氧化镁。 (4)多级闪急蒸馏法能淡化海水,故填:C。 9.(2019河北)小明用某纯碱样品(含少量氯化钠)进行了图27所示的实验。请计算: (1)生成二氧化碳的总重量为_____g。 (2)所用稀盐酸的溶质质量分数。 【答案】(1)4.4g;(2) 7.3% 【解析】(1)根据反应前后物质减少的质量就是产生二氧化碳的质量:12g+50g+50g-107.6g=4.4g; (2)设反应所用稀盐酸的溶质质量分数为x Na2CO3+2HCl=2NaCl+H2O+CO2↑ 73 44 100gx 4.4g 73: 100gx=44: 4.4g x=7.3% ∴所用稀盐酸的溶质质量分数是7.3%。 答:所用稀盐酸的溶质质量分数是7.3%。 6查看更多