- 2021-04-13 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习全国非新高考地区版第六章微考点48燃料电池及其他新型电池电极反应式的书写作业
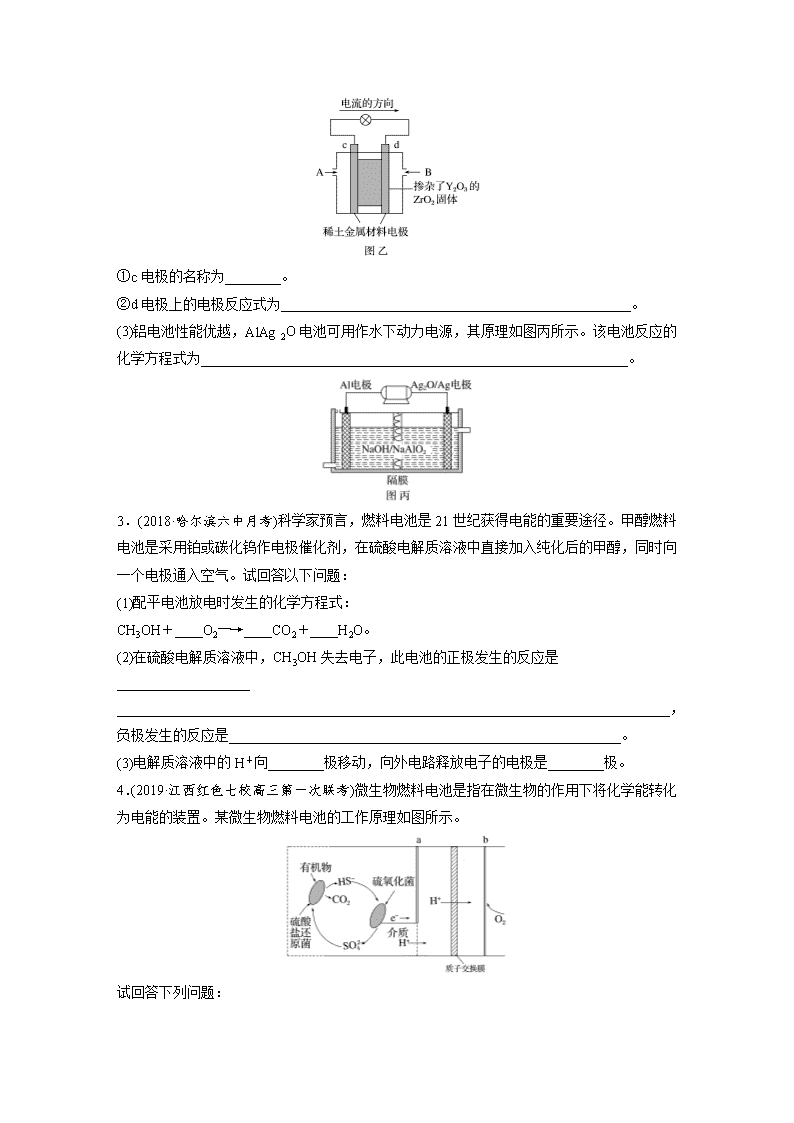
1.(1)燃料电池是一种高效低污染的新型电池。燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲烷、肼等。如图是甲烷燃料电池原理示意图,回答下列问题: ①电池的负极是_________(填“a”或“b”)电极,该极的电极反应式为_________________。 ②电池工作一段时间后电解质溶液的pH____________(填“增大”“减小”或“不变”)。 (2)肼分子(H2N—NH2)可以在氧气中燃烧生成氮气和水,利用肼、氧气与KOH溶液组成碱性燃料电池,请写出该电池的负极反应式:___________________________________________,正极反应式:____________________________________________________________, 总反应式:________________________________________________________________。 (3)以甲醇(CH3OH)为燃料,空气为氧化剂,以熔融K2CO3为电解质环境的燃料电池,负极反应式为________________________________________________________________________ ________________________________________________________________________, 正极反应式为_____________________________________________________________。 2.(1)某燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构如图甲所示,电池总反应可表示为2H2+O2===2H2O。 请回答: ①H+由________(填“a”或“b”)极通过固体酸电解质传递到另一极。 ②b极上发生的电极反应式是_______________________________________________。 (2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如图乙所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-。 ①c电极的名称为________。 ②d电极上的电极反应式为__________________________________________________。 (3)铝电池性能优越,AlAg2O电池可用作水下动力电源,其原理如图丙所示。该电池反应的化学方程式为_____________________________________________________________。 3.(2018·哈尔滨六中月考)科学家预言,燃料电池是21世纪获得电能的重要途径。甲醇燃料电池是采用铂或碳化钨作电极催化剂,在硫酸电解质溶液中直接加入纯化后的甲醇,同时向一个电极通入空气。试回答以下问题: (1)配平电池放电时发生的化学方程式: CH3OH+____O2―→____CO2+____H2O。 (2)在硫酸电解质溶液中,CH3OH失去电子,此电池的正极发生的反应是___________________ _______________________________________________________________________________, 负极发生的反应是________________________________________________________。 (3)电解质溶液中的H+向________极移动,向外电路释放电子的电极是________极。 4.(2019·江西红色七校高三第一次联考)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。 试回答下列问题: (1)该微生物燃料电池,负极为________(填“a”或“b”),当电路中有0.5 mol电子发生转移,则有________ mol的H+通过质子交换膜。 (2)该电池正极反应式为:___________________________________________________。 负极反应式为:____________________________________________________________。 5.(2019·天津一中月考)锂电池应用越来越广泛,大致可分为两类:锂金属电池和锂离子电池。 锂空气电池比锂离子电池具有更高的能量密度,因为其正极(以多孔碳为主)很轻,且氧气从环境中获取而不用保存在电池里。其工作原理如图,电池总反应为4Li+O2+2H2O===4LiOH。 请回答下列问题: (1)该电池的正极反应式是___________________________________________________ ________________________________________________________________________。 (2)在负极的有机电解液和正极的水性电解液之间,用只能通过锂离子的固体电解质隔开,使用该固体电解质的优点有____________________________________________________。 (3)正极使用水性电解液的优点是_____________________________________________ ________________________________________________________________________。 答案精析 1.(1)①a CH4+10OH--8e-===CO+7H2O ②减小 (2)N2H4-4e-+4OH-===4H2O+N2 O2+4e-+2H2O===4OH- N2H4+O2===N2+2H2O (3)CH3OH-6e-+3CO===4CO2+2H2O O2+6e-+3CO2===3CO 2.(1)①a ②O2+4e-+4H+===2H2O (2)①正极 ②CH4+4O2--8e-===CO2+2H2O (3)2Al+3Ag2O+2NaOH===2NaAlO2+6Ag+H2O 解析 (1)a极为负极,b极为正极,电极反应式分别为: 负极:2H2-4e-===4H+,正极:O2+4e-+4H+===2H2O,其中正极上的H+来自负极生成的H+。 (2)根据电流的方向,可判断c为正极,d为负极。在正极通入空气,电极反应式为2O2+8e-===4O2-,在负极通入CH4,电极反应式为CH4+4O2--8e-===CO2+2H2O。 (3)由铝电池原理图可知,Al作负极,Ag2O/Ag作正极,电池反应式为2Al+3Ag2O+2NaOH===2NaAlO2+6Ag+H2O。 3.(1)2 3 2 4 (2)3O2+12H++12e-===6H2O 2CH3OH+2H2O-12e-===2CO2+12H+ (3)正 负 解析 (1)根据得失电子守恒配平反应方程式,注意CH3OH中的H显+1价,O显-2价。(2)电极反应的书写应注意电解质溶液,本题给出的是酸性溶液。(3)由电极反应可知,H+在正极被消耗,在负极生成,所以H+向正极移动。 4.(1)a 0.5 (2)2O2+8e-+8H+===4H2O,HS-+4H2O-8e-===SO+9H+ 解析 (1)根据图示,在硫氧化菌作用下HS-转化为SO,发生氧化反应:HS-+4H2O-8e-===SO+9H+;电极a上发生氧化反应,电极a为负极,b为正极,正极上发生还原反应:2O2+8e-+8H+===4H2O,当电路中有0.5 mol电子发生转移,则有0.5 mol H+通过质子交换膜。 5.(1)O2+2H2O+4e-===4OH- (2)既可防止两种电解液混合,又可防止水和氧气等和负极的锂金属发生反应 (3)可防止正极的碳孔堵塞 解析 (3)该电池正极若使用非水性电解液,则生成的是固体氧化锂(Li2O),而使用水性电解液时,生成的氢氧化锂(LiOH)溶于水,这样就不会引起正极的碳孔堵塞。查看更多