- 2021-04-13 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年云南民族大学附属中学高二12月月考化学试题
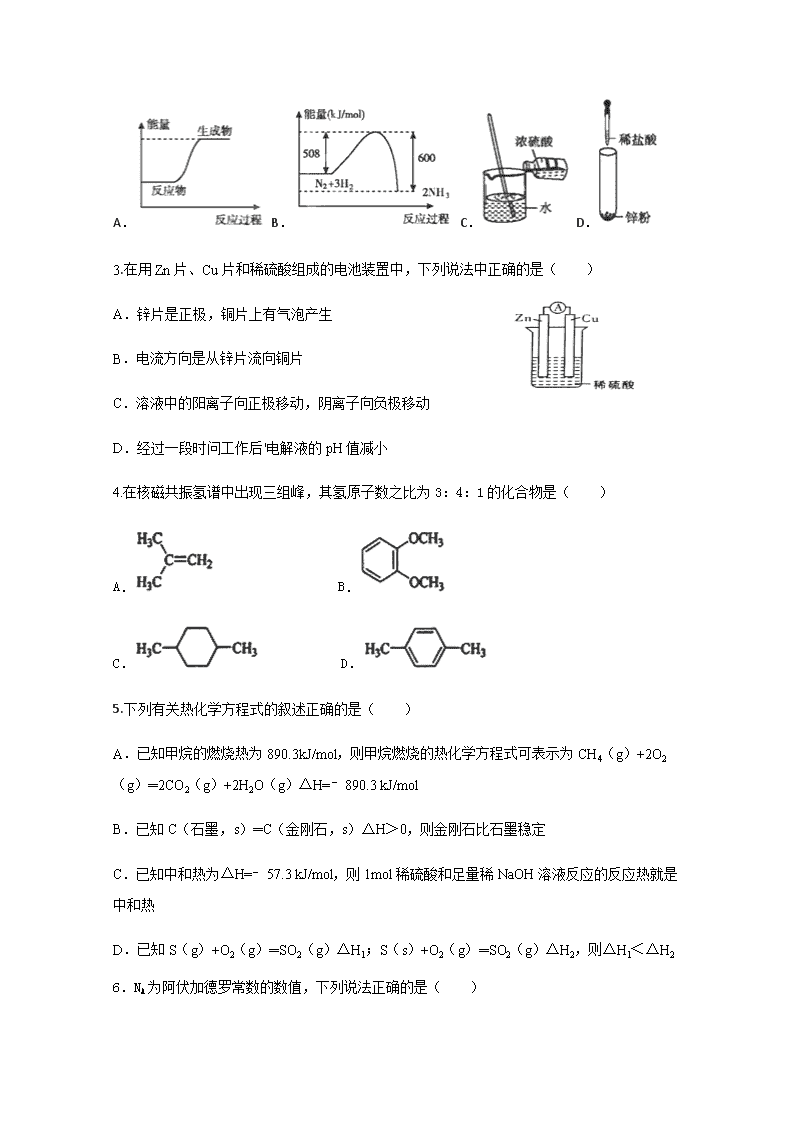
2017-2018学年云南民族大学附属中学高二12月月考化学试卷 注意事项: 1.答题前,考生务必用黑色碳素笔将自己的考号、姓名、考场、座位号、班级在答题卡上填写清楚。 2.每小题选出答案后,用2B铅笔把答题卡上对应的题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。在试卷上作答无效。 诚信誓言: 我以我青春的荣誉起誓,在本次考试中,诚实守信,成绩真实。 起誓人: 可能用到的原子量:H:1 C:12 N:14 O:16 Na:23 Cl:35.5 Br:80 第Ⅰ卷(50分) 一.选择题(本题包括20小题,每小题2.5分,共50分。每小题只有1个选项符合题意) 1.化学是你,化学是我,化学深入我们生活,下列说法正确的是( ) A.木材纤维和土豆淀粉遇碘水均显蓝色 B.食用花生油和鸡蛋清都能发生水解反应 C.包装用材料聚乙烯和聚氯乙烯都属于烃 D.PX项目的主要产品对二甲苯属于饱和烃 2.下列图示变化为吸热反应的是( ) A. B. C. D. 3.在用Zn片、Cu片和稀硫酸组成的电池装置中,下列说法中正确的是( ) A.锌片是正极,铜片上有气泡产生 B.电流方向是从锌片流向铜片 C.溶液中的阳离子向正极移动,阴离子向负极移动 D.经过一段时问工作后'电解液的pH值减小 4.在核磁共振氢谱中出现三组峰,其氢原子数之比为3:4:1的化合物是( ) A. B. C. D. 5.下列有关热化学方程式的叙述正确的是( ) A.已知甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=﹣890.3 kJ/mol B.已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 C.已知中和热为△H=﹣57.3 kJ/mol,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热 D.已知S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2 6.NA为阿伏加德罗常数的数值,下列说法正确的是( ) A.标准状况下,11.2 L的己烷所含的分子数为0.5 NA 个 B.28 g乙烯所含共用电子对数目为6 NA个 C.标准状况下,11.2 L四氯化烷所含共价键数目为2NA个 D.现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为6 NA个 7.已知下列两个热化学方程式: H2(g) + 1/2 O2(g) H2O(l) △H=-300KJ·mol-1 C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(l) △H =-2000.0 KJ·mol-1 实验测得氢气的丙烷的混合气体共5mol,完全燃烧时放热5000KJ,则混合气体中氢气和丙烷的体积比约为( ) A. 7:10 B. 3:1 C. 10:7 D. 1:3 8.下列对有机反应类型的描述不正确的是( ) A.乙醇使酸性KMnO4溶液褪色,是因为发生了氧化反应 B.将苯加入溴水中,振荡后水层接近无色,是因为发生了取代反应 C.乙烯使溴的四氯化碳溶液褪色,是因为发生了加成反应] D.甲烷与氯气混合,光照一段时间后黄绿色消失,是因为发生了取代反应[] 9.运用盖斯定律可方便地计算出难以通过实验直接测定的反应热.已知: P4(白磷,s)+5O2(g)=P4O10(s)△H=﹣2983.2kJ/mol P(红磷,s)+O2(g)=P4O10(s)△H=﹣738.5kJ/mol 则白磷转化为红磷的热化学方程式为( ) A.P4(白磷,s)=4P(红磷,s)△H=﹣29.2kJ/mol B.P4(白磷,s)=4P(红磷,s)△H=+29.2kJ/mol C.P4(白磷,s)=4P(红磷,s)△H=﹣2244.7kJ/mol D.P4(白磷,s)=4P(红磷,s)△H=+2244.7kJ/mol 10.已知:乙醇可被强氧化剂氧化为乙酸.可经三步反应制取,发生反应的类型依次是( ) A.水解反应、加成反应、氧化反应 B.加成反应、水解反应、氧化反应 C.水解反应、氧化反应、加成反应 D.加成反应、氧化反应、水解反应 11.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2﹣.下列对该燃料电池说法不正确的是( ) A.在熔融电解质中,O2﹣移向负极 B.电池的总反应是:2C4H10+13O2=8CO2+10H2O C.通入空气的一极是正极,电极反应为:O2+4e﹣=2O2﹣ D.通入丁烷的一极是正极,电极反应为:C4H10+26e﹣+13O2﹣=4CO2↑+5H2O 12.分子式为C4H10O的醇与分子式为C4H8O2的羧酸酯化反应,生成酯的结构有(不考虑立体异构)( ) A.4种 B.6种 C.8种 D.10种 13.已知:C(s)+O2(g)═CO2(g)△H1 CO2(g)+C(s)═2CO(g)△H2 2CO(g)+O2(g)═2CO2(g)△H3 4Fe(s)+3O2(g)═2Fe2O3(s)△H4[] 3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)△H5 下列关于上述反应焓变的判断正确的是( ) A.△H1>0,△H3<0 B.△H2>0,△H4>0 C.△H1=△H2+△H3 D.△H3=△H4+△H5 14.下列说法不正确的是( ) A.CH3CH2CHCH3CH2CH(CH3)2的系统命名为3,5﹣二甲基己烷 B.正丁烷的二氯代物有6种(不考虑立体异构) C.乙醇在铜催化下加热可脱氢生成乙醛,该反应属于氧化反应 D.淀粉、纤维素属于糖类化合物,在一定条件下都可以水解得到葡萄糖 15.肼(H2N﹣NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N﹣N为154,则断裂1molN﹣H键所需的能量(kJ)是( ) A.194 B.391 C.516 D.658 16.有机物R的结构简式如图所示.下列有关R的性质叙述正确的是( ) A.R的所有原子一定在同一平面上 B.在Ni催化和加热条件下,lmolR能与3molH2发生加成反应 C.R既能与羧酸、醇反应,还能发生水解、加成和氧化反应 D.1molR与足量碳酸氢钠溶液反应,生成CO2的物质的量为2mol 17.铁镍蓄电池又称爱迪生电池.放电时的总反应为:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2.下列有关该电池的说法错误的是( ) A.电池的电解液为碱性溶液,负极为Fe B.电池放电时,负极反应为Fe+2OH﹣﹣2e﹣═Fe(OH)2 C.电池充电过程中,阴极附近溶液的pH减小 D.电池充电时,OH﹣向阳极迁移 18.下列实验中,为实现实验目的而必须除杂的是( ) 实验 除杂试剂 实验目的 ① 电石与水反应 CuSO4溶液 用KMnO4酸性溶液检验乙炔的还原性 ② CH3CH2Br与NaOH溶液共热 HNO3溶液 用AgNO3溶液检验CH3CH2Br中的Br ③ 淀粉与稀H2SO4水浴共热 NaOH溶液 用新制氢氧化铜检验水解产物的还原性 ④ C2H5OH与浓H2SO4加热至170℃ NaOH溶液 用Br2的CCl4溶液证明该反应为消去反应 A.只有①②③ B.只有①②④ C.只有②③④ D.①②③④ 19.已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO4·5H2O(s)═CuSO4(s)+5H2O(l)△H=+Q2 kJ·mol-1则Q1、Q2的关系为( ) A.Q1<Q2 B.Q1>Q2 C.Q1=Q2 D.无法确定 20.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图.下列说法正确的是( ) A.a为CH4,b为CO2 B.CO32﹣向正极移动 C.此电池在常温时也能工作 D.正极反应式为:O2+2CO2+4e﹣═2CO32﹣ 第Ⅱ卷(50分) 二、非选择题(本题包括4小题,每空2分,共50分) 21.(12分)已知化学反应N2+3H22NH3的能量变化如下图所示: (1) N原子和H原子生成1mol NH3(g)是 能量的过程(填“吸收”或“放出”); (2)根据能量图判断N2与H2每生成1mol NH3(l)需要放出热量 kJ(用字母表示); (3)拆开1mol H— H键,1mol N—H键,1mol N三N键分别需要吸收的能量为436kJ ,391kJ,946kJ:反应方程式为:N2 +3H2====== 2 NH3 则 N2和H2生成1molNH3时放出的能量为 kJ; (4)下图为氢氧燃料电池原理示意图,按照此图的提示,请填空: ①a电极是 (填“正极”或“负极”); ②a电极的电极反应为: ; b电极的电极反应为: 。 22.(12分)人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。 (1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。 负极反应式为________________ ; (2)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板。若将此反应设计成原电池,则负极所用电极材料为________________,正极反应式为________________; (3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为________________; A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片 (4)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,回答下列问题: ①负极反应式为________________; ②电池工作一段时间后电解质溶液的pH_________(填“增大”、“减小”或“不变”)。 23.(12分)醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下: 相对分子质量 密度/(gcm﹣3) 沸点/℃ 溶解性 环乙醇 100 0.9618 161 微溶于水 环己烯 82 0.8102 83 难溶于水 a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃ .反应粗产物倒入f中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯12g. 回答下列问题: (1)由环己醇制取环己烯的方程式 。 (2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填正确答案标号)。 A.立即补加 B.冷却后补加 C.不需补加 D.重新配料 (3)分离氯化钙的操作是 。 (4)合成过程中加入浓硫酸的作用是 。 (5)该实验中环己烯的产率为 。(保留到小数点后一位) 24.(14分)肉桂酸乙酯存在天然苏合香中,具有类似水果的香气,气息清面甜润,是一种增香剂,合成肉桂酸乙酯的路线如图所示. 已知: ① ② 回答下列问题: (1)A的名称是 ,C中含有的官能团的名称是 。 (2)B的结构简式是 ,E→F的反应类型是 。 (3)H+E→I的化学方程式为 。 (4)①能发生银镜反应 ②能与氯化铁溶液发生显色反应③除苯环外不含其他环,其中核磁共振氢谱显示5组峰,且峰面积之比为1:2:2:2:1的结构简式为 。(写出一种既可) (5)参照肉桂酸乙酯的合成路线,设计一条以E为起始原料制备1﹣丁烯的合成路线: 。 化学答案 一、 选择题 1-5 B A C C D 6-10 B C B A A 10-15 D C C A B 16-20 C C D A D 二、 填空题查看更多