【化学】广东省揭阳市揭西县河婆中学2020届高三下学期综合测试(四)
广东省揭阳市揭西县河婆中学2020届高三下学期综合测试(四)
7.化学与生产和生活密切相关,下列有关说法正确的是( )
A.英文的“中国”一词又指“瓷器”,中国瓷器驰名世界,其主要成分SiO2
B.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰
C.二氧化硫有毒,严禁将其添加到任何食品和饮料中
D.泡沫灭火器中用的是小苏打和硫酸铝( )
8.NA是阿伏加德罗常数的值。下列说法正确的是
A.10 L pH=1的H2SO4 溶液中含H+离子数为2NA
B.28 g乙烯与丙烯混合物中含有C-H键数目为4NA
C.3 mol H2与1 mol N2混合反应生成NH3,转移电子数为6NA
D.11.2 L(标准状况)Cl2 溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
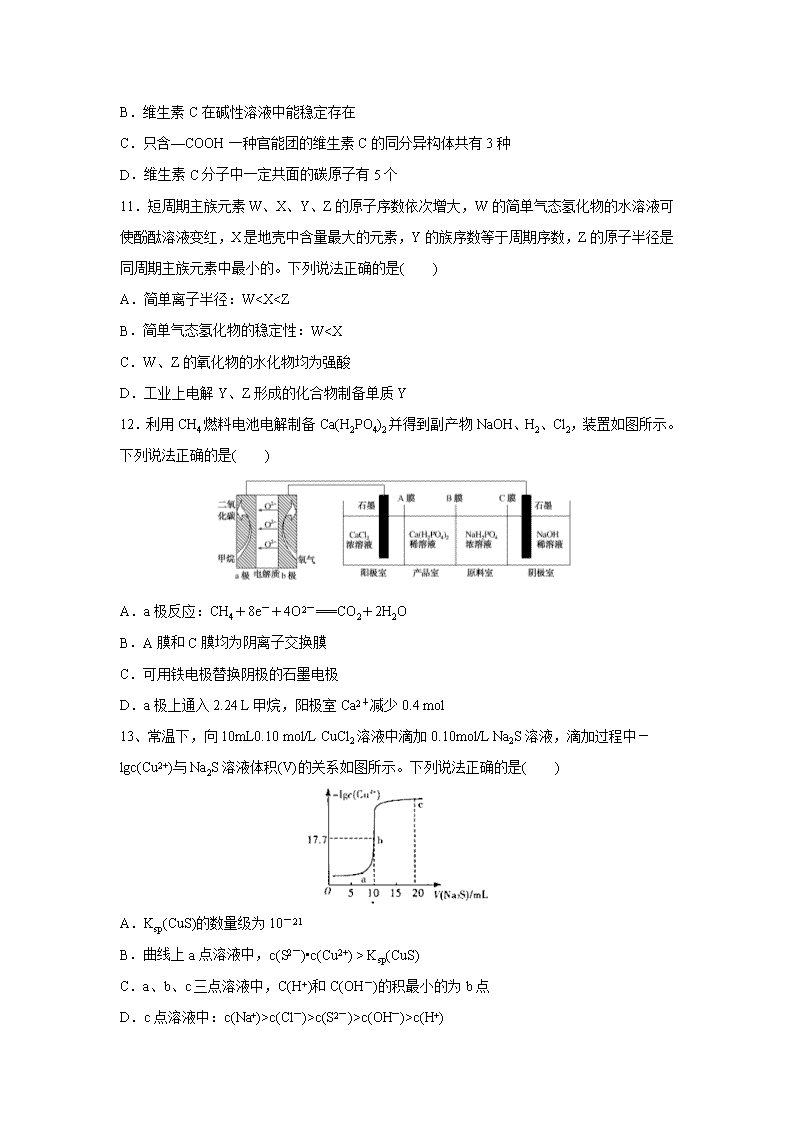
9.实验室用O2氧化NH3制备硝酸的装置如图所示(夹持装置略),下列说法不正确的是( )
A.球形干燥管B中可以填充碱石灰或五氧化二磷
B.实验过程中,若熄灭酒精灯,装置C中的氧化铬继续保持红热,说明装置C中的反应放热
C.球形干燥管D中的无水氯化钙可吸收尾气中的氨气和水蒸气
D.装置E中的石蕊试液最终变红,说明锥形瓶中有硝酸产生
10.维生素C又叫L抗坏血酸,是一种水溶性维生素,在水果和蔬菜中含量丰富,其结构简式如图所示。下列有关说法正确的是( )
A.维生素C分子中含有3种官能团
B.维生素C在碱性溶液中能稳定存在
C.只含—COOH一种官能团的维生素C的同分异构体共有3种
D.维生素C分子中一定共面的碳原子有5个
11.短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单气态氢化物的水溶液可使酚酞溶液变红,X是地壳中含量最大的元素,Y的族序数等于周期序数,Z的原子半径是同周期主族元素中最小的。下列说法正确的是( )
A.简单离子半径:W
Ksp(CuS)
C.a、b、c三点溶液中,C(H+)和C(OH-)的积最小的为b点
D.c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+)
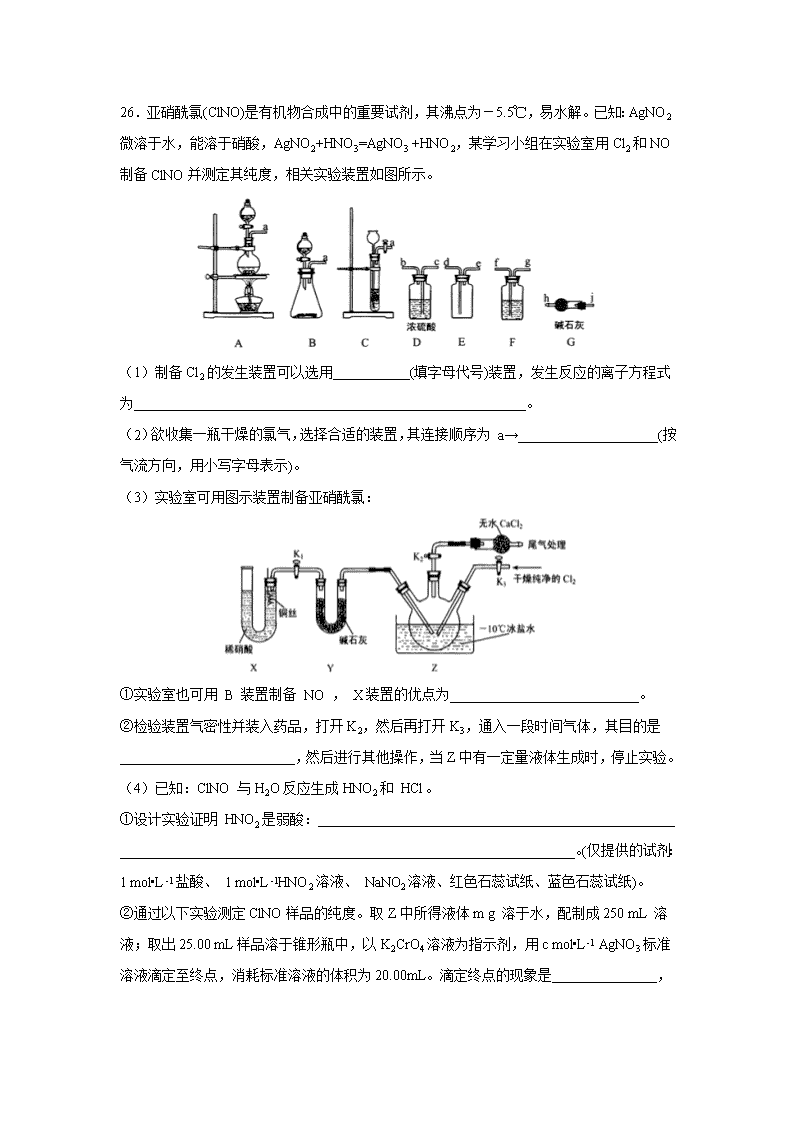
26.亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为-5.5℃,易水解。已知:AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。
(1)制备Cl2的发生装置可以选用___________(填字母代号)装置,发生反应的离子方程式为________________________________________________________。
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 a→____________________(按气流方向,用小写字母表示)。
(3)实验室可用图示装置制备亚硝酰氯:
①实验室也可用 B 装置制备 NO , X装置的优点为___________________________。
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是_________________________,然后进行其他操作,当Z中有一定量液体生成时,停止实验。
(4)已知:ClNO 与H2O反应生成HNO2和 HCl。
①设计实验证明 HNO2是弱酸:___________________________________________________
_________________________________________________________________。(仅提供的试剂:1 mol•L-1盐酸、 1 mol•L-1HNO2溶液、 NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取Z中所得液体m g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用c mol•L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是______
_________,亚硝酰氯(ClNO)的质量分数为_________。(已知: Ag2CrO4为砖红色固体; Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)
27.氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②相关金属离子[c(Mn+)=0.1 mol·L−1]形成氯氧化物沉淀时的pH如下:
金属离子
Al3+
Fe3+
Fe2+
Ca2+
Mn2+
Mg2+
开始沉淀的pH
3.8
1.5
6.3
10.6
8.8
9.6
沉淀完全的pH
5.2
2.8
8.3
12.6
10.8
11.6
③常温下,CaCl2、MnCl2的溶度积分别为
回答下列问题:
(1)“焙烧”时发生的主要化学反应方程式为____________________________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:
焙烧温度_________,氯化铵与菱镁矿粉的质量之比为__________,焙烧时间为________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________________________________________;然后调节溶液pH使Fe3+、Al3+沉淀完全,此时溶液的pH范围为___________________________。再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10−5 mol·L−1时,c(Mg2+)=__________________mol·L−1。
(4)碳化结晶时,发生反应的离子方程式为____________________________________。
(5)流程中能循环利用的固态物质是____________。
28.(15分)磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1)已知:25 ℃时,磷酸和氢氟酸的电离常数如下表所示。
物质
H3PO4
HF
电离常数
Ka1=7.1×10-3;
Ka2=6.3×10-8;
Ka3=4.2×10-13
Ka=6.6×10-4
向NaF溶液中滴加少量H3PO4溶液,反应的离子方程式为__________________________。
(2)已知:
Ⅰ.CaO(s)+H2SO4(l)⇌CaSO4(s)+H2O(l) ΔH=-271 kJ·mol-1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)⇌Ca5(PO4)3F(s)+5H2O(l) ΔH=-937 kJ·mol-1
则:
①工业上用Ca5(PO4)3F和硫酸反应制备磷酸的热化学方程式为____________________________________________________。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率________(填“增大”“减小”或“不变”,下同);HF的平衡浓度________。
(3)工业上用磷尾矿制备Ca5(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH。
①一定温度下,向10 L密闭容器中充入0.5 mol CO和1 mol H2O(g),2 min达到平衡时,测得0~2 min内用CO2表示的反应速率v(CO2)=0.02 mol·L-1·min-1。则CO的平衡转化率α=________;该反应的平衡常数K=________。
②在压强不变的密闭容器中发生上述反应,设起始的=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH________0(填“>”“<”或“=”,下同)。a________1,理由为_____________________________。
36.[化学——选修5:有机化学基础](15分)
顺丁烯二酸也称马来酸,是食品饮料工业中的新型酸味剂。马来酸酐()是一种重要的化工原料,可用于合成可降解的高聚物树脂H。流程中E的产量常作为衡量一个国家石油化工发展水平的重要标志。
回答下列问题:
(1)E的名称为____________;I中含有官能团的名称是____________。
(2)F为环状结构,核磁共振氢谱只有一组峰,其结构简式为__________________。
(3)顺丁烯二酸的结构简式为_____________。
(4)I生成J的反应类型为________反应。
(5)写出D与G反应生成H的化学方程式___________________________________________。
(6)同时符合下列条件的有机物共有________种,写出核磁共振氢谱峰面积比为3:3:1:1的一种同分异构体的结构简式________(不考虑立体异构)。
①相对分子质量比J大14
②与J具有相同官能团
③可发生银镜反应
【参考答案】
题号
7
8
9
10
11
12
13
答案
D
B
A
A
B
C
D
26、【答案】(1)A(或B) MnO2+4H++2Cl-Mn2++ Cl2↑+2H2O(或2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O)
(2)f→g→c→b→d→e→j→h
(3)①随开随用,随关随停 ②排干净三颈烧瓶中的空气
(4)①用玻璃棒蘸取NaNO2溶液,点在红色石蕊试纸中央,若试纸变蓝,说明HNO2是弱酸 ②滴入最后一滴标准液,生成砖红色沉淀,且半分钟内无变化 %
27、【答案】(1)MnCO3+2NH4ClMnCl2+2NH3↑+CO2↑+H2O
(2)500℃ 1.10 60min
(3)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O 5.2≤pH<8.8 5×10-6
(4)Mn2++2HCO3-MnCO3↓+CO2↑+H2O
(5)NH4Cl
28、答案:
(1)H3PO4+F-===H2PO+HF(2分)
(2)①Ca5(PO4)3F(s)+5H2SO4(l)3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418 kJ/mol(2分) ②增大(1分) 不变(1分)
(3)①80%(2分) 8/3(2分) ②<(1分) <(2分) 相同温度下,n(CO)/n(H2O)越小,CO的转化率越大,其平衡体积分数越小(2分)
36、答案:(除标明外,每空1分)
(1)乙烯 碳碳双键、羧基(2分)
(2)
(3) (2分)
(4)酯化(取代)
(5)
HOHOO+(2n-1)H2O (2分)
(6)8(2分)