- 2021-04-13 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教通用版第10讲镁、铝及其重要化合物作业
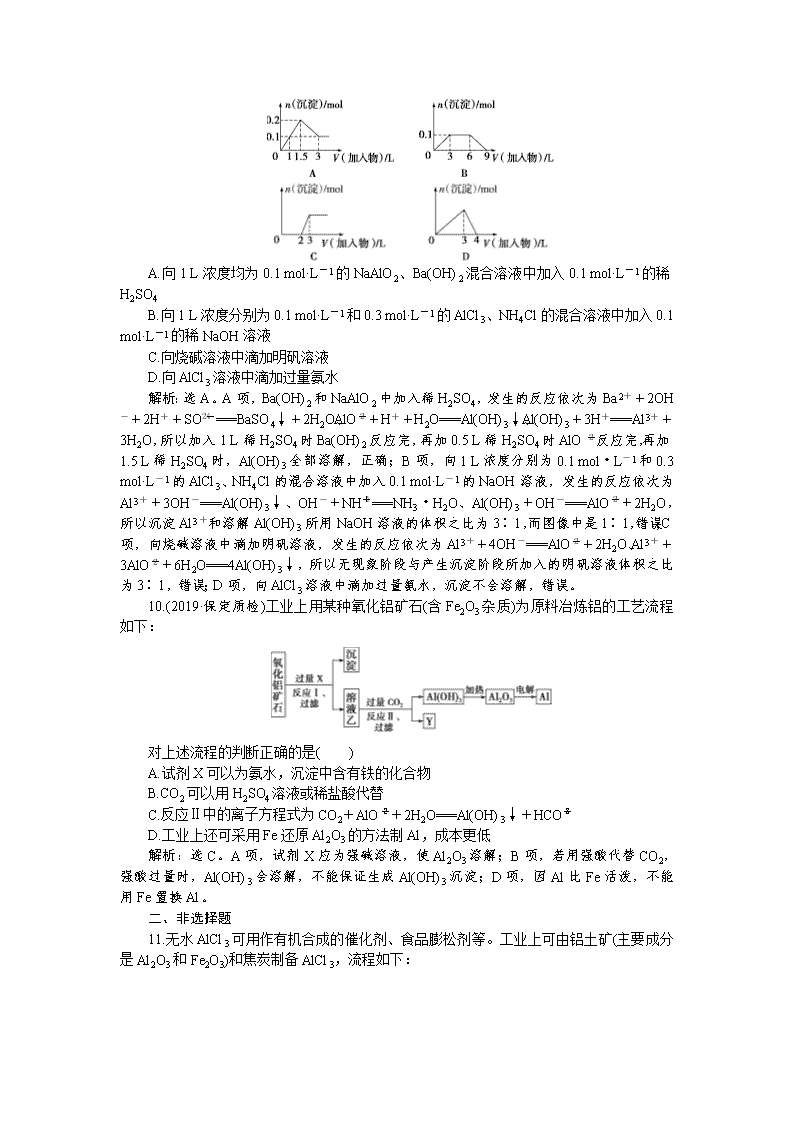
一、选择题 1.(2019·银川第一中学月考)镁粉是焰火、闪光粉、鞭炮中不可缺少的原料。工业上制造镁粉是将镁蒸气在某种气体中冷却,有下列气体:①空气、②CO2、③Ar、④H2、⑤N2,其中可作为冷却气体的是( ) A.①和② B.②和③ C.③和④ D.④和⑤ 解析:选C。加热时O2、N2、CO2都能与镁反应。 2.下列关于铝及其化合物的说法不正确的是( ) A.Al既可用于食品包装,也可用作建筑材料 B.Al2O3既可用来冶炼金属Al,也可用作耐火材料 C.明矾[KAl(SO4)2·12H2O]既可用作净水剂,也可用作消毒剂 D.Al(OH)3既可用作治疗胃酸过多的药物,也可用来制备一些铝盐 解析:选C。A项,金属铝具有良好的延展性,因此铝可以制成铝箔用于食品包装,金属铝也可用作建筑材料,如铝合金门窗等,正确;B项,电解熔融的Al2O3可冶炼金属Al,由于Al2O3具有耐高温的性质,也可用作耐火材料,正确;C项,明矾[KAl(SO4)2·12H2O]溶于水后,Al3+能发生水解反应,生成的Al(OH)3胶体具有吸附作用,可用作净水剂,但Al(OH)3并不具有消毒作用,错误;D项,Al(OH)3与胃酸中的盐酸反应生成氯化铝和水,正确。 3.世界卫生组织已把铝确定为食品的污染源之一而加以控制使用。铝在下列应用中应加以控制的是( ) ①制铝合金 ②制电线 ③制炊具 ④制银色漆颜料 ⑤用明矾净水 ⑥用明矾与苏打做食品膨松剂 ⑦制易拉罐 ⑧用氢氧化铝凝胶制胃舒平药品 ⑨包装糖果和食品 A.③⑤⑧⑨ B.②⑥⑧⑨ C.③④⑤⑨ D.③⑤⑥⑦⑧⑨ 解析:选D。解答本题时,要抓住题中的“把铝确定为食品的污染源之一”与“控制使用”。 4.(2019·洛阳第一次统考)下列实验中,所加固体可以完全溶解的是( ) A.在H2O2溶液中加入少量MnO2粉末 B.将一小块铝片投入足量NaOH溶液中 C.将少量氢氧化铝加入足量的浓氨水中 D.常温下将一小块铁片投入足量浓硝酸中 解析:选B。二氧化锰做催化剂,固体不会溶解,A项错误;Al与足量NaOH溶液反应生成偏铝酸钠和氢气,固体Al可完全溶解,B项正确;氨水不能溶解氢氧化铝,固体不会溶解,C项错误;常温下,铁遇浓硝酸发生钝化,生成致密的氧化膜阻止反应的进一步发生,则固体不能完全溶解,D项错误。 5.下列除去杂质的方法不正确的是( ) A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥得到镁粉 B.用过量氨水除去Fe3+溶液中的少量Al3+ C.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后再过滤、洗涤、干燥得到Al(OH)3 D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到MgO 解析:选B。Al(OH)3不溶于氨水,故向含少量Al3+的Fe3+溶液中加入过量氨水时,Fe3+、Al3+均转化为氢氧化物沉淀,达不到除杂的目的。 6.(2019·洛阳第一次统考)镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如图所示: 下列判断不合理的是( ) A.Al、Ga均处于第ⅢA族 B.Ga2O3可与盐酸反应生成GaCl3 C.Ga(OH)3可与NaOH反应生成NaGaO2 D.酸性:Al(OH)3>Ga(OH)3 解析:选D。Ga与Al同主族,均处于第ⅢA族,A项正确;Ga2O3与Al2O3的性质相似,可与盐酸反应生成GaCl3,B项正确;Ga(OH)3属于两性氢氧化物,与Al(OH)3的性质相似,能与NaOH溶液反应生成NaGaO2,C项正确;化学反应遵循强酸制弱酸的原理,在NaAlO2和NaGaO2的混合液中通入适量CO2,只有Al(OH)3沉淀,而没有Ga(OH)3沉淀,镓酸的酸性强于碳酸,则酸性:Al(OH)3<Ga(OH)3,D项错误。 7.从海水中提取镁的工艺流程如图所示: 下列说法错误的是( ) A.用此法提取镁的优点之一是原料来源丰富 B.步骤⑦电解MgCl2时阴极产生氯气 C.步骤⑥可将晶体置于HCl气体氛围中脱水 D.上述工艺流程中涉及化合、分解和复分解反应 解析:选B。海水中含有大量的镁,A项正确;电解MgCl2时,阳极产生Cl2,B项错误;加热脱水过程中Mg2+能水解生成Mg(OH)2,为防止Mg2+水解,应在HCl气体氛围中脱水,C项正确;②、③、④分别为分解反应、化合反应、复分解反应,D项正确。 8.(2019·试题调研)在一定条件下,向Al2O3和过量C粉的混合物中通入氯气,可制得易水解的AlCl3,实验装置如图所示。下列说法不正确的是( ) A.装置c中盛装的是浓硫酸 B.实验时应先点燃装置d处酒精灯,再点燃装置a处酒精灯 C.此反应中的尾气,除氯气外都可直接排放到大气中 D.该装置不完善,其中应改进的一项是在装置d、e之间添加一个干燥装置 解析:选C。装置a制取Cl2,装置b除去Cl2中的HCl,装置c干燥Cl2,装置d制备AlCl3,装置e处理尾气。装置c中盛装的是浓硫酸,用来干燥Cl2,A正确;实验时应先点燃装置d处酒精灯,再点燃装置a处酒精灯,可以充分利用Cl2,B正确;此反应中的尾气,除Cl2外还有CO等,不能直接排放到大气中,C错误;为防止装置e中的水蒸气进入装置d,应在装置d、e之间添加一个干燥装置,D正确。 9.下列曲线图与对应的选项相符合的是( ) A.向1 L浓度均为0.1 mol·L-1的NaAlO2、Ba(OH)2混合溶液中加入0.1 mol·L-1的稀H2SO4 B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液 C.向烧碱溶液中滴加明矾溶液 D.向AlCl3溶液中滴加过量氨水 解析:选A。A项,Ba(OH)2和NaAlO2中加入稀H2SO4,发生的反应依次为Ba2++2OH-+2H++SO===BaSO4↓+2H2O、AlO+H++H2O===Al(OH)3↓、Al(OH)3+3H+===Al3++3H2O,所以加入1 L稀H2SO4时Ba(OH)2反应完,再加0.5 L稀H2SO4时AlO反应完,再加1.5 L稀H2SO4时,Al(OH)3全部溶解,正确;B项,向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的NaOH溶液,发生的反应依次为Al3++3OH-===Al(OH)3↓、OH-+NH===NH3·H2O、Al(OH)3+OH-===AlO+2H2O,所以沉淀Al3+和溶解Al(OH)3所用NaOH溶液的体积之比为3∶1,而图像中是1∶1,错误;C项,向烧碱溶液中滴加明矾溶液,发生的反应依次为Al3++4OH-===AlO+2H2O、Al3++3AlO+6H2O===4Al(OH)3↓,所以无现象阶段与产生沉淀阶段所加入的明矾溶液体积之比为3∶1,错误;D项,向AlCl3溶液中滴加过量氨水,沉淀不会溶解,错误。 10.(2019·保定质检)工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如下: 对上述流程的判断正确的是( ) A.试剂X可以为氨水,沉淀中含有铁的化合物 B.CO2可以用H2SO4溶液或稀盐酸代替 C.反应Ⅱ中的离子方程式为CO2+AlO+2H2O===Al(OH)3↓+HCO D.工业上还可采用Fe还原Al2O3的方法制Al,成本更低 解析:选C。A项,试剂X应为强碱溶液,使Al2O3溶解;B项,若用强酸代替CO2,强酸过量时,Al(OH)3会溶解,不能保证生成Al(OH)3沉淀;D项,因Al比Fe活泼,不能用Fe置换Al。 二、非选择题 11.无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备AlCl3,流程如下: 已知:AlCl3、FeCl3分别在183 ℃、315 ℃时升华。 (1)铝离子的结构示意图为 ,实验室配制氯化铝溶液时加入盐酸的目的是________________________________________________________________________。 (2)氯化炉中Al2O3、Cl2和焦炭在高温下发生的反应化学方程式为________________; 炉气中残余的少量Cl2,可用NaOH溶液吸收,其离子方程式为______________。 (3)700 ℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围: 。 a.低于183 ℃ b.介于183 ℃和315 ℃之间 c.高于315 ℃ (4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。 m克样品NaAlO2溶液Al(OH)3n克Al2O3 计算该样品中AlCl3的质量分数:____________________________________ (结果用m、n表示,不必化简)。 答案:(1) 防止氯化铝水解 (2)Al2O3+3Cl2+3C2AlCl3+3CO Cl2+2OH-===ClO-+Cl-+H2O (3)b (4)×100% 12.氮化铝(AlN)是一种综合性能优良的陶瓷材料,能缓慢水解,不耐酸碱腐蚀。某化学实验小组在实验室制备AlN并测定产品纯度,设计实验如下。请回答: Ⅰ.制备AlN (1)实验时,以空气为原料制备AlN。按气流从左向右的方向,上述装置的正确连接顺序为j→______________→i(填仪器接口字母编号)。 (2)上述装置中,需要检漏的仪器名称为___________________________________。 (3)试剂X的作用为___________________________________________ ________________________________________________________________________。 (4)装置D中发生的反应化学方程式为_______________________________________ ________________________________________________________________________。 Ⅱ.测定产品纯度 (5)设计实验证明装置D的产品中含有Al单质:_________________________ ________________________________________________________________________ ________________________________________________________________________。 (6)测定产品纯度:取装置D中产品4.37 g,加入足量NaOH浓溶液,充分反应后,通入水蒸气,将生成的气体全部赶出,用V1 mL c1 mol/L的盐酸吸收;以酚酞做指示剂,用c2 mol/L的NaOH标准溶液滴定过量的盐酸,达到滴定终点时,消耗V2 mL NaOH标准溶液。则: ①达到滴定终点的现象为_______________________________________ ________________________________________________________________________。 ②产品中AlN的质量分数为________________________________________ ________________________________________________________________________(列出计算式即可)。 答案:(1)fe→dc→ab(或ba)→gh(或hg) (2)分液漏斗 (3)吸收空气中的水蒸气,避免其与还原铁粉反应干扰实验 (4)2Al+N22AlN (5)取装置D中少量产品于试管中,加入足量稀硫酸,有无色、无味的可燃性气体生成,则产品中含有Al单质(或其他合理答案) (6)①滴入最后一滴NaOH标准溶液时,溶液恰好从无色变为浅红色,且半分钟内不变色 ②×100% 13.(2019·安徽师大附中段考)用铝土矿(含30%SiO2、40.8%Al2O3和少量Fe2O3等)制取铝硅合金材料有湿法、干法等方法,其中干法制备的工艺流程如下: (1)若湿法处理铝土矿,用强酸浸取时,所得溶液中阳离子有__________________。 (2)焙烧除铁的反应化学方程式为4(NH4)2SO4+Fe2O32NH4Fe(SO4)2+3H2O+6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的转化率与温度的关系如图,最适宜的焙烧温度为__________________________________________________________。 (3)操作①包括加水溶解、________。 (4)用焦炭还原SiO2、Al2O3会产生中间产物SiC、Al4C3。写出高温下Al4C3与Al2O3反应生成铝单质的化学方程式:__________________________________________。 (5)铝硅合金材料中若含铁,会影响其抗腐蚀性,原因是 ________________________________________________________________________。 (6)不计损失,投入1 t铝土矿,当加入54 kg纯铝后,铝硅合金中m∶n=________。 解析:铝土矿加(NH4)2SO4焙烧除铁,Fe2O3转化为NH4Fe(SO4)2,同时生成氨,加水溶解、过滤,滤渣为SiO2和Al2O3,用焦炭在高温条件下还原SiO2、Al2O3得到铝硅熔体,再加纯铝搅拌,得到铝硅合金。 (1)铝土矿中的氧化铝和氧化铁能溶于强酸生成Al3+、Fe3+,另外还有剩余的H+,所以溶液中的阳离子有Al3+、Fe3+、H+。 (2)焙烧除铁时尽可能使氧化铁的转化率升高,并使氧化铝的转化率降低,由图可知在300 ℃时,氧化铁转化为硫酸盐的转化率很高,而氧化铝转化为硫酸盐的转化率最低,所以最适宜的焙烧温度为300 ℃。 (3)由流程分析可知,操作①包括加水溶解、过滤。 (4)在高温条件下,Al4C3与Al2O3反应生成Al和CO,其反应的化学方程式为Al4C3+Al2O36Al+3CO↑。 (5)Al、Fe形成原电池,Al的活泼性比Fe强,做负极,被腐蚀,所以铝硅合金材料中若含铁,容易发生电化学腐蚀。 (6)已知铝土矿中含30%SiO2、40.8%Al2O3,不考虑损失,投入1 t铝土矿,加入54 kg纯铝,则得到的铝硅合金中Al元素的总质量为1 000 kg×40.8%×+54 kg=270 kg,Si元素的总质量为1 000 kg×30%×=140 kg,则铝硅合金中m∶n=∶=2∶1。 答案:(1)Al3+、Fe3+、H+ (2)300 ℃ (3)过滤 (4)Al4C3+Al2O36Al+3CO↑ (5)铁与铝形成原电池,加快了铝的腐蚀 (6)2∶1查看更多