- 2021-04-13 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
湖北省武汉市2020届高三毕业生六月供题(二)理科综合化学试题
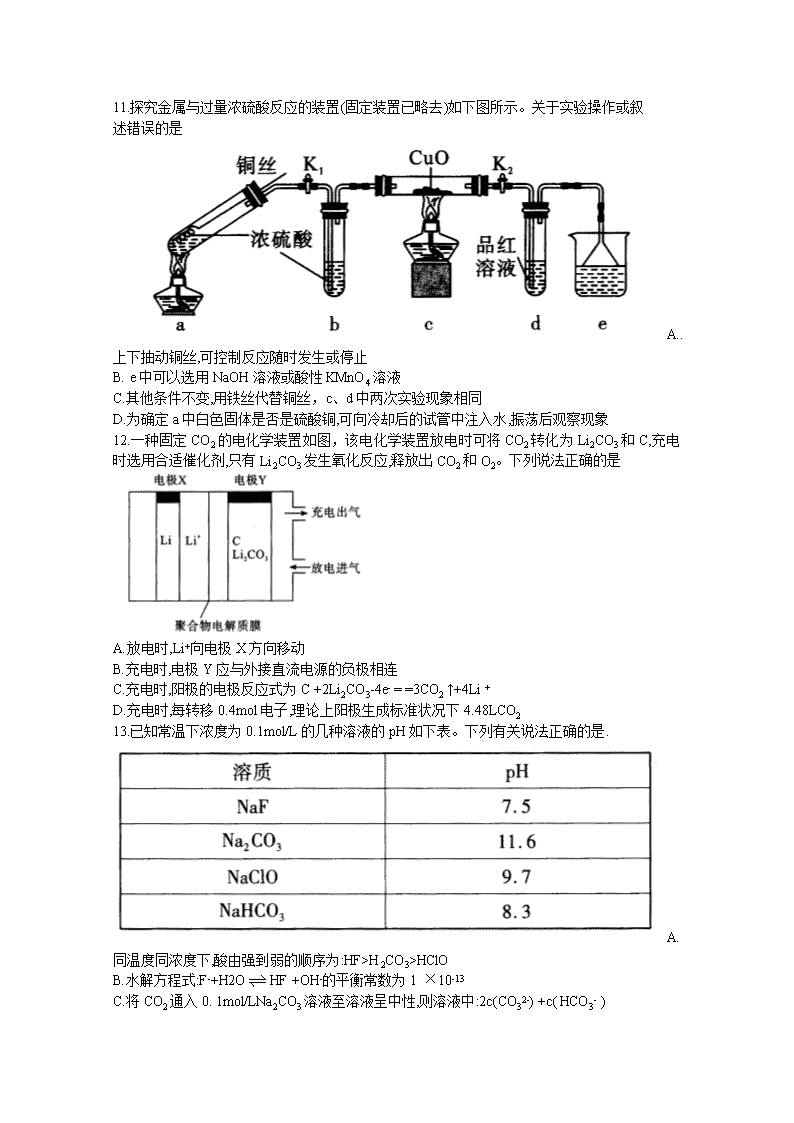
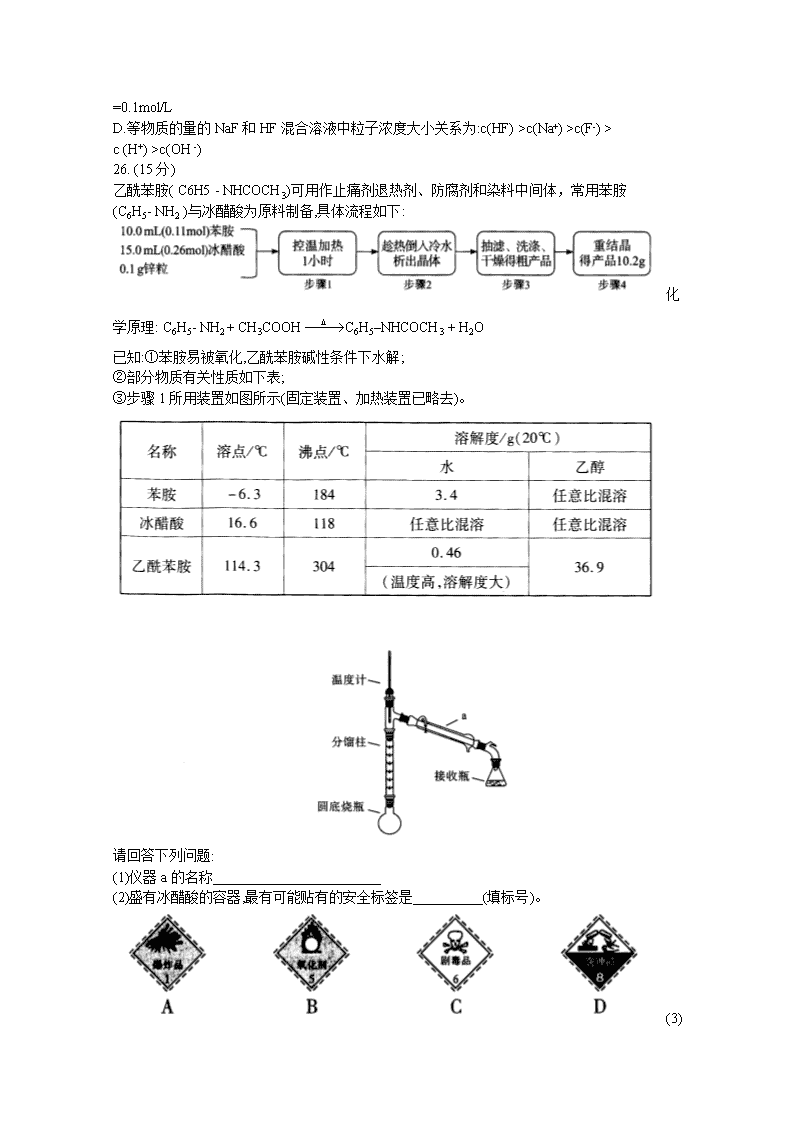
武汉市2020届高中毕业生六月供题(二) 理科综合试卷化学部分 武汉市教育科学研究院命制 2020. 6 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 V-51 Ru- 101 7.化学与生活、社会密切相关,下列有关说法中不正确的是 A.用NaHCO3和Al2(SO4)3溶液可以制作泡沫灭火剂 B.为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏 C.溴化银见光易分解,可用作胶片感光剂, D.硅胶多孔,常用作食品干燥剂 8.某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:Ksp[ Al(OH)3]=1.0×10-34 Ksp[Fe(OH)3]=4.0×10 -38 已知:“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子,该离子会水解,下列说法不正确的是 A.“酸浸”时TiO2发生反应的离子方程式为TiO2 +2H+= =TiO2+ +H2O B.“结晶”时温度需控制在70%以上,温度过低TiO2●xH2O产率降低 C.为使滤渣2沉淀完全,需“调pH"最小为4.3 D.MgCl2溶液制备MgCl2●6H2O需要在HCl的气氛下蒸发浓缩 9.有以下合成路线(部分反应条件已省略): 下列有关说法错误的是 A.物质X的名称为乙炔,其电子式为 B.物质Y中所有原子可能共平面 C.物质Z的同分异构体中含有苯环且苯环上有两个取代基的有3种 D.反应③的反应条件为O2、Cu/加热,反应类型为氧化反应 10. W、X、Y、Z均为短周期元素且原子序数依次增大,它们的原子最外层电子数为互不相等 的奇数,Y与W形成的阴离子(如图所示)中W不满足8电子稳定结构,W与Z的最高价之和为8。下列说法中错误的是 A.原子半径:Y>X> W B. Z2O是某种弱酸的酸酐 C.W与X形成的二元化合物只能含极性键 D.最高价氧化物对应水化物的酸性:Z> X 11.探究金属与过量浓硫酸反应的装置(固定装置已略去)如下图所示。关于实验操作或叙 述错误的是 A..上下抽动铜丝,可控制反应随时发生或停止 B. e中可以选用NaOH溶液或酸性KMnO4溶液 C.其他条件不变,用铁丝代替铜丝,c、d中两次实验现象相同 D.为确定a中白色固体是否是硫酸铜,可向冷却后的试管中注入水,振荡后观察现象 12.一种固定CO2的电化学装置如图,该电化学装置放电时可将CO2转化为Li2CO3和C,充电时选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2。下列说法正确的是 A.放电时,Li+向电极X方向移动 B.充电时,电极Y应与外接直流电源的负极相连 C.充电时,阳极的电极反应式为C +2Li2CO3-4e- = =3CO2 ↑+4Li + D.充电时,每转移0.4mol电子,理论上阳极生成标准状况下4.48LCO2 13.已知常温下浓度为0.1mol/L的几种溶液的pH如下表。下列有关说法正确的是. A.同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO B.水解方程式:F-+H2OHF +OH-的平衡常数为1 ×10-13 C.将CO2通入0. 1mol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-) +c( HCO3- ) =0.1mol/L D.等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF) >c(Na+) >c(F-) > c (H+) >c(OH -) 26. (15分) 乙酰苯胺( C6H5 - NHCOCH3)可用作止痛剂退热剂、防腐剂和染料中间体,常用苯胺 (C6H5- NH2 )与冰醋酸为原料制备,具体流程如下: 化学原理: C6H5- NH2 + CH3COOHC6H5–NHCOCH3 + H2O 已知:①苯胺易被氧化,乙酰苯胺碱性条件下水解; ②部分物质有关性质如下表; ③步骤1所用装置如图所示(固定装置、加热装置已略去)。 请回答下列问题: (1)仪器a的名称________________________ (2)盛有冰醋酸的容器,最有可能贴有的安全标签是__________(填标号)。 (3)加入锌粒,除了防止暴沸外,还能起到的作用是________________ (4)步骤1中控制温度计示数约105 °C的原因是_____________________ (5)判断反应基本完全的现象是_______________.,步骤3中洗涤乙酰苯胺粗产品最合适的试 剂是___________________(填标号)。 A.冰水 B.热水 C.15%的乙醇溶液 D. NaOH溶液 (6)步骤4中重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加人少量蒸馏水→加 入活性炭脱色→加热煮沸→ __________ →冷却结晶→过滤→洗涤→干燥。 (7)本实验中乙酰苯胺产率为_______________________。 27. (14分) 三氯化钌是一种重要的贵金 属化合物,广泛应用于氯碱工业中金属阳极钌涂层及加氢催化剂。 I.三氯化钌的制备 将金属钌粉与氯化钠混合后,加入微量还原性淀粉,将温度升高到800~1000°C,再往熔融的熔体中通入氯气,大部分钌粉转化为氯钌酸钠( Na2 RuCl6) ,再经过一系列化学工艺制备 出三氯化钌。 (1)生成氯钌酸钠的化学方程式为__________________ (2)升温阶段加入还原性淀粉的作用是__________________ III.三氯化钌的回收 从废弃催化剂回收三氯化钌的一种工艺流程如下图所示: 回答下列问题: (3)“氧化”时加H2SO4的目的______________________ (4)“吸收”过程中加入乙醇的作用是__________________________ (5)可用氢还原重量法测定产品的纯度,其原理为2RuCl3+3H2==2Ru+6HCl。某同学对产品纯度进行测定,所得数据记录如下: 则产品的纯度为________(用百分数表示,保留两位有效数字) (6)钌及其化合物在合成工业.上有广泛用途,下图是用钌( Ru)基催化剂催化合成甲酸的过程。每生成92g液态HCOOH放出62.4kJ的热量。 ①根据图示写出该反应的热化学方程式_______________ ②下列说法正确的是________ A.图示中物质I为该反应的催化剂 B.图示中参与循环的物质只有CO2和H2 C.反应的活化能为62.4 kJ●mol -1 28. (15分) 碳的化合物在工业上应用广泛,下面有几种碳的化合物的具体应用: (1)已知下列热化学方程式: i. CH2=CHCH3(g) +C12(g)==CH2ClCHClCH3(g) △H1= -133 kJ·mol -1 ii. CH2=CHCH3(g) +Cl2(g) = =CH2 =CHCH2Cl(g) +HCl(g) △H2= -100 kJ●mol -1 又已知在相同条件下,CH2=CHCH2Cl(g) + HCl(g)= =CH2CICHClCH3(g) 的正反应的活化能Ea(正)为132 kJ●mol -1 ,,则逆反应的活化能Ea(逆)为________kJ ·mol -1。 (2)查阅资料得知,反应CH3CHO(aq)= =CH4(g) +CO(g)在含有少量I2的溶液中分两步进行: 第I步反应为CH3CHO(aq) +I2(aq)-→CH3I(l) +HI(aq) +CO(g)(慢反应),第II步为快反应。增大I2的浓度________(填“能”或“ 不能”)明显增大总反应的平均速率,理由为_____________________________________。 (3)用催化剂Fe3(CO)12/ZSM -5催化CO2加氢合成乙烯的反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。 催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。 欲提高单位时间内乙烯的产量,在Fe3 (CO)12/ZSM -5中添加__________助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是_______________________________。 (4) 在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4) =2:1,发生反应:CH4(g) +2H2S(g) CS2(g) +4H2(g)。0. 11MPa时,温度变化对平衡时产物的物质的量分数的影响如下图所示: 为提高H2S的平衡转化率,除改变温度外,还可采取的措施是______________(列举一条)。N点对应温度下,该反应的Kp=______ ( MPa)2(Kp为以分压表示的平衡常数)。 (5)合成碳酸二甲酯的工作原理如下图所示。 阳极的电极反应式为_______,离子交换膜a为__________(填“阳膜”、“阴膜”)。 35. [化学一选修 3:物质结构与性质](15分) 锰及其化合物用途非常广泛,请回答下列问题: (1)Mn3+在水溶液中容易歧化为MnO2和Mn2+ ,下列说法合理的是________ A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型 B.根据Mn2+的电子构型可知,Mn4+中不含成对电子 C.Mn2+易被氧化,可能是因为Mn2+轨道内有大量自旋方向相同的电子 D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似 (2)锰的一种配合物的化学式为[ Mn( CO)5( CH3CN)]。配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是_________原子(填写元素名称) ,该分子中碳原子的杂化方式为 _________________________________。 (3)研究发现,在成甲醇反应(CO2 +3H2 =CH3OH +H2O)中, CO氧化物负载的Mn氧化物纳米粒子催化剂具有高活性。反应所涉及的4种物质中,沸点从高到低的顺序为___________ ,原因是_____________________________,硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在______,NO3 -的空间构型是______________. (用文字描述)。 (4)某锰氧化物的晶胞结构如图乙所示,该锰氧化物的化学式为___________,该晶体 中Mn的配位数是_______该晶体中Mn之间的最近距离为_____cm(用含a、b的代数式表示)。 36. [化学一选修 5:有机化学基础](15分) 化合物G是一种药物合成中间体,其合成路线如下: (1)化合物A的名称是______________。 (2)反应②和⑤的反应类型分别是___________、___________。 (3)写出C到D的反应方程式_______________________。 (4)E的分子式___________________。 (5)F中官能团的名称是______________________。 (6)X是G的同分异构体,X具有五元碳环结构,其核磁共振氢谱显示四组峰,且峰面积之比为6:2:1:1。写出两种符合要求的X的结构简式____________________________。 (7)设计由乙酸乙酯和1 ,4-二溴丁烷制备的合成路线________________________ (无机试剂任选)。查看更多