- 2021-04-12 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2015年10月浙江省普通高校招生选考科目考试化学试题(含答案)
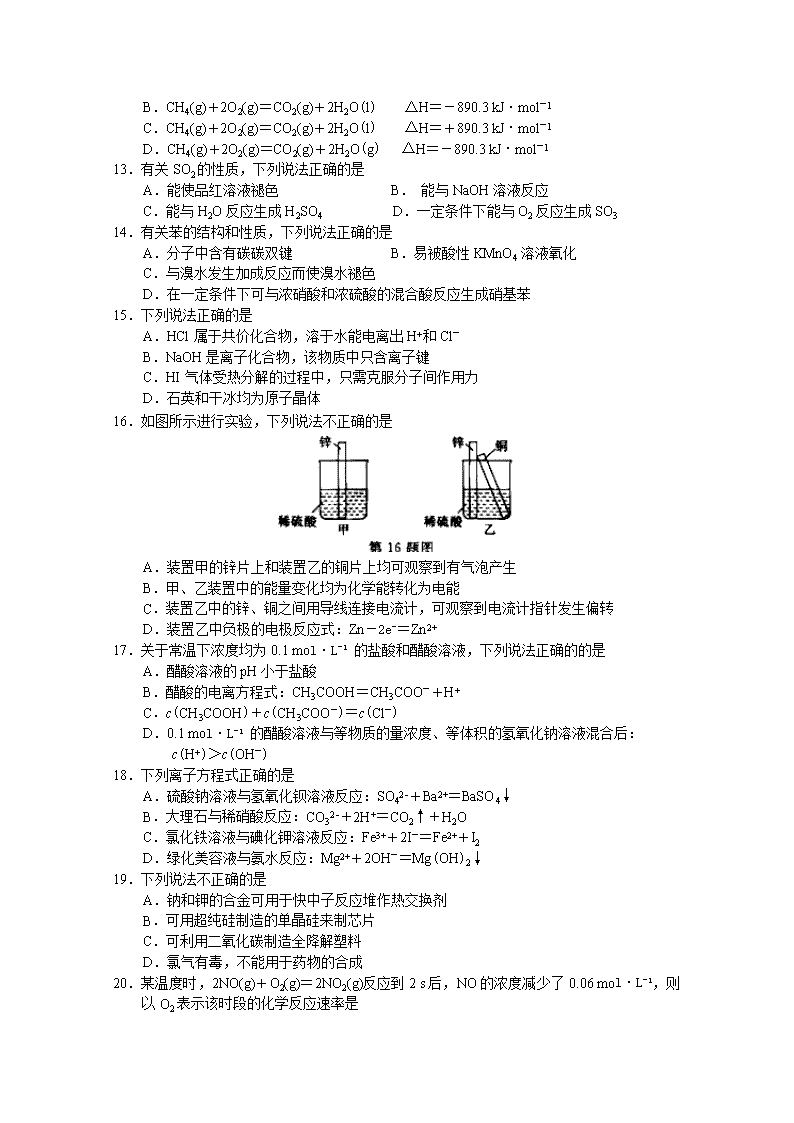
2015年10月浙江省普通高校招生选考科目考试 化学试题 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Si 28 S 32 Ca 40 Fe 56 Cu 64 Zn 65 一、选择题(本大题共25小题,每小题2分,共50分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分) 1.下列属于酸性氧化物的是 A.CO2 B.CaO C.K2SO4 D.NaOH 2.仪器名称为“容量瓶”的是 A. B. C. D. 3.常温下能与水反应的金属单质是 A.SiO2 B.Br2 C.Na2O D.Na 4.HCl+NaOH=NaCl+H2O的反应类型是 A.化合反应 B.置换反应 C.分解反应 D.复分解反应 5.下列物质中,属于可再生的能源是 A.氢气 B.石油 C.煤 D.天然气 6.硅元素在周期表中的位置是 A.第二周期ⅣA族 B.第三周期ⅣA族 C.第三周ⅥA族 D.第二周期ⅣA族 7.下列化学用语表述正确的是 A. 水分子的结构式: B. 氯化钠的电子式: C.氯气的比例模型: D.硫原子的结构示意图: 8.能产生“丁达尔效应”的是 A.饱和食盐水 B.Fe(OH)3胶体 C.盐酸 D.硫酸铜溶液 9.下列说法不正确的是 A.核素H的中子数是0 B.12C和14C互为同位素 C.金刚石、石墨和富勒烯互为同素异形体 D.CH3CH2OH和CH3OCH3互为同分异构体 10.实验室有两瓶失去标签的溶液,其中一瓶是H2SO4,另一瓶是蔗糖溶液。鉴别时,下列选用的试纸或试剂不正确的是 A.pH试纸 B.KCl溶液 C.BaCl2溶液 D.Na2CO3溶液 11.下列物质的水溶液因水解呈酸性的是 A. NaOH B.Na2CO3 C.NH4Cl D.HCl 12.已知1 mol CH4气体完全燃烧生成气态CO2和液态H2O,放出890.3 kJ热量,则表示该反应的热化学方程式正确的是 A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=+890.3 kJ·mol-1 B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1 C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=+890.3 kJ·mol-1 D.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1 13.有关SO2的性质,下列说法正确的是 A.能使品红溶液褪色 B. 能与NaOH溶液反应 C.能与H2O反应生成H2SO4 D.一定条件下能与O2反应生成SO3 14.有关苯的结构和性质,下列说法正确的是 A.分子中含有碳碳双键 B.易被酸性KMnO4溶液氧化 C.与溴水发生加成反应而使溴水褪色 D.在一定条件下可与浓硝酸和浓硫酸的混合酸反应生成硝基苯 15.下列说法正确的是 A.HCl属于共价化合物,溶于水能电离出H+和Cl- B.NaOH是离子化合物,该物质中只含离子键 C.HI气体受热分解的过程中,只需克服分子间作用力 D.石英和干冰均为原子晶体 16.如图所示进行实验,下列说法不正确的是 A.装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生 B.甲、乙装置中的能量变化均为化学能转化为电能 C.装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转 D.装置乙中负极的电极反应式:Zn-2e-=Zn2+ 17.关于常温下浓度均为0.1 mol·L-1 的盐酸和醋酸溶液,下列说法正确的的是 A.醋酸溶液的pH小于盐酸 B.醋酸的电离方程式:CH3COOH=CH3COO-+H+ C.c(CH3COOH)+c(CH3COO-)=c(Cl-) D.0.1 mol·L-1 的醋酸溶液与等物质的量浓度、等体积的氢氧化钠溶液混合后: c(H+)>c(OH-) 18.下列离子方程式正确的是 A.硫酸钠溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ B.大理石与稀硝酸反应:CO32-+2H+=CO2↑+H2O C.氯化铁溶液与碘化钾溶液反应:Fe3++2I-=Fe2++I2 D.绿化美容液与氨水反应:Mg2++2OH-=Mg(OH)2↓ 19.下列说法不正确的是 A.钠和钾的合金可用于快中子反应堆作热交换剂 B.可用超纯硅制造的单晶硅来制芯片 C.可利用二氧化碳制造全降解塑料 D.氯气有毒,不能用于药物的合成 20.某温度时,2NO(g)+O2(g)=2NO2(g)反应到2 s后,NO的浓度减少了0.06 mol·L-1,则以O2表示该时段的化学反应速率是 A.0.03 mol·L-1·s-1 B.0.015 mol·L-1·s-1 C.0.12 mol·L-1·s-1 D.0.06 mol·L-1·s-1 21.下列说法正确的是 A.棉花和蚕丝的主要成分都是纤维素 B.蛋白质在一定条件发生水解反应生成葡萄糖 C.煤的气化是在高温下煤和水蒸气作用转化为可燃性气体的过程 D.食用植物油的主要成分是不饱和高级脂肪酸甘油酯,属于高分子化合物 22.设NA为阿伏伽德罗常数的值,下列说法正确的是 A.NA个氧分子与NA个氢分子的质量之比为8︰1 B.100 mL 1.0 mol·L-1 FeCl3溶液与足量Cu反应,转移的电子数为0.2 NA C.标准状况下,11.2 LCCl4中含有C-Cl键的数目为2NA D.NA个D2O分子中,含有10 NA个电子 23.右图为元素周期表中短周期主族非金属元素的一部分,下列说法不正确的是 A.W的原子序数可能是Y的两倍 B.Z的原子半径比X的大 C.Y元素的非金属性比Z元素的强 D.Z的最高价氧化物对应的水化物的酸性比W的强 24.下列说法不正确的是 A.定容时,因不慎使液面高于容量的刻度线,可用滴管将多余液体吸出 B.焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧,然后再进行实验 C.将新制氯水滴入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色 D.取少量晶体放入试管中,再加入适量NaOH溶液,加热,在试管口用湿润的红色石蕊试纸检验,若试纸变蓝,则可证明该晶体中含有NH4+ 25.已知氧化性Br2>Fe3+。向含溶质a mol的FeBr2溶液中通入a mol Cl2,充分反应。下列说法不正确的是 A.离子的还原性强弱:Fe2+>Br->Cl- B.当a≥2b时,发生的离子反应:2Fe2++Cl2=2Fe3++2Cl- C.当a=b时,反应后的离子浓度:c(Fe3+)︰c(Br-)︰c(Cl-)=1︰2︰2 D.当3a≤2b时,发生的离子反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- 二、非选择题(本大题共7小题,共50分) 26.(4分)气态烃A中碳元素与氢元素的质量比为6︰1.淀粉在一定条件下水解可生成B。B在人体组织中缓慢氧化,放出热量,提供生命活动所需能量。有关物质的转化关系如下图: 请回答: (1)①的反应类型是 。 (2)向试管中加入2 mL10%氢氧化钠溶液,滴加4~5滴5%硫酸铜溶液,振荡后加入2 mL10% B溶液,加热。写出加热后观察到的现象 。 (3)反应③的化学方程式是 。 27.(6分)某酸性废液中含有Fe2+、Cu2+、Ba2+ 三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境。 请回答: (1)沉淀a中含有的单质是 。 (2)沉淀c的化学式是 。 (3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是 。 28.(6分)右图为实验室制取乙酸乙酯的装置。 请回答: (1)检验该装置气密性的方法是 。 (2)浓硫酸的作用是 。 (3)下列有关该实验的说法中,正确的是 。 A.向a试管中加入沸石,其作用是防止加热时液体爆沸 B.饱和碳酸钠溶液可以出去产物中混有的乙酸 C.乙酸乙酯是一种无色透明、密度比水大的油状液体 D.若原料为CH3COOH和CH3CH218OH,则乙酸乙酯中不含18O 29.(4分)量取8.0 mL 5.0 mol·L-1 H2SO4溶液,加蒸馏水稀释至100 mL,取两份稀释后的H2SO4溶液各25 mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。请计算: (1)稀释后H2SO4溶液的物质的量浓度为 mol·L-1。 (2)加入Fe的质量至少有 g 30.【加试题】(10分) 由某精矿石(MCO3·ZCO3)可以制备单质M,制备过程中排放出的二氧化碳可以作为原料制备甲醇,取该矿石样品1.84g,高温灼烧至恒重,得到0.96g仅含两种金属氧化物的固体,其中m(M)︰m(Z)=3:5,请回答: (1)该矿石的化学式为 。 (2)①以该矿石灼烧后的固体产物为原料,真空高温条件下用单质硅还原,仅得到单质M和一种含氧酸盐(只含Z、Si和O元素,且Z和Si的物质的量之比为2︰1)。写出该反应的化学方程式 。 ②单质M还可以通过电解熔融MCl2得到,不能用电解MCl2溶液的方法制备M的理由是 。 (3)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应: 反应1:CO2(g)+H2(g)CO(g)+H2O(g) △H1 反应2:CO(g)+2H2(g)CH3OH(g) △H2 反应3:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1 其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图1所示。 则△H1 △H2 (填“大于”、“小于”、“等于”),理由是 。 (4)在温度T1时,使体积比为3︰1的H2和CO2在体积恒定的密闭容器内进行反应。T1温度下甲醇浓度随时间变化曲线如图2所示;不改变其他条件,假定t时刻迅速降温到T2,一段时间后体系重新达到平衡。试在图中画出t时刻后甲醇浓度随时间变化至平衡的示意曲线。 31.【加试题】(10分)纳米CdSe(硒化镉)可用作光学材料。在一定条件下,由Na2SO3和Se(硒,与S为同族元素)反应生成Na2SeSO3(硒代硫酸钠);再由CdCl2形成的配合物与Na2SeSO3反应制得CdSe纳米颗粒。流程图如下: 注:①CdCl2能与配位剂L形成配合物[Cd(L)n]Cl2 [Cd(L)n]Cl2=[Cd(L)n]2++2Cl-;[Cd(L)n]2+Cd2++nL ②纳米颗粒通常指平均粒径为1~100nm的粒子 请回答: (1)图1加热回流装置中,仪器a的名称是 ,进水口为 (填1或2) (2)①分离CdSe纳米颗粒不宜采用抽滤的方法,理由是 。 ②有关抽滤,下列说法正确的是 。 A.滤纸应比漏斗内径略小,且能盖住所有小孔 B.图2抽滤装置中只有一处错误,即漏斗颈口斜面没有对着吸滤瓶的支管口 C.抽滤得到的滤液应从吸滤瓶的支管口倒出 D.抽滤完毕后,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关水龙头,以防倒吸 (3)研究表明,CdSe的生成分两步:①SeSO32-在碱性条件下生成HSe-;②HSe-与Cd2+反应生成CdSe。 完成第①步反应的离子方程式 SeSO32-+ =HSe-+ 。 写出第②步反应的离子方程式 。 (4)CdSe纳米颗粒的大小影响其发光性质。某研究小组在一定配位剂浓度下,探究了避光加热步骤中反应时间和温度对纳米颗粒平均粒径的影响,如图3所示;同时探究了某温度下配位剂浓度对纳米颗粒平均粒径的影响,如图4所示。 下列说法正确的是 。 A.改变反应温度和反应时间,可以得到不同发光性质的CdSe纳米颗粒 B.在图3所示的两种温度下,只有60℃反应条件下可得到2.7 nm的CdSe纳米颗粒 C.在其它条件不变时,若要得到较大的CdSe纳米颗粒,可采用降低温度的方法 D.若要在60℃得到3.0 nm的CdSe纳米颗粒,可尝试降低配位剂浓度的方法 32.【加试题】(10分)乙酰基扁桃酰氯是一种医药中间体。某研究小组以甲苯和乙醇为主要原料,按下列路线合成乙酰基扁桃酰氯。 已知: 请回答: (1)D的结构简式 。 (2)下列说法正确的是 。 A.化合物A不能发生取代反应 B.化合物B能发生银镜反应 C.化合物C能发生氧化反应 D.从甲苯到化合物C的转化过程中,涉及到的反应类型有取代反应、加成反应和氧化反应 (3)E+F→G的化学方程式是 。 (4)写出化合物D同时符合下列条件的所有可能的同分异构体的结构简式 。 ①红外光谱检测表明分子中含有氰基(-CN); ②1H-NMR谱检测表明分子中有苯环,且苯环上有两种不同化学环境的氢原子 (5)设计以乙醇为原料制备F的合成路线(用流程图表示;无机试剂任选)。查看更多