- 2021-04-12 发布 |
- 37.5 KB |
- 200页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习工艺流程课件(200张)
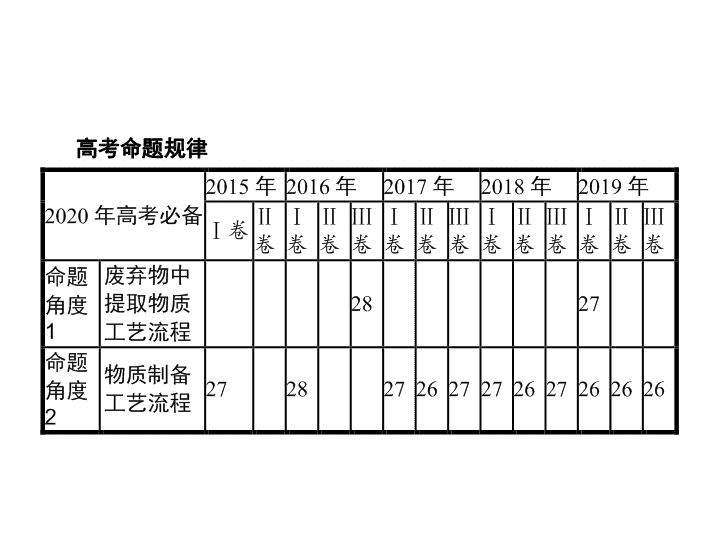
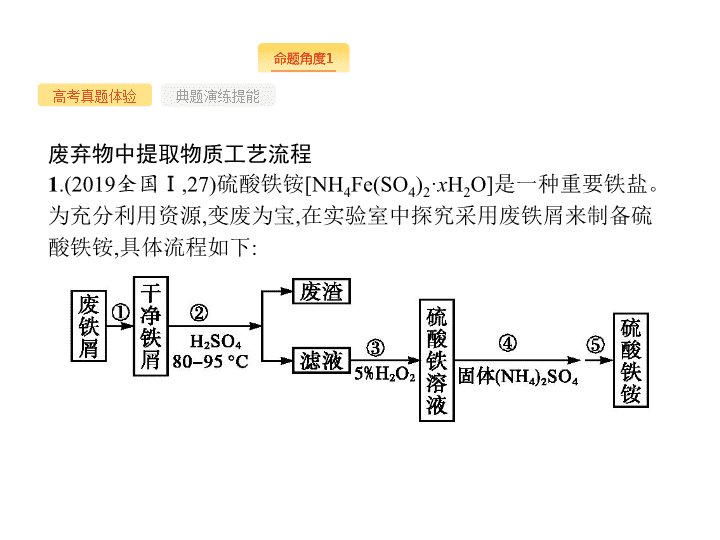
题型八 工艺流程题 - 2 - 高考命题 规律 - 3 - 高考真题体验 典题演练提能 废弃物中提取物质工艺流程 1 .(2019 全国 Ⅰ ,27) 硫酸铁铵 [NH 4 Fe(SO 4 ) 2 · x H 2 O] 是一种重要铁盐。为充分利用资源 , 变废为宝 , 在实验室中探究采用废铁屑来制备硫酸铁铵 , 具体流程如下 : - 4 - 高考真题体验 典题演练提能 回答下列问题 : (1) 步骤 ① 的目的是去除废铁屑表面的油污 , 方法是 。 (2) 步骤 ② 需要加热的目的是 , 温度保持 80~95 ℃ , 采用的合适加热方式是 。铁屑中含有少量硫化物 , 反应产生的气体需要净化处理 , 合适的装置为 ( 填标号 ) 。 (3) 步骤 ③ 中选用足量的 H 2 O 2 , 理由是 。分批加入 H 2 O 2 , 同时为了 , 溶液要保持 pH 小于 0.5 。 - 5 - 高考真题体验 典题演练提能 (4) 步骤 ⑤ 的具体实验操作有 , 经干燥得到硫酸铁铵晶体样品。 (5) 采用热重分析法测定硫酸铁铵晶体样品所含结晶水数 , 将样品加热到 150 ℃ 时失掉 1.5 个结晶水 , 失重 5.6% 。硫酸铁铵晶体的化学式为 。 答案 : (1) 碱煮水洗 (2) 加快反应 热水浴 C (3) 将 Fe 2+ 全部氧化为 Fe 3+ ; 不引入杂质 抑制 Fe 3+ 水解 (4) 加热浓缩、冷却结晶、过滤 ( 洗涤 ) (5)NH 4 Fe(SO 4 ) 2 ·12H 2 O - 6 - 高考真题体验 典题演练提能 解析 : (1) 油污在碱性溶液中发生水解反应生成可溶于水的物质 , 因此可使用碱煮水洗的方法去除废铁屑表面的油污。 (2) 加热可以增大溶解速率 ; 温度低于 100 ℃ , 因此可用水浴加热 ; 硫化氢可与碱反应 , 因此可用碱溶液来吸收 , 为了防止倒吸 , 应选用的装置为 C 。 (3) 为了将 Fe 2+ 全部转化为 Fe 3+ , 应选用足量的 H 2 O 2 ; 生成的 Fe 3+ 能发生水解反应 ,H 2 O 2 与 Fe 2+ 反应消耗 H + , 为了抑制 Fe 3+ 发生水解反应 , 应保持溶液的 pH 小于 0.5 。 (4) 由溶液得到晶体的操作为加热浓缩、冷却结晶、过滤 ( 洗涤 ) 。 (5) 设硫酸铁铵晶体的物质的量为 1 mol, 则失去水的物质的量为 1.5 mol, 质量为 27 g, 由此可知 , 硫酸铁铵晶体的相对分子质量 为 - 7 - 高考真题体验 典题演练提能 2 .(2019 江苏 ,19) 实验室以工业废渣 ( 主要含 CaSO 4 ·2H 2 O, 还含少量 SiO 2 、 Al 2 O 3 、 Fe 2 O 3 ) 为原料制取轻质 CaCO 3 和 (NH 4 ) 2 SO 4 晶体 , 其实验流程如下 : - 8 - 高考真题体验 典题演练提能 (2) 将氨水和 NH 4 HCO 3 溶液混合 , 可制得 (NH 4 ) 2 CO 3 溶液 , 其离子方程式为 ; 浸取废渣时 , 向 (NH 4 ) 2 CO 3 溶液中加入适量浓氨水的目的是 。 - 9 - 高考真题体验 典题演练提能 (3) 废渣浸取在下图所示的装置中进行。控制反应温度在 60~70 ℃ , 搅拌 , 反应 3 小时。温度过高将会导致 CaSO 4 的转化率下降 , 其原因是 ; 保持温度、反应时间、反应物和溶剂的量不变 , 实验中提高 CaSO 4 转化率的操作有 。 (4) 滤渣水洗后 , 经多步处理得到制备轻质 CaCO 3 所需的 CaCl 2 溶液。设计以水洗后的滤渣为原料 , 制取 CaCl 2 溶液的实验方案 : [ 已知 pH=5 时 Fe(OH) 3 和 Al(OH) 3 沉淀完全 ;pH=8.5 时 Al(OH) 3 开始溶解。实验中必须使用的试剂 : 盐酸和 Ca(OH) 2 ] 。 - 10 - 高考真题体验 典题演练提能 答案 : (1)1.6×10 4 ( 3) 温度过高 ,(NH 4 ) 2 CO 3 分解 加快搅拌速率 (4) 在搅拌下向足量稀盐酸中分批加入滤渣 , 待观察不到气泡产生后 , 过滤 , 向滤液中分批加入少量 Ca(OH) 2 , 用 pH 试纸测量溶液 pH, 当 pH 介于 5~8.5 时 , 过滤 - 11 - 高考真题体验 典题演练提能 (3) 温度超过 70 ℃ 时 ,(NH 4 ) 2 CO 3 发生分解 , 浓度 降低 , 导致 CaSO 4 转化率下降 ; 在其他条件不变时 , 加快搅拌速率、增大反应物接触面积等 , 均可大大加快反应速率 , 提高 CaSO 4 的转化率。 - 12 - 高考真题体验 典题演练提能 (4) 根据题给条件 , 设计实验流程 为 - 13 - 高考真题体验 典题演练提能 3 .(2016 全国 Ⅲ ,28) 以硅藻土为载体的五氧化二钒 (V 2 O 5 ) 是接触法生产硫酸的催化剂。从废钒催化剂中回收 V 2 O 5 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为 : 以下是一种废钒催化剂回收工艺路线 : - 14 - 高考真题体验 典题演练提能 - 15 - 高考真题体验 典题演练提能 (4)“ 离子交换 ” 和 “ 洗脱 ” 可简单表示为 : ( ROH 为强碱性阴离子交换树脂 ) 。为了提高洗脱效率 , 淋洗液应该呈 性 ( 填 “ 酸 ”“ 碱 ” 或 “ 中 ”) 。 (5)“ 流出液 ” 中阳离子最多的是 。 (6)“ 沉钒 ” 得到偏钒酸铵 (NH 4 VO 3 ) 沉淀 , 写出 “ 煅烧 ” 中发生反应的化学方程式 。 - 16 - 高考真题体验 典题演练提能 - 17 - 高考真题体验 典题演练提能 - 18 - 高考真题体验 典题演练提能 1 .(2019 湘赣十四校第一次联考 ) 银铜合金广泛应用于航空工业 , 从银铜合金的切割废料中回收银并制备铜产品的工艺如下 : 已知 :Al(OH) 3 和 Cu(OH) 2 开始分解的温度分别为 450 ℃ 和 80 ℃ 。 (1) 电解精炼银时 , 粗银作 极 , 另一电极上的电极反应式为 。 (2) 加快渣料 ( 含少量银 ) 溶于稀硫酸的措施有 、 ( 写出两种 ) 。 - 19 - 高考真题体验 典题演练提能 (3) 滤渣 A 与稀硝酸反应 , 产生的气体在空气中迅速变为红棕色 , 滤渣 A 与稀硝酸反应的离子方程式为 。 (4) 煮沸 CuSO 4 混合溶液的过程中 , 得到固体 B, 则固体 B 的组成为 ; 在生成固体 B 的过程中 , 需控制 NaOH 的加入量 , 若 NaOH 过量 , 则因过量引起的反应的离子方程式为 。 (5) 硫酸铜溶液可用于浸取硫铁矿中的铁元素 , 浸取时发生复杂的氧化还原反应。反应体系中除 CuSO 4 和 FeS 2 外 , 还有 H 2 SO 4 、 Cu 2 S 、 FeSO 4 和 H 2 O, 下列对该反应的分析正确的是 ( 填字母代号 ) 。 A. 氧化剂为 CuSO 4 和 FeS 2 B. 反应后溶液的 pH 降低 C. 被氧化的 FeS 2 占总量的 30% D. 每转移 2 mol 电子消耗 3 mol CuSO 4 - 20 - 高考真题体验 典题演练提能 解析 : 由工艺流程图可知 , 废料在空气中熔炼时 ,Cu 被氧化 , 滤渣中含有 CuO 及少量 Ag, 向滤渣中加入硫酸进行酸浸 ,CuO 与硫酸反应 , 过滤得到硫酸铜溶液 ( 含有硫酸 ), 滤渣 A 为 Ag; 向滤液中加入硫酸铝、氢氧化钠 , 煮沸后过滤得到的固体 B 为氢氧化铝、氧化铜 , 煅烧中二者反应得到 CuAlO 2 。 - 21 - 高考真题体验 典题演练提能 - 22 - 高考真题体验 典题演练提能 - 23 - 高考真题体验 典题演练提能 2 .(2019 山东德州二模 ) 金属 Co 、 Ni 性质相似 , 在电子工业以及金属材料方面应用广泛。现以含钴、镍、铝的废渣 ( 所含主要成分为 CoO 、 Co 2 O 3 、 Ni 、少量杂质 Al 2 O 3 ) 提取钴、镍的工艺如下 : - 24 - 高考真题体验 典题演练提能 (1) 酸浸时 SO 2 的作用是 。 (2) 除铝时加入碳酸钠产生沉淀的离子反应方程式是 。 (3) 从有机层提取出的 Ni 2+ 可用于制备氢镍电池 , 该电池工作原理为 : NiOOH+MH Ni(OH) 2 +M , 电池放电时正极反应式为 。 - 25 - 高考真题体验 典题演练提能 (4) 用 CoCO 3 为原料采用微波水热法和常规水热法均可制得使 H 2 O 2 分解的高效催化剂 Co x Ni (1- x ) Fe 2 O 4 ( 其中 Co 、 Ni 均为 +2 价 ) 。如图是用两种不同方法制得的 Co x Ni (1- x ) Fe 2 O 4 在 10 ℃ 时催化分解 6% 的 H 2 O 2 溶液的相对初始速率随 x 变化的曲线 : ① H 2 O 2 的电子式为 ; ② 由图中信息可知 : 法制取的催化剂活性更高 ; ③ Co 2+ 、 Ni 2+ 两种离子中催化效果更好的是 。 (5) 已知煅烧 CoCO 3 时 , 温度不同 , 产物不同。在 400 ℃ 条件下充分煅烧 CoCO 3 , 得到固体氧化物 2.41 g,CO 2 的体积为 0.672 L( 标准状况下 ), 则此时所得固体氧化物的化学式为 。 - 26 - 高考真题体验 典题演练提能 解析 : (1) 废渣中含有 CoO 、 Co 2 O 3 、 Ni 、少量杂质 Al 2 O 3 等 , 酸浸时固体溶解 , 可得到含 Co 2+ 、 Co 3+ 、 Al 3+ 、 Ni 2+ 的溶液 , 通入 SO 2 的作用是将 Co 3+ 还原为 Co 2+ 。 - 27 - 高考真题体验 典题演练提能 ② 由图中信息可知 , 微波水热法制得的催化剂使 H 2 O 2 分解的初始反应速率相对较大 , 故微波水热法制取的催化剂活性更高。 ③ 由图像可以看出 , x 值越大 ,H 2 O 2 分解反应初始速率越大 , 说明 Co 2+ 的催化效果比 Ni 2+ 好。 (5) 反应生成的 CO 2 为 0.03 mol, 根据 C 原子守恒 , n (Co)= n (CoCO 3 )= n (CO 2 )=0.03 mol,2.41 g 氧化物中含 氧 - 28 - 高考真题体验 典题演练提能 3 .(2019 河南洛阳第四次模拟 ) 精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥 ( 主要含有铜、银、金、少量的镍 ) 中分离提取多种金属元素的工艺流程如下 : - 29 - 高考真题体验 典题演练提能 已知 : ⅰ . 分金液中含金离子主要为 [AuCl 4 ] - ; 分金渣的主要成分为 AgCl; ⅱ . 分银液中含银离子主要成分为 [Ag(SO 3 ) 2 ] 3- , 且存在如 下平 ⅲ .“ 分铜 ” 时各元素的浸出率如下表所示。 (1) 由表中数据可知 ,Ni 的金属性比 Cu 。分铜渣中银元素的存在形式为 ( 用化学用语表示 ) 。 “ 分铜 ” 时 , 如果温度过高 , 会有明显的放出气体现象 , 原因是 。 (2)“ 分金 ” 时 , 单质金发生反应的离子方程式为 。 - 30 - 高考真题体验 典题演练提能 (3)Na 2 SO 3 溶液中含硫微粒物质的量分数与 pH 的关系如图所示 : “ 沉银 ” 时 , 需加入硫酸调节溶液的 pH=4, 分析能够析出 AgCl 的原因为 。 调节溶液的 pH 不能过低 , 理由为 ( 用离子方程式表示 ) 。 (4) 已知 K sp (Ag 2 SO 4 )=1.4×10 -5 , 沉银时为了保证不析出 Ag 2 SO 4 , 应控制溶液 中 浓度 ( 假定溶液中 Ag + 浓度为 0.1 mol·L -1 ) 。 - 31 - 高考真题体验 典题演练提能 (5) 工业上 , 用镍为阳极 , 电解 0.1 mol·L -1 NiCl 2 溶液与一定量 NH 4 Cl 组成的混合溶液 , 可得高纯度的球形超细镍粉。当其他条件一定时 ,NH 4 Cl 的浓度对阴极电流效率及镍的成粉率的影响如图所示 : 为获得髙纯度的球形超细镍粉 ,NH 4 Cl 溶液的浓度最好控制为 g·L -1 , 当 NH 4 Cl 溶液的浓度大于 15 g·L -1 时 , 阴极有无色无味气体生成 , 导致阴极电流效率降低 , 该气体为 。 - 32 - 高考真题体验 典题演练提能 解析 : (1) 由表中数据可知 , 镍的浸出率比铜高 , 说明镍更容易被氧化 , 故金属性 Ni 比 Cu 强。根据流程图分析 ,“ 分铜 ” 时加入足量的 NaCl 可以使溶解出的 Ag + 形成 AgCl 进入分铜渣 , 分铜渣中银元素的存在形式为 Ag 、 AgCl 。 “ 分铜 ” 时 , 如果温度过高 ,H 2 O 2 发生分解 , 会有明显的气体放出现象 。 - 33 - 高考真题体验 典题演练提能 - 34 - 高考真题体验 典题演练提能 - 35 - 高考真题体验 典题演练提能 4 .(2019 四川攀枝花三模 ) 废旧硬质合金刀具中含碳化钨 (WC) 、金属钴 (Co) 及少量杂质铁 , 利用电解法回收 WC 和制备 Co 2 O 3 的工艺流程如下 : 已知 : 在上述流程中 , 各种金属离子形成氢氧化物沉淀的 pH 范围如下 : - 36 - 高考真题体验 典题演练提能 回答下列问题 : (1) 以废旧刀具作阳极 , 不锈钢作阴极 , 盐酸为电解质溶液。电解时阳极的电极反应有 : Co-2e - === Co 2 + 和 。 (2) 通入氨气的目的是调节溶液的 pH, 除去铁元素。由表中的数据可知 , 理论上可选择的 pH 范围是 。 (3) 生成 CoCO 3 的离子方程式是 。 (4) 实验测得 NH 4 HCO 3 溶液显碱性。制备 CoCO 3 时 , 不能将滤液加入 NH 4 HCO 3 溶液中 , 原因是 。 (5) 已知 : K sp (CoCO 3 )=1.6×10 -13 , K sp (CoC 2 O 4 )=6.3×10 -8 。若仅从沉淀转化角度考虑 , 在 0.01 mol·L -1 Na 2 C 2 O 4 溶液中加入 CoCO 3 固体能否转化为 CoC 2 O 4 沉淀 ? 通过计算说明 : 。 (6) 洗涤 CoCO 3 不充分对最终产品纯度并无影响 , 但在焙烧时会造成环境污染 , 主要原因是 。 (7)CoCO 3 生成 Co 2 O 3 的化学方程式是 。 - 37 - 高考真题体验 典题演练提能 - 38 - 高考真题体验 典题演练提能 解析 : 由题给工艺流程知 , 以盐酸为电解质溶液 , 以废旧刀具作阳极 , 不锈钢作阴极 , 进行电解 , 电解过程中 WC 进入阳极泥中 , 溶液中含有 Fe 2+ 和 Co 2+ , 加入双氧水 ,Fe 2+ 被氧化为 Fe 3+ , 通入氨气 , 调节 pH 在 3.2 到 6.5 之间 , 将 Fe 3+ 转化为 Fe(OH) 3 沉淀过滤除去 , 滤液中含有 Co 2+ , 加入碳酸氢铵溶液生成碳酸钴 , 焙烧生成 Co 2 O 3 。 (1) 电解时废旧刀具作阳极 , 不锈钢作阴极 , 盐酸作电解质溶液 , 依据阳极金属放电规律可知 , 除了 Co 失电子以外还有 Fe 也会失电子 , 其电极反应式为 Fe-2e - === Fe 2 + ; (2) 通入氨气的目的是调节溶液的 pH, 使 Fe 3+ 转化为 Fe(OH) 3 而除去。由表中的数据可知 , 理论上可选择的 pH 范围是 3.2 ≤ pH<6.5 ; - 39 - 高考真题体验 典题演练提能 (4) 根据题意可知 ,NH 4 HCO 3 溶液显碱性 , 则若将滤液加入 NH 4 HCO 3 溶液中会生成 Co(OH) 2 杂质 ; - 40 - 高考真题体验 典题演练提能 5 .(2019 黑龙江大庆一中模拟 ) 钴元素由于其良好的物理化学性质 , 被广泛应用于生产、生活中。以含钴废料 ( 含 CoO 、 Co 2 O 3 、单质 Al 、 Li 等 ) 为原料制取粗 CoCl 2 ·6H 2 O 的流程如下图所示 : - 41 - 高考真题体验 典题演练提能 请回答下列问题 : (1) 步骤 Ⅰ 中主要反应的化学方程式为 。 (2) 已知 Co 2 O 3 具有强氧化性 , 若步骤 Ⅱ 中浸出剂为盐酸 , 造成的后果是 。 (3) 步骤 Ⅲ 中 ① 的目的是除去 Al 3+ , 写出该步反应的离子方程式 。 (4) 若在实验室煅烧 CoCO 3 , 所需的硅酸盐质仪器除酒精灯和玻璃棒外 , 还有 、 ( 填仪器名称 ) 。 (5) 操作 ① 是在 HCl 氛围中进行的 , 其步骤是 、 、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水 , 其优点是 。 - 42 - 高考真题体验 典题演练提能 (6) 某同学用标准硝酸银溶液滴定未知浓度的 CoCl 2 溶液 , 下列可作为指示剂的是 ( 填选项 , 忽略亚钴离子的颜色干扰 ) 。 A.KCl B.KSCN C.K 2 CrO 4 D.K 2 S 已知几种物质在 20 ℃ 时的颜色及 K sp 如下表 : - 43 - 高考真题体验 典题演练提能 (4) 坩埚 泥三角 (5) 蒸发浓缩 冷却结晶 减少晶体的溶解损失 (6)C - 44 - 高考真题体验 典题演练提能 解析 : 含钴废料 ( 含 CoO 、 Co 2 O 3 、单质 Al 、 Li) 加入碱液 ,Al 能溶于强碱溶液生成偏铝酸盐和氢气 , 锂能够与水反应而溶解 , 过滤得到钴渣和含铝溶液 ; 钴渣中加入浸出剂得到含有 Co 2+ 及微量 Li + 、 Al 3+ 的溶液 , 向该溶液中加入 20% 碳酸钠溶液调节溶液的 pH 为 4.5~5, 然后加入 NaF, 过滤得到铝锂渣和滤液 ; 滤液中加入 30% 碳酸钠溶液调节溶液的 pH 为 8~8.5, 得到 CoCO 3 沉淀 , 煅烧碳酸钴得到 CoO;CoO 与盐酸反应生成 CoCl 2 , 蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得 CoCl 2 ·6H 2 O 结晶水合物 。 (2)Co 2 O 3 具有强氧化性 , 若步骤 Ⅱ 中浸出剂为盐酸 , 盐酸中的氯元素可被氧化生成氯气 , 污染环境。 - 45 - 高考真题体验 典题演练提能 (4) 实验室煅烧 CoCO 3 需要在坩埚中进行 , 所需的硅酸盐质仪器除酒精灯和玻璃棒外 , 还有坩埚、泥三角。 (5)CoCl 2 水解生成的氯化氢容易挥发 , 因此 , 操作 ① 需要在 HCl 氛围中进行。从 CoCl 2 溶液中获得 CoCl 2 ·6H 2 O 晶体 , 需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥。洗涤时用工业酒精代替水可以减少晶体的溶解损失 , 且酒精更加容易挥发 , 便于晶体干燥。 (6) 用标准硝酸银溶液滴定未知浓度的 CoCl 2 溶液 , 根据几种物质在 20 ℃ 时的颜色及 K sp , 滴定过程中需要有明显的现象 , 应该用 K 2 CrO 4 为指示剂。 - 46 - 高考真题体验 典题演练提能 6 .(2019 北京昌平二模 ) 新能源汽车的核心部件是锂离子电池 , 常用磷酸亚铁锂 (LiFePO 4 ) 作电极材料。对 LiFePO 4 废旧电极 ( 含杂质 Al 、石墨粉 ) 回收并获得高纯 Li 2 CO 3 的工业流程图如下 : - 47 - 高考真题体验 典题演练提能 资料 : 碳酸锂在水中的溶解度 : (1) 过程 ⅰ 研磨粉碎的目的是 。 (2) 过程 ⅱ 加入足量 NaOH 溶液的作用是 。 (3) 过程 ⅲ 采用不同氧化剂分别进行实验 , 均采用 Li 含量为 3.7% 的原料 , 控制 pH 为 3.5, 浸取 1.5 h 后 , 实验结果如下表所示 : - 48 - 高考真题体验 典题演练提能 ① 实验 2 中 ,NaClO 3 与盐酸反应生成黄绿色气体 , 大大增加了酸和氧化剂的用量 , 该反应的离子方程式为 。 ② 结合实验结果和 ① 中的现象 , 最终选择 H 2 O 2 作为氧化剂 , 原因是 。 ③ 过程 ⅲ 得到的浸出液循环两次的目的是 。 磷酸铁晶体的原因 。 (5) 对比过程 ⅳ 和 ⅴ, 说明过程 ⅳ 不用饱和 Na 2 CO 3 溶液的原因 。 (6) 简述过程 ⅵ 的操作 。 - 49 - 高考真题体验 典题演练提能 答案 : (1) 增大反应物接触面积 , 增大反应速率 (2) 溶解 Al, 使其进入滤液 1 ② Li + 的浸出率较高 , 且较环保 ( 或节约酸和氧化剂的用量 ) ③ 提高浸出液中 Li + 浓度 ( 或提高氧化剂和酸的利用率 , 节约后续过程中纯碱的用量 ) (6) 用热水洗涤、干燥 - 50 - 高考真题体验 典题演练提能 解析 : (1) 过程 ⅰ 研磨粉碎的目的是增大固体反应物接触面积 , 增大反应速率。 (2) 单质铝可溶于氢氧化钠溶液生成偏铝酸钠 , 过程 ⅱ 加入足量 NaOH 溶液的作用是溶解 Al, 使其进入滤液 1 分离除去 。 ② 实验 2 生成氯气污染空气 , 增加了酸和氧化剂的用量 , 实验 1 与实验 3 相比较 ,Li + 的浸出率较高 , 故最终选择 H 2 O 2 作为氧化剂。 ③ 过程 ⅲ 得到的浸出液循环两次的目的是提高氧化剂和酸的利用率 , 提高浸出液中 Li + 浓度。 - 51 - 高考真题体验 典题演练提能 (6) 由碳酸锂溶解度与温度的关系可知 , 温度越高 , 碳酸锂溶解度越小 , 故过程 ⅵ 的操作是用热水洗涤 , 干燥。 - 52 - 高考真题体验 典题演练提能 7 .(2019 安徽淮北宿州二模 ) 钴酸锂 (LiCoO 2 ) 是锂离子电池的一种重要正极材料。可利用湿法冶金工艺处理精选后的锂离子电池正极材料 (LiCoO 2 、乙炔黑 ) 重新制备高纯度 LiCoO 2 , 其流程如下 ( 已知 :LiCoO 2 难溶于水 ;Li 2 CO 3 微溶于水、难溶于醇 ;CoCO 3 难溶于水和醇 ) 。 - 53 - 高考真题体验 典题演练提能 (l)H 2 O 2 的作用是 。 (2)“ 浸取 ” 时若加入盐酸 ,Cl - 被 LiCoO 2 氧化产生 Cl 2 。该反应的离子方程式是 。 (3) 向含 Co 2+ 、 Li + 的溶液中加入乙醇的作用是 , 滤渣 b 的主要成分是 ( 填化学式 ) 。 (4) 在空气中 “ 煅烧 ” 时 , 发生反应的总化学方程式为 。 - 54 - 高考真题体验 典题演练提能 解析 : (1)“ 浸取 ” 时加入 H 2 SO 4 、 H 2 O 2 , 滤液中产生了 Co 2+ , 钴元素化合价由 +3 价变成了 +2 价 ,H 2 O 2 的作用是用来还原 LiCoO 2 。 (2)“ 浸取 ” 时若加入盐酸 ,Cl - 会被 LiCoO 2 氧化产生 Cl 2 , 造成环境污染 , 该反应的离子方程式为 2Cl - +2LiCoO 2 +8H + === Cl 2 ↑+2Co 2+ +2Li + +4H 2 O; 由于 LiCoO 2 难溶于水 , 在离子方程式中不拆。 - 55 - 高考真题体验 典题演练提能 (3) 因 Li 2 CO 3 和 CoCO 3 都难溶于醇 , 向含 Co 2+ 、 Li + 溶液中加入乙醇的作用是降低 Li 2 CO 3 、 CoCO 3 的溶解度 , 使其尽可能析出。滤渣 b 的主要成分是 Li 2 CO 3 和 CoCO 3 。 - 56 - 高考真题体验 典题演练提能 8 .(2019 广东深圳二模 ) 重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液 ( 主要含 Cr 3+ 、 Fe 3+ 、 K + 、 等 ) 制备 K 2 Cr 2 O 7 的流程如下图所示。 - 57 - 高考真题体验 典题演练提能 回答下列问题 : (1) 滤渣 ② 的主要成分为 ( 填化学式 ) 。 (2) 写出 “ 氧化 ” 步骤中反应的化学方程式 。 (3)“ 加热 ” 操作的目的是 。 - 58 - 高考真题体验 典题演练提能 - 59 - 高考真题体验 典题演练提能 (6) 在 K 2 Cr 2 O 7 存在下 , 可利用微生物电化学技术实现含苯酚废水的有效处理 , 其工作原理如下图所示 。 ① 负极的电极反应式为 ; ② 一段时间后 , 中间室中 NaCl 溶液的浓度 ( 填 “ 增大 ”“ 减小 ” 或 “ 不变 ”) 。 - 60 - 高考真题体验 典题演练提能 答案 : (1)Fe(OH) 3 ( 2)2Cr(OH) 3 +3H 2 O 2 +4KOH === 2K 2 CrO 4 +8H 2 O (3) 分解除去剩余的 H 2 O 2 (4)2×10 -8 mol·L -1 (5)88.20% (6) ① C 6 H 5 OH+11H 2 O-28e - === 6CO 2 ↑+28H + ② 减小 解析 : 含铬废液 ( 主要含 Cr 3+ 、 Fe 3+ 、 K + 、 等 ) 加入 KOH 溶液调 pH=7~8, 生成 Cr(OH) 3 和 Fe(OH) 3 沉淀 , 过滤后得滤渣 ① 为 Cr(OH) 3 和 Fe(OH) 3 ; 向滤渣 ① 加入过量 H 2 O 2 溶液和 KOH 溶液 ,Cr(OH) 3 在碱性条件下被氧化为 K 2 CrO 4 进入溶液 , 经过滤 , 滤渣 ② 的主要成分为 Fe(OH) 3 ; 滤液 ② 经加热除去剩余的 H 2 O 2 , 冷却后酸化至 pH=1, 结晶析出 K 2 Cr 2 O 7 晶体。 - 61 - 高考真题体验 典题演练提能 - 62 - 高考真题体验 典题演练提能 ② 负极产生的 H + 通过阳离子交换膜进入中间室 , 正极产生的 OH - 通过阴离子交换膜也进入中间室 ,H + 和 OH - 反应生成水 , 溶液体积增大 ,NaCl 溶液的浓度将减小。 - 63 - 高考真题体验 典题演练提能 9 .(2019 河北衡水中学二模 ) 镍钴锰酸锂电池是一种高功率动力电池。采用废旧锂离子电池回收工艺制备镍钴锰酸锂三元正极材料 ( 铝电极表面涂有 LiNi (1- x-y ) Co x Mn y O 2 ) 的工艺流程如图所示 : - 64 - 高考真题体验 典题演练提能 回答下列问题 : (1) 废旧锂离子电池拆解前进行 “ 放电处理 ” 有利于锂在正极的回收 , 其原因是 。 (2) 能够提高 “ 碱浸 ” 效率的方法有 ( 至少写两种 ) 。 (3)“ 碱浸 ” 过程中 , 铝溶解的离子方程式为 。 (4) 实验室模拟 “ 碱浸 ” 后过滤的操作 , 需用到的玻璃仪器有 ; 过滤后需洗涤 , 简述洗涤的操作过程 : 。 (5)LiCoO 2 参与 “ 还原 ” 反应的离子方程式为 。 - 65 - 高考真题体验 典题演练提能 (6) 溶液温度和浸渍时间对钴的浸出率影响如图所示 : 则浸出过程的最佳条件是 。 (7) 已知溶液中 Co 2+ 的浓度为 1.0 mol·L -1 , 缓慢通入氨气 , 使其产生 Co(OH) 2 沉淀 , 则 Co 2+ 沉淀完全时溶液的最小 pH 为 ( 已知 : 离子沉淀完全时 c (Co 2+ ) ≤ 1.0×10 -5 mol·L -1 , K sp [Co(OH) 2 ]=4.0×10 -15 ,lg2=0.3, 溶液体积变化忽略不计 ) 。 (8) 写出 “ 高温烧结固相合成 ” 过程的化学方程式 : 。 - 66 - 高考真题体验 典题演练提能 - 67 - 高考真题体验 典题演练提能 解析 : (1) 放电时 , 负极上生成锂离子 , 锂离子向正极移动并进入正极材料中 , 所以 “ 放电处理 ” 有利于锂在正极的回收 ; (2) 提高浸出率的方法有粉碎原料、适当增大 NaOH 溶液的浓度、适当升高温度等 ; (4) 过滤需要用到的玻璃仪器有漏斗、烧杯、玻璃棒 ; 洗涤沉淀在过滤器中进行 , 其操作为 : 沿玻璃棒向过滤器中加水至浸没沉淀 , 待水滤出后重复操作 2~3 次 ; - 68 - 高考真题体验 典题演练提能 - 69 - 高考真题体验 典题演练提能 10 .(2019 河南顶级名校第四次联考 ) 一种利用化肥生产中的废催化剂 ( 含 CoO 、 Co 、 Al 2 O 3 及少量 FeO) 制取明矾和 CoSO 4 粗产品的工艺流程如下 : - 70 - 高考真题体验 典题演练提能 已知 :( ⅰ ) 相关金属离子形成氢氧化物沉淀的 pH 范围如下表所示 : ( ⅱ )Al(OH) 3 在碱性条件下开始溶解时的 pH 为 7.8, 完全溶解时的 pH 为 11 。 回答下列问题 : (1) 写出 H 2 O 2 的电子式 : 。 (2) 下列措施一定能提高步骤 Ⅰ 中 Al 3+ 和 Co 2+ 的浸取率的是 ( 填标号 ) 。 a. 将废催化剂研磨为细颗粒 b. 步骤 Ⅰ 中的硫酸采用 98% 的浓硫酸 c. 适当提高浸取时的温度 - 71 - 高考真题体验 典题演练提能 (3) 步骤 Ⅱ 中 , 写出 “ 氧化 ” 过程中 Fe 2+ 被氧化的离子方程式 : , 若 “ 氧化 ” 后再 “ 调节 pH=3”, 造成的后果是 。 (4) 步骤 Ⅲ 中加 K 2 CO 3 应控制的 pH 范围为 。 (5) 测定 CoSO 4 粗产品中钴的质量分数的步骤如下 : 准确称取 a g 产品 , 先经预处理 , 然后加入过量的冰乙酸 , 在加热煮沸条件下 , 缓慢滴加 KNO 2 溶液直至过量 , 生成不溶于乙酸的 K 3 [Co(NO 2 ) 6 ], 再经过滤、洗涤及干燥 , 称量沉淀的质量为 b g 。 ① KNO 2 溶液氧化并沉淀 Co 2+ 的离子方程式为 ( 已知 KNO 2 被还原为 NO) 。 ② 粗产品中钴元素的质量分数为 ( M r {K 3 [Co(NO 2 ) 6 ]}=452, 列出计算式 ) 。 - 72 - 高考真题体验 典题演练提能 - 73 - 高考真题体验 典题演练提能 解析 : 废催化剂 ( 含 CoO 、 Co 、 Al 2 O 3 及少量 FeO) 加入硫酸酸浸后得到的浸取液中主要含有 Co 2+ 、 Al 3+ 、 Fe 2+ 、 H + 和 等离子 , 调节溶液 pH=3, 再加入 H 2 O 2 ,Fe 2+ 被氧化为 Fe 3+ 并产生 Fe(OH) 3 沉淀。过滤后 , 滤液中加入 K 2 CO 3 调节 pH, 生成 Co(OH) 2 沉淀和 KAlO 2 溶液 , 经过滤分离 ,Co(OH) 2 沉淀加硫酸溶解经后续处理得到粗产品 CoSO 4 , 滤液加硫酸酸化得到硫酸铝钾溶液 , 经结晶得到明矾。 (1)H 2 O 2 为共价化合物 , 两个氧原子共用一对电子 , 电子式 ( 2) 将废催化剂研磨为细颗粒 , 可增大固体反应物的接触面积 , 能提高浸取率 , 故 a 正确 ; 该反应为 H + 参加的离子反应 ,98% 的浓硫酸中的氢离子浓度极小 , 不利于酸浸 , 故 b 错误 ; 升高温度可以增大化学反应速率 , 适当提高浸取时的温度 , 能提高浸取率 , 故 c 正确。 - 74 - 高考真题体验 典题演练提能 - 75 - 高考真题体验 典题演练提能 11 .(2019 四川成都七中模拟 )NiCO 3 常用于催化剂、电镀、陶瓷等工业。现用某含镍电镀废渣 ( 含 Cu 、 Zn 、 Fe 、 Cr 等杂质 ) 制取 NiCO 3 的过程如图所示 : (1) 流程中的试剂 X( 某钠盐 ) 的化学式是 。 (2)“ 氧化 ” 时需保持滤液在 40 ℃ 左右 , 用 6% 的 H 2 O 2 溶液氧化。控制温度不超过 40 ℃ 的原因是 ( 用化学方程式表示 ) 。 - 76 - 高考真题体验 典题演练提能 (3)Fe 2+ 也可以用 NaClO 3 氧化 , 生成的 Fe 3+ 在较小 pH 条件下水解 , 最终形成黄钠铁矾 [Na 2 Fe 6 (SO 4 ) 4 (OH) 12 ] 沉淀而被除去 , 如图是 pH- 温度关系图 , 图中阴影部分为黄钠铁矾稳定存在的区域 , 下列说法不正确的 是 ( 填字母 ) 。 a. 黄钠铁矾 [Na 2 Fe 6 (SO 4 ) 4 (OH) 12 ] 中铁为 +2 价 b.pH 过低或过高均不利于生成黄钠铁矾 , 其原因相同 c. 氯酸钠在氧化 Fe 2+ 时 ,1 mol NaClO 3 得到的电子数为 6 N A d. 工业生产中温度常保持在 85~95 ℃ , 加入 Na 2 SO 4 后生成黄钠铁矾 , 此时溶液的 pH 约为 1.2~1.8 。 - 77 - 高考真题体验 典题演练提能 (4) 加入 Na 2 CO 3 溶液时 , 确认 Ni 2+ 已经完全沉淀的实验方法是 。 (5) 某小组利用 NiCO 3 制取镍氢电池的正极材料碱式氧化镍 (NiOOH), 过程如图 : ① 已知 25 ℃ 时 , K sp [Ni(OH) 2 ]=2×10 -15 , 当调节 pH ≥ 9 时 , 溶液中残留的 c (Ni 2+ ) mol·L -1 。 ② 写出在空气中加热 Ni(OH) 2 制取 NiOOH 的化学方程式 。 ③ 镍氢电池电解液为 30% 的 KOH 溶液 , 负极为 MH( 即吸氢材料 M 吸附氢原子 ) 。充电时也可实现 Ni(OH) 2 转化为 NiOOH 。请写出放电时该电池的总反应式 。 - 78 - 高考真题体验 典题演练提能 解析 : 根据流程图 , 该含镍电镀废渣 ( 含 Cu 、 Zn 、 Fe 、 Cr 等杂质 ) 用过量的酸溶解 , 其中的金属转化为金属阳离子 , 再加入适量 X 试剂 , 将铜离子和锌离子转化为硫化物沉淀除去 , 滤液中含有镍、铁、铬等金属离子。根据 (2) 可知 , 保持滤液在 40 ℃ 左右 , 用 6% 的 H 2 O 2 溶液氧化 Fe 2+ , 再在 95 ℃ 加入 NaOH 调节 pH, 除去 Fe(OH) 3 和 Cr(OH) 3 , 在过滤后的滤液中加入碳酸钠得到 NiCO 3 。 - 79 - 高考真题体验 典题演练提能 (1) 根据流程图 , 加入试剂 X 后生成了硫化铜和硫化锌沉淀 , 因此试剂 X( 某钠盐 ) 为 Na 2 S; (2) 由于过氧化氢受热容易分解 , 因此 “ 氧化 ” 时需保持滤液温度不超过 40 ℃ ; (3) 黄钠铁矾 [Na 2 Fe 6 (SO 4 ) 4 (OH) 12 ] 中钠为 +1 价 , 硫酸根为 -2 价 , 氢氧根为 -1 价 , 根据各元素正负化合价代数和为 0 可知铁为 +3 价 , 故 a 错误。 pH 过低 ,[Na 2 Fe 6 (SO 4 ) 4 (OH) 12 ] 能够被酸溶解 ;pH 过高 , 铁离子容易水解生成氢氧化铁或 FeOOH 沉淀 , 均不利于生成黄钠铁矾 , 原因不相同 , 故 b 错误。用氯酸钠在酸性条件下氧化 Fe 2+ 的离子方程式 为 , 1 mol NaClO 3 得到的电子数为 6 N A , 故 c 正确 ; 由图像可知 ,85~95 ℃ 条件下生成黄钠铁矾的合适 pH 约为 1.2~1.8, 故 d 正确 。 - 80 - 高考真题体验 典题演练提能 (4) 确认 Ni 2+ 已经完全沉淀的具体操作步骤为 : 静置 , 在上层清液中继续滴加 1~2 滴 Na 2 CO 3 溶液 , 无沉淀生成。 ③ 镍氢电池电解液为 30% 的 KOH 溶液 , 负极为 MH( 即吸氢材料 M 吸附氢原子 ) 。充电时也可实现 Ni(OH) 2 转化为 NiOOH, 则放电时 NiOOH 在正极发生还原反应生成 Ni(OH) 2 , 电池的总反应为 MH 与 NiOOH 反应生成 Ni(OH) 2 和 M, 反应方程式为 NiOOH+MH === M+Ni(OH) 2 。 - 81 - 高考真题体验 典题演练提能 物质制备工艺流程 1 .(2019 全国 Ⅰ ,26) 硼酸 (H 3 BO 3 ) 是一种重要的化工原料 , 广泛应用于玻璃、医药、肥料等工业。一种以硼镁矿 ( 含 Mg 2 B 2 O 5 ·H 2 O 、 SiO 2 及少量 Fe 2 O 3 、 Al 2 O 3 ) 为原料生产硼酸及轻质氧化镁的工艺流程如下 : - 82 - 高考真题体验 典题演练提能 回答下列问题 : (1) 在 95 ℃ “ 溶浸 ” 硼镁矿粉 , 产生的气体在 “ 吸收 ” 中反应的化学方程式为 。 (2)“ 滤渣 1” 的主要成分有 。为检验 “ 过滤 1” 后的滤液中是否含有 Fe 3+ 离子 , 可选用的化学试剂是 。 (3) 根据 H 3 BO 3 的解离反应 : , K a =5.81×10 -10 , 可判断 H 3 BO 3 是 酸 ; 在 “ 过滤 2” 前 , 将溶液 pH 调节至 3.5, 目的是 。 (4) 在 “ 沉镁 ” 中生成 Mg(OH) 2 ·MgCO 3 沉淀的离子方程式为 , 母液经加热后可返回 工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是 。 - 83 - 高考真题体验 典题演练提能 (2) 由流程图可知 ,B 元素最终以 H 3 BO 3 的形式存在 ,Mg 元素经沉镁后以 Mg(OH) 2 ·MgCO 3 的形式存在 , 可分析出 Fe 、 Al 在沉镁后不会存在于母液中 , 因此滤渣 1 的主要成分为矿石中含有的 SiO 2 、 Fe 2 O 3 、 Al 2 O 3 。可用 KSCN 溶液检验 Fe 3+ 的存在。 - 84 - 高考真题体验 典题演练提能 - 85 - 高考真题体验 典题演练提能 2 .(2019 全国 Ⅱ ,26) 立德粉 ZnS·BaSO 4 ( 也称锌钡白 ), 是一种常用的白色颜料。回答下列问题 : (1) 利用焰色反应的原理既可制作五彩缤纷的节日烟花 , 亦可定性鉴别某些金属盐。灼烧立德粉样品时 , 钡的焰色为 ( 填标号 ) 。 A. 黄色 B. 红色 C. 紫色 D. 绿色 (2) 以重晶石 (BaSO 4 ) 为原料 , 可按如下工艺生产立德粉 : - 86 - 高考真题体验 典题演练提能 ① 在回转炉中重晶石被过量焦炭还原为可溶性硫化钡 , 该过程的化学方程式为 。 回转炉尾气中含有有毒气体 , 生产上可通过水蒸气变换反应将其转化为 CO 2 和一种清洁能源气体 , 该反应的化学方程式为 。 ② 在潮湿空气中长期放置的 “ 还原料 ”, 会逸出臭鸡蛋气味的气体 , 且水溶性变差 , 其原因是 “ 还原料 ” 表面生成了难溶于水的 ( 填化学式 ) 。 ③ 沉淀器中反应的离子方程式为 。 - 87 - 高考真题体验 典题演练提能 (3) 成品中 S 2- 的含量可以用 “ 碘量法 ” 测得。称取 m g 样品 , 置于碘量瓶中 , 移取 25.00 mL 0.100 0 mol·L -1 的 I 2 -KI 溶液于其中 , 并加入乙酸溶液 , 密闭 , 置暗处反应 5 min, 有单质硫析出。以淀粉为指示剂 , 过 - 88 - 高考真题体验 典题演练提能 解析 : (1) 常见的金属元素在焰色反应中呈现的焰色分别为 : 钠 — 黄色、钾 — 紫色 ( 透过蓝色钴玻璃观察 ) 、钙 — 砖红色、锶 — 洋红色、铜 — 绿色、钡 — 黄绿色。 (2) ① 由于焦炭过量 , 故 C 被氧化为 CO, 反应的化学方程式 为 ② 根据信息结合框图可知 , 还原料的主要成分为 BaS, 表面 BaS 与空 气中的 H 2 O 和 CO 2 反应生成有臭鸡蛋气味的 H 2 S 和难溶于水的 BaCO 3 。 - 89 - 高考真题体验 典题演练提能 - 90 - 高考真题体验 典题演练提能 3 .(2019 全国 Ⅲ ,26) 高纯硫酸锰作为合成镍钴锰三元正极材料的原料 , 工业上可由天然二氧化锰粉与硫化锰矿 ( 还含 Fe 、 Al 、 Mg 、 Zn 、 Ni 、 Si 等元素 ) 制备 , 工艺如下图所示。回答下列问题 : - 91 - 高考真题体验 典题演练提能 相关金属离子 [ c 0 (M n + )=0.1 mol·L -1 ] 形成氢氧化物沉淀的 pH 范围如下 : (1)“ 滤渣 1” 含有 S 和 ; 写出 “ 溶浸 ” 中二氧化锰与硫化锰反应的化学方程式 。 (2)“ 氧化 ” 中添加适量的 MnO 2 的作用是 。 (3)“ 调 pH” 除铁和铝 , 溶液的 pH 范围应调节为 ~6.0 之间。 (4)“ 除杂 1” 的目的是除去 Zn 2+ 和 Ni 2+ ,“ 滤渣 3” 的主要成分是 。 - 92 - 高考真题体验 典题演练提能 (5)“ 除杂 2” 的目的是生成 MgF 2 沉淀除去 Mg 2+ 。若溶液酸度过高 ,Mg 2+ 沉淀不完全 , 原因是 。 (6) 写出 “ 沉锰 ” 的离子方程式 。 (7) 层状镍钴锰三元材料可作为锂离子电池正极材料 , 其化学式为 LiNi x Co y Mn z O 2 , 其中 Ni 、 Co 、 Mn 的化合价分别为 +2 、 +3 、 +4 。当 x = y = 时 , z = 。 - 93 - 高考真题体验 典题演练提能 - 94 - 高考真题体验 典题演练提能 解析 : 本题为工艺流程题 , 综合考查了陌生化学方程式和离子方程式的书写、调节 pH 除杂、沉淀溶解平衡及化合价的简单计算等知识 , 综合性较强 , 难度中等。 (1) 加硫酸 “ 溶浸 ” 过程中 ,MnO 2 将 MnS 中的 S 2- 氧化为单质硫 : MnO 2 +MnS+2H 2 SO 4 === 2MnSO 4 +S+2H 2 O 。天然锰矿中含有的二氧化硅 ( 或硅酸盐 ) 不溶于稀硫酸 , 所以滤渣 1 为 S 和二氧化硅 ( 或不溶性硅酸盐 ) 。 - 95 - 高考真题体验 典题演练提能 - 96 - 高考真题体验 典题演练提能 4 .(2018 全国 Ⅰ ,27 节选 ) 焦亚硫酸钠 (Na 2 S 2 O 5 ) 在医药、橡胶、印染、食品等方面应用广泛。回答下列问题 : (1) 生产 Na 2 S 2 O 5 , 通常是由 NaHSO 3 过饱和溶液经结晶脱水制得。写出该过程的化学方程式 。 (2) 利用烟道气中的 SO 2 生产 Na 2 S 2 O 5 的工艺为 : ① pH=4.1 时 , Ⅰ 中为 溶液 ( 写化学式 ) 。 ② 工艺中加入 Na 2 CO 3 固体 , 并再次充入 SO 2 的目的是 。 - 97 - 高考真题体验 典题演练提能 (3)Na 2 S 2 O 5 可用作食品的抗氧化剂。在测定某葡萄酒中 Na 2 S 2 O 5 残留量时 , 取 50.00 mL 葡萄酒样品 , 用 0.010 00 mol·L -1 的碘标准液滴定至终点 , 消耗 10.00 mL 。滴定反应的离子方程式为 , 该样品中 Na 2 S 2 O 5 的残留量为 g·L -1 ( 以 SO 2 计 ) 。 - 98 - 高考真题体验 典题演练提能 - 99 - 高考真题体验 典题演练提能 5 .(2018 全国 Ⅱ ,26) 我国是世界上最早制得和使用金属锌的国家 , 一种以闪锌矿 (ZnS, 含有 SiO 2 和少量 FeS 、 CdS 、 PbS 杂质 ) 为原料制备金属锌的流程如图所示 : 相关金属离子 [ c 0 (M n + )=0.1 mol·L -1 ] 形成氢氧化物沉淀的 pH 范围如下 : - 100 - 高考真题体验 典题演练提能 回答下列问题 : (1) 焙烧过程中主要反应的化学方程式为 。 (2) 滤渣 1 的主要成分除 SiO 2 外还有 ; 氧化除杂工序中 ZnO 的作用是 。若不通入氧气 , 其后果是 。 (3) 溶液中的 Cd 2+ 可用锌粉除去 , 还原除杂工序中反应的离子方程式为 。 (4) 电解硫酸锌溶液制备单质锌时 , 阴极的电极反应式为 ; 沉积锌后的电解液可返回 工序继续使用。 - 101 - 高考真题体验 典题演练提能 - 102 - 高考真题体验 典题演练提能 6 .(2018 全国 Ⅲ ,27)KIO 3 是一种重要的无机化合物 , 可作为食盐中的补碘剂。回答下列问题 : (1)KIO 3 的化学名称是 。 (2) 利用 “KClO 3 氧化法 ” 制备 KIO 3 工艺流程如下图所示 : “ 酸化反应 ” 所得产物有 KH(IO 3 ) 2 、 Cl 2 和 KCl 。 “ 逐 Cl 2 ” 采用的方法是 。 “ 滤液 ” 中的溶质主要是 。 “ 调 pH” 中发生反应的化学方程式为 。 - 103 - 高考真题体验 典题演练提能 (3)KIO 3 也可采用 “ 电解法 ” 制备 , 装置如图所示 。 ① 写出电解时阴极的电极反应式 。 ② 电解过程中通过阳离子交换膜的离子主要为 , 其迁移方向是 。 ③ 与 “ 电解法 ” 相比 ,“KClO 3 氧化法 ” 的主要不足之处有 ( 写出一点 ) 。 - 104 - 高考真题体验 典题演练提能 - 105 - 高考真题体验 典题演练提能 7 .(2017 全国 Ⅰ ,27)Li 4 Ti 5 O 12 和 LiFePO 4 都是锂离子电池的电极材料 , 可利用钛铁矿 ( 主要成分为 FeTiO 3 , 还含有少量 MgO 、 SiO 2 等杂质 ) 来制备。工艺流程如下 : - 106 - 高考真题体验 典题演练提能 回答下列问题 : (1)“ 酸浸 ” 实验中 , 铁的浸出率结果如下图所示。由图可知 , 当铁的浸出率为 70% 时 , 所采用的实验条件为 。 (2)“ 酸浸 ” 后 , 钛主要 以 形式 存在 , 写出相应反应的离子方程式 。 - 107 - 高考真题体验 典题演练提能 (3)TiO 2 · x H 2 O 沉淀与双氧水、氨水反应 40 min 所得实验结果如下表所示 : 分析 40 ℃ 时 TiO 2 · x H 2 O 转化率最高的原因 。 (4)Li 2 Ti 5 O 15 中 Ti 的化合价为 +4, 其中过氧键的数目为 。 (5) 若 “ 滤液 ② ” 中 c (Mg 2+ )=0.02 mol·L -1 , 加入双氧水和磷酸 ( 设溶液体积增加 1 倍 ), 使 Fe 3+ 恰好沉淀完全即溶液中 c (Fe 3+ )=1.0×10 -5 mol·L -1 , 此时是否有 Mg 3 (PO 4 ) 2 沉淀生成 ? ( 列式计算 ) 。 FePO 4 、 Mg 3 (PO 4 ) 2 的 K sp 分别为 1.3×10 -22 、 1.0×10 -24 。 (6) 写出 “ 高温煅烧 ② ” 中由 FePO 4 制备 LiFePO 4 的化学方程式 : 。 - 108 - 高考真题体验 典题演练提能 - 109 - 高考真题体验 典题演练提能 解析 : (1) 由图像可知 , 当铁的浸出率为 70% 时 , 对应的条件有 2 个 , 一个为 100 ℃ 、 2 h, 另一个为 90 ℃ 、 5 h 。 (2) 此题考查陌生离子方程式的书写 , 第一步应搞清所写的离子方程式是否为氧化还原反应的离子方程式。在钛铁矿 (FeTiO 3 ) 中 Fe 为 +2 价 ,Ti 为 +4 价。 在 中 Ti 仍为 +4 价 , 故为非氧化还原反应 , 第二步依据元素守恒和电荷守恒把离子方程式配平。 (3) 考查反应温度与反应物浓度对反应速率的影响。温度低于 40 ℃ 时 ,TiO 2 · x H 2 O 转化反应速率随温度升高而增加 ; 超过 40 ℃ 时 ,H 2 O 2 易分解 ,NH 3 也易从反应体系中逸出 , 反应物浓度减小 ,TiO 2 · x H 2 O 转化反应速率下降。 (4) 设在化合物 Li 2 Ti 5 O 15 中有 x 个 O 为 -2 价 , y 个 O 为 -1 价 , 由化合物中各元素化合价的代数和为零可得 : 解得 x =7, y =8, 即有 8 个氧原子显 -1 价 , 则过氧键的数目为 4 。 - 110 - 高考真题体验 典题演练提能 因溶液的体积扩大了一倍 , c (Mg 2+ )=0.01 mol·L -1 , Q [Mg 3 (PO 4 ) 2 ]= c 3 (Mg 2+ )· c 2 ( )= 0.01 3 ×(1.3×10 -17 ) 2 =1.7×10 -40 <1.0×10 -24 , 即 Q查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档