- 2021-04-12 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
辽宁省大连海湾高级中学2019-2020学年高二上学期第一次质量检测化学试卷
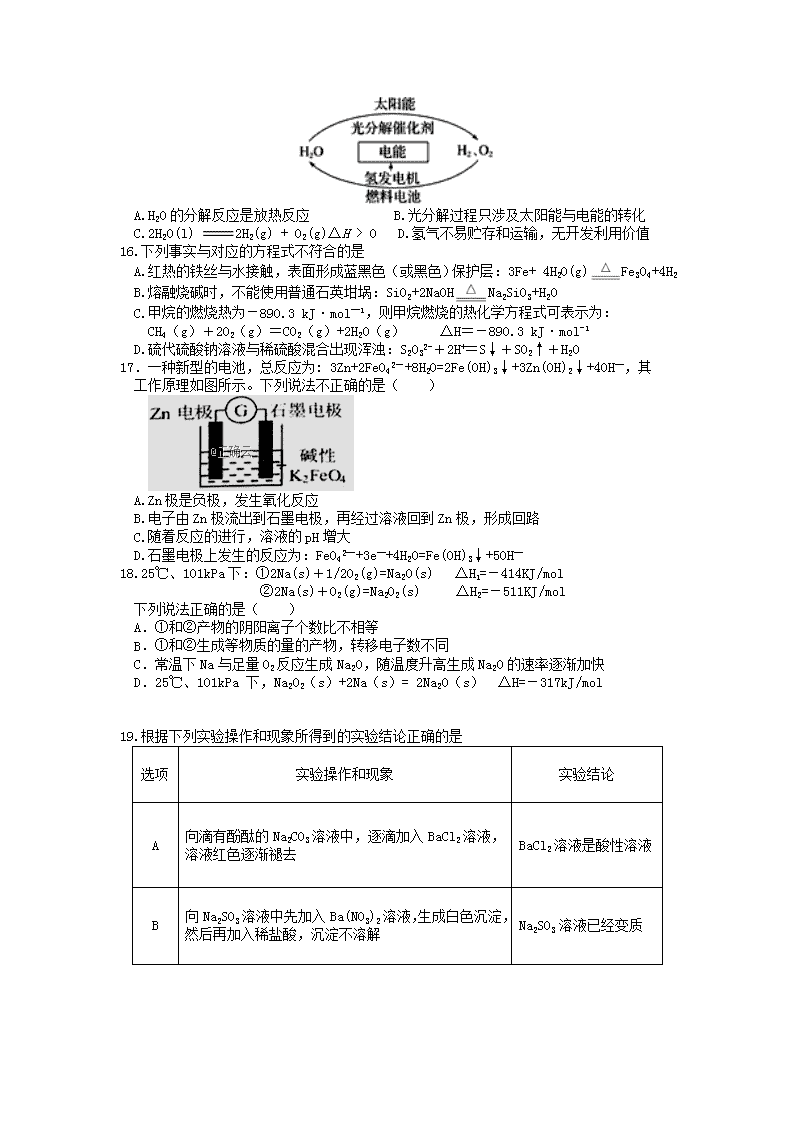
高二化学试题 总分:100 分 时间:90 分钟 可能用到的相对原子质量:Cu 64 Fe 56 Na 23 Cl 35.5 O 16 N 14 C 12 H 1 Ca 40 S 32 第Ⅰ卷(共 48 分) 一、选择题(本题共 12 小题,每小题 2 分,共 24 分。每小题只有一个选项符合题意) 1.化学与人类生产、生活、社会可持续发展等密切相关。下列说法正确的是 A.《格物粗谈》记载“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”文 中的“气”是指氧气 B.中国天眼 FAST 用到的碳化硅是一种新型的有机高分子材料 C.利用肥皂水处理蚊虫叮咬,主要是利用肥皂水的弱碱性 D.食品包装盒中的生石灰或铁粉,都可以起到抗氧化作用 2.下列关于能量变化的说法正确的是 A.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高 B.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种 C.已知 C(石墨,s)=C(金刚石,s)ΔH>0,则金刚石比石墨稳定 D.化学反应遵循质量守恒的同时,也遵循能量守恒 3.下列叙述正确的是( ) ①CO2 的大量排放会加剧温室效应 ②正常雨水的 pH 为 5.6,主要是因为溶解了 SO2 ③利用太阳能、风能和氢能替代化石能源可以改善空气的质量 ④酸与碱的反应都是非氧化还原反应 ⑤为防止电池中的重金属离子污染土壤和水源,废电池要集中处理 A.①②③④⑤ B.②③⑤ C.①③⑤ D.①②④⑤ 4.设 NA 为阿伏加德罗常数的值,下列说法正确的是( ) A.25℃时,1 L pH=12 的 Ba(OH)2 溶液中含有的 OH−数目为 0.02NA B.常温常压下,46gNO2 与 N2O4 的混合气体含有的氮原子数目无法计算 C.常温常压下,7.8g Na2S 和 Na2O2 的混合物中,阴离子所含电子数为 1.8NA D.0.1 mo1·L﹣1 MgC12 溶液中含有的 Mg2+数目小于 0.1 NA 5.下列实验操作不能达到实验目的的是 A.用加热的方法除去碳酸钠固体中的碳酸氢钠 B.加热蒸干溶液,可以得到 CuCl2 晶体 C.放在流动的蒸馏水中可除去半透膜中蛋白质溶液里混有的(NH4)2SO4 D.鉴别 NaBr 和 KI 溶液,可分别加新制氯水后,用 CCl4 萃取 6.可逆反应 aA(g)+bB(g) cC(g)+dD(g);ΔH 同时符合下列两图中各曲 线的规律的是( ) A.a+b>c+d T1<T2 ΔH<0 B.a+b>c+d T1<T2 ΔH>0 C.a+b<c+d T1>T2 ΔH<0 D.a+b>c+d T1>T2 ΔH>0 7.下列各组离子可能大量共存的是 A.可使石蕊试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO2- B.能与金属铝反应放出氢气的溶液中:Fe2+、NO3-、Cl-、NH4+ C.常温下水电离出的 c(H+)·c(OH-)=10-20 的溶液中:Na+、Cl-、S2-、SO32- D.含有 CO32 -的溶液中:K+、A13+、NO3-、Ca2+ 8.2019 年 2 月,在世界移动通信大会(MWC)上发布了中国制造首款 5G 折叠屏手机的消息。 下列说法不正确的是 A.制造手机芯片的关键材料是硅 B.用铜制作手机线路板利用了铜优良的导电性 C.镁铝合金制成的手机外壳具有轻便抗压的特点 D.手机电池工作时,电池中化学能完全转化为电能 9.判断下列说法正确的是 A.强电解质溶液的导电能力一定比弱电解质溶液强 B.中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠等于醋酸 C.将 NaOH 和氨水溶液各稀释一倍,两者的 OH-浓度均减少到原来的 1/2 D.物质的量相同的磷酸钠溶液和磷酸溶液中所含的 P043- 量相同 10.实验室模拟工业上侯德榜制碱原理制备纯碱,下列操作未涉及的是 A. B. C. D. 11.短周期主族元素 W、X、Y、Z 的原子序数依次递增。X 和 Z 形成的化合物的水溶液呈 中性,W 和 X 的最外层电子数之和等于 Z 的最外层电子数,Y 的原子序数是 W 的 2 倍, 下列说法正确的是 A.原子半径:W<X<Y<Z B.Y 的气态氢化物的稳定性强于 Z 的气态氢化物 C.W 与 X 形成的化合物可能含有共价键 D.常温常压下,Y 的单质是气态 12.莫尔盐[(NH4)2Fe(SO4)2•6H2O]溶液经常用于定量滴定实验,下列说法正确的是 A.实验室配制 0.1mol·L-1 莫尔盐溶液 490mL,需莫尔盐 19.2 克 B.可与含 Fe2+、H+、I﹣微粒的溶液大量共存 C.加入过量 Ba(OH)2 溶液发生反应:2Ba2++2SO42-+Fe2++2OH-=2BaSO4↓+Fe(OH)3↓ D.取样,加入铁氰化钾,若出现黄色沉淀,证明含 Fe2+ 二、选择题(本题共 8 小题,每小题 3 分,共 24 分。每小题只有一个选项符合题意) 13.一定温度下在一容积不变的密闭容器中发生可逆反应 2X(g) Y(g)+Z(s) 以下不能说明该反应达到化学平衡状态的是 A.混合气体的密度不再变化 B.反应容器中 Y 的质量分数不变 C.体系压强不再变化 D.2v 逆(X)=v 正(Y) 14.下列说法中正确的是( ) ①将硫酸钡放入水中不能导电,但硫酸钡是电解质 ②氨溶于水得到的溶液氨水能导电,所以氨水是电解质 ③固态共价化合物不导电,熔融态的共价化合物可以导电 ④固态的离子化合物不导电,熔融态的离子化合物能导电 ⑤强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强 A. ①④ B. ①④⑤ C. ①②③④ D. ①②③④⑤ 15.为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳 能制取氢能的构想。下列说法正确的是 A.H2O 的分解反应是放热反应 B.光分解过程只涉及太阳能与电能的转化 C.2H2O(l) 2H2(g) + O2(g)ΔH > 0 D.氢气不易贮存和运输,无开发利用价值 16.下列事实与对应的方程式不符合的是 A.红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+ 4H2O(g) Fe3O4+4H2 B.熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH Na2SiO3+H2O C.甲烷的燃烧热为-890.3 kJ·mol—1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 D.硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32-+2H+=S↓+SO2↑+H2O 17.一种新型的电池,总反应为: 3Zn+2FeO42-+8H2O=2Fe(OH)3↓+3Zn(OH)2↓+4OH—,其 工作原理如图所示。下列说法不正确的是( ) A.Zn 极是负极,发生氧化反应 B.电子由 Zn 极流出到石墨电极,再经过溶液回到 Zn 极,形成回路 C.随着反应的进行,溶液的 pH 增大 D.石墨电极上发生的反应为:FeO42—+3e—+4H2O=Fe(OH)3↓+5OH— 18.25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414KJ/mol ②2Na(s)+O2(g)=Na2O2(s) △H2=-511KJ/mol 下列说法正确的是( ) A.①和②产物的阴阳离子个数比不相等 B.①和②生成等物质的量的产物,转移电子数不同 C.常温下 Na 与足量 O2 反应生成 Na2O,随温度升高生成 Na2O 的速率逐渐加快 D.25℃、101kPa 下,Na2O2(s)+2Na(s)= 2Na2O(s) △H=-317kJ/mol 19.根据下列实验操作和现象所得到的实验结论正确的是 选项 实验操作和现象 实验结论 A 向滴有酚酞的 Na2CO3 溶液中,逐滴加入 BaCl2 溶液, 溶液红色逐渐褪去 BaCl2 溶液是酸性溶液 B 向 Na2SO3 溶液中先加入 Ba(NO3)2 溶液,生成白色沉淀, 然后再加入稀盐酸,沉淀不溶解 Na2SO3 溶液已经变质 C 向 KI 溶液中滴加少量溴水,再滴加 CCl4,振荡,静 置。分层,上层无色,下层紫红色 溴的非金属性强于碘 D 向 AgNO3 溶液中先滴加少量 NaCl 溶液,生成白色沉淀, 然后再滴加 Na2S 溶液,生成黑色沉淀 溶解度:AgCl>Ag2S 20.一定温度下,下列溶液的离子浓度关系式正确的是( ) A.pH=5 的 H2S 溶液中,c(H+)=c(HS-)=1×10-5mol•L-1 B.pH=a 的氨水溶液,稀释 10 倍后,其 pH=b,则 a=b+1 C.pH=2 的 H2C2O4 溶液与 pH=12 的 NaOH 溶液任意比例混合: c(Na+)+c(H+)=c(OH-)+c(HC2O4-) D.pH 相同的①CH3COONa②NaHCO3③NaClO 三种溶液的 c(Na+):①>②>③ 第Ⅱ卷(非选择题,共 52 分) 21.(16 分)在容积为 1.00L 的容器中,通入一定量的 N2O4,发生反应 N2O4(g) 2NO2(g), 随温度升高,混合气体的颜色变深。回答下列问题: (1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如 右图所示。在 0~60s 时段,反应速率 v(N2O4)为 mol·L-1·s-1 反应的平衡常 数 K1 为 。 (2)100℃时达到平衡后,改变反应温度为 T,c(N2O4)以 0.0020 mol·L-1·s-1 的平均速率降低,经 10s 又达到平衡。 a:T 100℃(填“大于”“小于”),判断理由是 。 b:列式计算温度 T 是反应的平衡常数 K2 (3)温度 T 时反应达平衡后,将反应容器的容积减少一半, 平衡向 (填“正反应”或“逆反应”)方向移动, 判断理由是 。 22.(l2 分)常用补钙片的有效成分是 CaCO3,某化学探究小组欲测定某补钙片中碳酸钙的 含量。查阅资料得知:一种常用的分析试剂EDTA 二钠盐(用 Na2H2Y•2H2O 表示)可用于 测定 Ca2+,其反应为:Ca2++H2Y2-===CaY2-+2H+,以铬黑 T 为指示剂,滴定终点溶液 由红色变为蓝色。于是该实验小组做了如下实验: 步骤一:配制待测溶液。取适量补钙片研碎后,准确称取 0.400 g 配成 250 mL 溶液。 步骤二:滴定。用移液管取待测液 25.00 mL 于锥形瓶中,加入适量 NaOH 溶液,摇 匀,再加入铬黑 T 指示剂 3 滴,用 0.0100 mol•L−1 EDTA 二钠盐溶液滴定至终点。 三次重复滴定平均消耗 EDTA 二钠盐溶液 22.50 mL。 请回答下列问题: (1)步骤一中补钙剂要用 2 mol/L 的盐酸溶解,反应的离子方程式为 , 配制待测溶液所必需的仪器除研钵、药匙、分析天平、称量瓶、烧杯、玻璃棒外, 还有_______、________,操作的先后顺序为:e→____→____→d→f→____→____ →____(填下列操作的序号)。 A.盐酸溶解 b.称量 c.定容摇匀 d.加蒸馏水稀释 e.研磨 f.用 NaOH 溶液调节溶液 pH 至 7 g.转移溶液 h.洗涤并转移 (2)实验测得补钙片中 CaCO3 的含量为_______。 (3)下列操作会导致测定结果偏高的是_______(填下列选项的字母序号)。 A.未将洗涤烧杯内壁的溶液转入容量瓶 B.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 C.定容时俯视刻度线 D.滴定管下端尖嘴中有气泡存在,滴定后气泡消失 E.滴定管用蒸馏水洗净后未用标准液润洗 23.(10 分)(1)在 25 ℃条件下将 pH=12 的氨水稀释过程中,下列关系式正确的是_____。 A.能使溶液中 c(NH4+)·c(OH-)增大 B.溶液中 c(H+)·c(OH-)不变 C.能使溶液中 比值增大 D.此过程中 Kw 增大 (2)在 25 ℃条件下将 pH=12 的氨水稀释 100 倍后溶液的 pH 为________(填序号)。 A.10 B.11 C.10~12 D.11~13 (3)25 ℃时,向 0.1 mol·L-1 的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液 pH 减小,主要原因是________(填序号)。 ①氨水与氯化铵发生化学反应 ②氯化铵溶液水解显酸性,增加了 c(H+) ③氯化铵溶于水,电离出大量铵离子,抑制了一水合氨的电离,使 c(OH-)减小 (4)室温下,如果将 0.2molNH4Cl 和 0.1molNaOH 全部溶于水,形成混合溶液(假设无损失)。 ①________和________两种粒子的物质的量之和等于 0.2 mol。 ②________和________两种粒子的物质的量之和比 OH-多 0.1 mol。 24.(14 分)某实验小组对 KSCN 的性质进行探究,设计如下实验: 试管中试剂 实 验 滴加试剂 现象 Ⅰ ⅰ.先加 1mL 0.1 mol/L FeSO4 溶液 ⅱ.再加硫酸酸化的 KMnO4 溶液 ⅰ.无明显现象 ⅱ.先变红,后褪色 Ⅱ ⅲ.先加 1mL 0.05 mol/L Fe2(SO4)3 溶 液 ⅳ.再滴加 0.5 mL 0.5 mol/L FeSO4 溶 液 ⅲ.溶液变红 ⅳ.红色明显变浅 (1)SCN-存在两种结构式,分别为 N≡C—S-和 S=C=N-,SCN-是二者的互变异构的混合物, 请写出 N≡C—S-的电子式__________________________。 (2)用离子方程式表示 FeSO4 溶液显酸性的原因______________________。 (3)①用离子方程式表示实验Ⅰ溶液变红的原因___________。 ②针对实验Ⅰ中红色褪去的原因,小组同学认为是 SCN-被酸性 KMnO4 氧化为 SO42-,并 设计如右图实验装置证实了猜想是成立的。其中 X 溶液是_______,Y 溶液是_______,检验产物 SO42-的操作及现象是_____________________。 2mL 0.1mol/L KSCN 溶液 高二化学试题答案 一、选择题(本题共 12 小题,每小题 2 分,共 24 分。每小题只有一个选项符合题意) 1、C 2、D 3、C 4、C 5、B 6、A 7、C 8、D 9、B 10、B 11、C 12、B 二、选择题(本题共 8 小题,每小题 3 分,共 24 分。每小题只有一个选项符合题意) 13、D 14、B 15、C 16、C 17、B 18、D 19、C 20、D 21.(16 分)(每空 2 分) (1) 大于 0.0010 0.36 mol·L-1 (单位可不写) (2)a:大于 反应正方向吸热,反应向吸热方向进行,故温度升高 b:K2= (0.16 mol·L-1)2/(0.020 mol·L-1) =1.3 mol·L-1(单位可不写) (3) 逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动 22.(12 分) (1)CaCO3+2H+==Ca2++CO2↑+H2O (2 分) 250 mL 容量瓶、(2 分)胶头滴管 (2 分) b a g h c(2 分) (2)56.3% (2 分) (3)CDE(2 分) 23.(10 分) (1). B (2 分 (2). C (2 分) (3). ③ (2 分) (4). ①NH4+ NH3·H2O (2 分) ②NH4+ H+(2 分) 24.(14 分) ( 1 ) ………………………………………………………………………………………………………………………………………… …(2 分) ( 2 ) Fe2++2H2O Fe(OH)2 + 2H+………………………………………………………………………………………………………(2 分) (3)① MnO4 —+ 5Fe2+ + 8H+ = Mn2++ 5Fe3+ + 4H2O,(2 分)Fe3+ +3SCN— Fe(SCN)3(2 分) ②0.1 mol/L KSCN 溶液,硫酸酸化的 KMnO4 溶液;……………………………………………………(各 2 分) 一段时间后取少量反应后的 KSCN 溶液,先加盐酸酸化,再加氯化钡溶液,出现白色沉 淀………………………………………………………………………………………………………………………………………………………… …………………(2 分)查看更多