- 2021-04-12 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广东省广州市天河区2020届高三三模化学试题
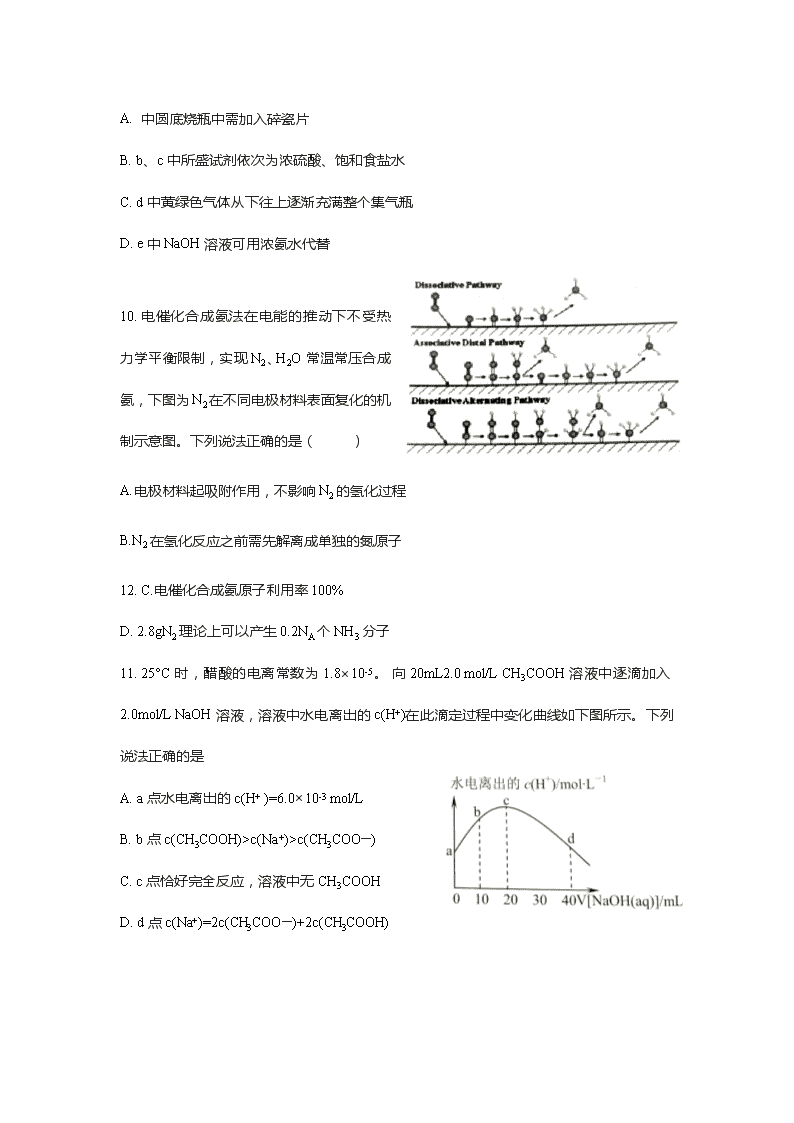
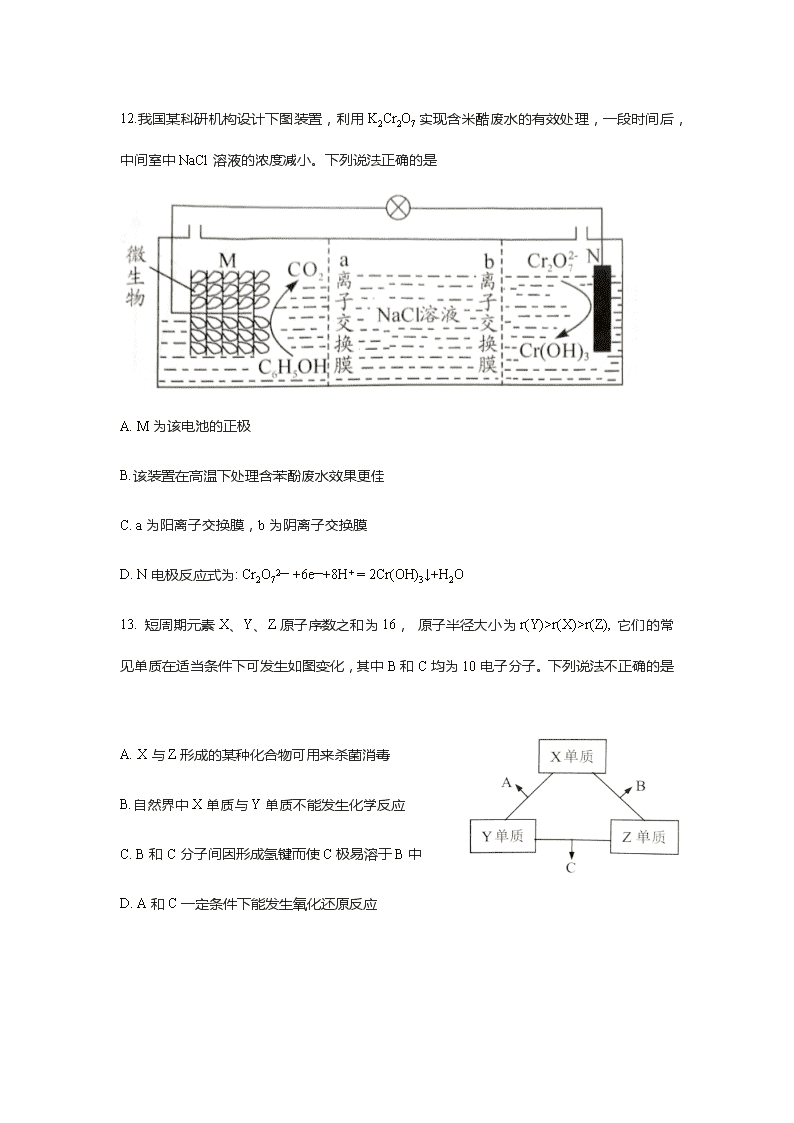
2020年广州市天河区高三(三模) 化学卷 可能用到的相对原子质量:H-1 N-14 O-16 Na-23 Mg-24 Cl-35.5 V-51 7.化学与生产、生活密切相关。下列有关说法正确的是 A.燃煤中加入生石灰可以有效减少碳排放 B.月饼包装盒内小袋铁粉主要作用为脱氧剂 C.热的纯碱溶液可用于洗涤煤油、柴油等油污 D.淀粉和纤维素在人体内最终水解为葡萄糖,为生命活动提供能量 8. Weiss 利用光敏剂QD制备2-环已基苯乙烯(c)的过程如图。下列说法不正确的是 A. a的二氯代物有3种 B.1mol b完全燃烧消耗10mol O2 C.c具有顺式和反式2种结构 D.a、b、c均能使溴水和稀高锰酸钾溶液褪色 9.实验室制备一瓶纯净氯^气的反应装置如下图所示。关于实验操作或;叙述正确的是 A. 中圆底烧瓶中需加入碎瓷片 B. b、c中所盛试剂依次为浓硫酸、饱和食盐水 C. d中黄绿色气体从下往上逐渐充满整个集气瓶 D. e中NaOH溶液可用浓氨水代替 10. 电催化合成氨法在电能的推动下不受热力学平衡限制,实现N2、H2O常温常压合成氨,下图为N2在不同电极材料表面复化的机制示意图。下列说法正确的是( ) A.电极材料起吸附作用,不影响N2的氢化过程 B.N2在氢化反应之前需先解离成单独的氮原子 12. C.电催化合成氨原子利用率100% D. 2.8gN2 理论上可以产生0.2NA个NH3分子 11. 25°C时,醋酸的电离常数为1.8×10-5。 向20mL2.0 mol/L CH3COOH溶液中逐滴加入2.0mol/L NaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法正确的是 A. a点水电离出的c(H+ )=6.0×10-3 mol/L B. b点c(CH3COOH)>c(Na+)>c(CH3COO—) C. c点恰好完全反应,溶液中无CH3COOH D. d点c(Na+)=2c(CH3COO—)+2c(CH3COOH) 12.我国某科研机构设计下图装置,利用K2Cr2O7实现含米酷废水的有效处理,一段时间后,中间室中NaCl溶液的浓度减小。下列说法正确的是 A. M为该电池的正极 B.该装置在高温下处理含苯酚废水效果更佳 C. a为阳离子交换膜,b为阴离子交换膜 D. N电极反应式为: Cr2O72— +6e—+8H+ = 2Cr(OH)3↓+H2O 13. 短周期元素X、Y、Z原子序数之和为16, 原子半径大小为r(Y)>r(X)>r(Z), 它们的常见单质在适当条件下可发生如图变化,其中B和C均为10电子分子。下列说法不正确的是 A. X与Z形成的某种化合物可用来杀菌消毒 B.自然界中X单质与Y单质不能发生化学反应 C. B和C分子间因形成氢键而使C极易溶于B中 D. A和C一定条件下能发生氧化还原反应 26.(14分)亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,熔点-64.5℃,沸点-5.5℃,遇水易水解。它是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成,某化学兴趣小 组设计下图装置制备NOC1。回答下列相关问题: (1) NOCl分子中各原子均满足8电子稳定结构,NOCI的电子式为 (2)装置乙中的液体为 ,装置丙作用是 . (3)实验时,先通入Cl2,观察到丁中烧瓶内充满黄绿色气体时,再通入NO,这样操作 目的是 。待丁中烧瓶内有一定量液体生成时,停止实验。 (4)上述装置设计有一不妥之处,理由是 (用化学方程式表示)。 (5)测定NOCl的纯度:取所得产物ag溶于水,配制成250mL溶液;取25.00mL.于 锥形瓶中,以K2Cr2O7溶液为指示剂,用cmol.L-1AgNO3标准溶液滴定至终点,消 耗标准溶液的体积为24.00mL。滴定终点的现象是 ,亚硝酰氯(NOCl)的纯度为 。(Ag2CrO4砖红色:Ksp(AgCl)=1.56x10-10,Ksp(Ag2CrO4)=1.0x10-12,Ksp(AgNO2)=5.86×10-4) 27.(15分)五氧化二钒常用作化学工业中的催化剂,广泛用于冶金、化工生产。一种以钒渣(主要含有V2O3,还有少量 FeO、Al2O3、SiO2等)为原料生产V2O5的工艺流程如下: 已知:VO2++H2OVO3++2H+ (1)“焙烧”时,V2O3转化为NaVO3的化学方程式是 。 (2)滤渣 1为 (填化学式),“酸浸”后,调pH=7.6,除了得到沉淀Fe(OH)3、 ,另一个目的是 . (3)“沉钒”得到偏钒酸铵(NH4VO3)的离子方程式是 。图1是沉钒率随 温度的变化曲线,温度高于80℃,沉钒率下降,其可能原因是 (4)在“煅烧”过程中,固体残留率(剩余固体质量/原始固体质量x100%)随温度变化的曲线如图2所示。NH4VO3分解过程中,先后失去的物质分别是 、 。(填化学式) (5)金矾液流电池的电解质溶液为VOSO4.溶液,电池的工作原理为。 VO2++V2++2H+VO2++H2O+V3+,电池充电时,阳极的电极反应式为 . 28.(14分)甲醇是重要的化工原料。利用合成气(主要成分为(CO,CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下: 1.CO2(g)+3H2(g)⇄CH3OH(g)+H2O(g) ΔH1 2.CO2(g)+H2(g)⇄CO(g)+H2O(g) ΔH2 3.CH3OH(g)⇄CO(g)+2H2(g) ΔH3 回答下列问题: (1)已知反应2中相关化学键键能数据如下: 化学键 H-H C=O C≡O H-0 E/KJ·mol-1 436 803 1076 465 由此计算ΔH2= KJ·mol-1。已知ΔH1=-63KJ·mol-1,则ΔH3= KJ·mol-1。 (2)对于反应1,不同温度对CO2的平衡转化率及催化剂的效率影响如下图所示,请回 答下列问题: ①下列说法不正确的是( ) A. M点时平衡常数比N点时平衡常数大 B.温度低于250℃时,随温度升高甲醇的平衡产率降低 C. 其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1 D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率 ②若在刚性容器中充入3molH2和1molCO2发生反应1,起始压强为4MPa,则图中M 点CH3OH的体积分数为 ,250℃时反应的平衡常数Kp= (MPa)-2 (保留三位有效数字); ③若要进一步提高甲醇产率,可采取的措施有 (写两条即可) (3)相同条件下,一定比例CO/CO2/H2混合气体甲醇生成速率大于CO2/H2混合气体甲 醇生成速率,结合反应1、2分析原因: . (4)以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸, CO2(g)+CH4(g)⇄CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速 率如下图所示: 250~300 ℃时,乙酸的生成速率降低的主要原因是 . 300~400℃时,乙酸的生成速率升高的主要原因是 . 35. [化学 选修3:物质结构与性质] (15分) 黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜。回答下列问题。 (1)基态硫原子中核外电子有______种空间运动状态。 Fe2+ 的电子排布式是 (2)液态SO2可发生自偶电离2SO2 = SO2+ +SO2—, SO32— 的空间构型是_ 与SO2+互为等电子体的分子有 (填化学式,任写一一种)。 (3) CuCl 熔点426℃,融化时几乎不导电,CuF 熔点908℃,沸点100℃,都是铜(I)的卤化物,熔沸点相差这么大的原因是 (4) 乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是_____。 乙硫醇的沸点比乙醇的沸点______ ( 填“高”或“低”),原因是 (5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是 ,其密度为 g/cm3 (阿伏加德罗常数的值用NA表示)。 36.[化学——选修5:有机化学基础] (15分) 已知: 回答以下问题: (1) A的化学名称为 。 (2) B的结构简式为_______, C中官能团的名称是_______. (3)由A生成D的反应类型为_______________。 (4)由C和E生成F的化学方程式为__________________________________________ (5)芳香化合物X是E的同分异构体,可与FeCl3溶液发生显色反应,其核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为6:2:2。写出两种符合要求X的结构简式_____________________________、_____________________________ (6)写出以1-溴-2.苯基乙烷为原料制备化合物的合成销路线(其他试剂任选)。___________________________________________________查看更多