- 2021-04-12 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】河南省名师联盟2020届高三下学期5月联考试题
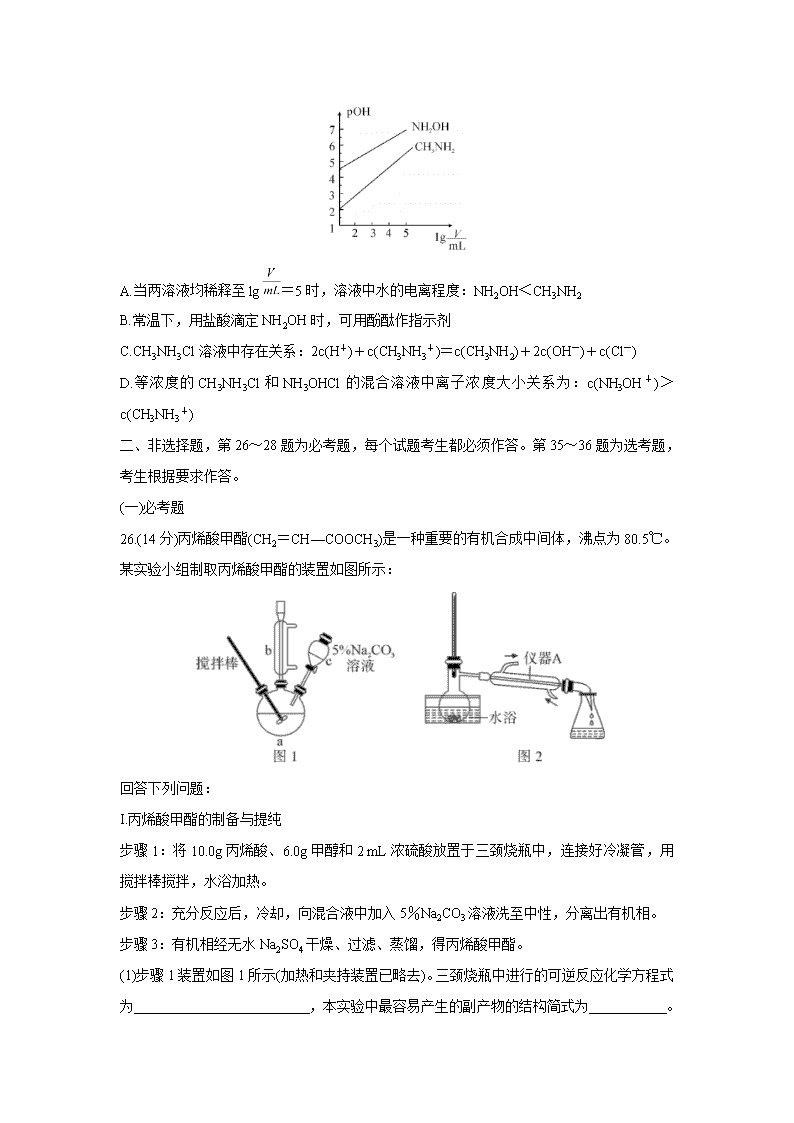
河南省名师联盟2020届高三下学期5月联考试题 可能用到的相对原子质量:H1 C12 N14 O16 Na23 S32 Cl35.5 K39 Re186 一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.化学与生产、生活密切相关,下列有关说法正确的是( ) A.“玉兔号”月球车帆板太阳能电池的材料是氮化硅或二氧化硅 B.硅胶、CaO、P2O5都可用作食品干燥剂 C.我国积极倡导“低碳经济”,将煤液化就是一种“低碳”方式 D.可利用新制Cu(OH)2悬浊液检验患者尿液中是否含有葡萄糖 8.下列实验“操作和现象”与“结论”对应且正确的是( ) 9.化合物A是一种危险化学制品,具有腐蚀性、可自燃性。主要用于医药工业,在有机合成 中用作催化剂等。其结构如右图所示,其中W、X、Y、Z是处于三个不同短周期且原子序 数依次递增的常见元素,X、Y核外电子层数相同,Y核外最外层电子数是X内层电子数 的3倍。下列叙述正确的是( ) A.原子半径:Y>X>Z>W B.简单气态氢化物的稳定性:X>Y C.X与W形成的常见化合物有两种 D.W和Z形成的化合物为离子化合物 10.某酯的相对分子质量不大于160,可表示为CnH2nO2(n为整数)。在酸性条件下能水解生成两种相对分子质量相等的酸和醇,且该醇最终可被氧化为羧酸,不考虑立体异构,则满足该条件的酯有( ) A.12种 B.14种 C.23种 D.28种 11.铼(Re)是种银白色的重金属,是地球地壳中最稀有的元素之一,它广泛应用于航空航天领域。在工业上,高温灼烧含ReS2的矿粉,可以制备Re2O7。另一种途径是从炼铜的废液中提取铼,其简易工艺流程如下(部分副产物省略,铼在废液中以ReO4-形式存在)。下列说法错误的是( ) A.在“反萃取”中,加入氨水、水的目的是萃取有机层中的ReO4- B.在NH4ReO4制备Re2O7的过程中,产生的副产物可回收利用 C.实验室在H2还原Re2O7的过程中,一共消耗7 mol H2,则可制得2 mol Re D.以含ReS2的矿石原料生产48.4 t Re2O7,理论上转移电子3.0×106 mol 12.制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。一定条件下,如下图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其他有机物生成)。电流效率=(生成目标产物消耗的电子数/转移的电子总数)×100%,则下列说法错误的是( ) A.电子移动方向为:a→d;e→b B.d电极反应式为C6H6+6H++6e-=C6H12 C.该储氢装置的电流效率明显小于100%,其原因可能是除目标产物外,还有H2生成 D.由表中数据可知,此装置的电流效率约为32.1% 13.常温时,浓度均为1 mol·L-1的CH3NH2和NH2OH两种碱溶液,起始时的体积都为10 mL。分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液的体积),pOH=-lg[c(OH-)]。 下列说法正确的是( ) A.当两溶液均稀释至lg=5时,溶液中水的电离程度:NH2OH<CH3NH2 B.常温下,用盐酸滴定NH2OH时,可用酚酞作指示剂 C.CH3NH3Cl溶液中存在关系:2c(H+)+c(CH3NH3+)=c(CH3NH2)+2c(OH-)+c(Cl-) D.等浓度的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系为:c(NH3OH+)>c(CH3NH3+) 二、非选择题,第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,考生根据要求作答。 (一)必考题 26.(14分)丙烯酸甲酯(CH2=CH—COOCH3)是一种重要的有机合成中间体,沸点为80.5℃。某实验小组制取丙烯酸甲酯的装置如图所示: 回答下列问题: I.丙烯酸甲酯的制备与提纯 步骤1:将10.0g丙烯酸、6.0g甲醇和2 mL浓硫酸放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。 步骤2:充分反应后,冷却,向混合液中加入5%Na2CO3溶液洗至中性,分离出有机相。 步骤3:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙烯酸甲酯。 (1)步骤1装置如图1所示(加热和夹持装置已略去)。三颈烧瓶中进行的可逆反应化学方程式为 ,本实验中最容易产生的副产物的结构简式为 。 (2)仪器b的作用为 。 (3)混合液用5%Na2CO3溶液洗涤的目的是 。 (4)实验室配制100 g 5% Na2CO3溶液需用到的玻璃仪器是 。 (5)关于产品的蒸馏操作(夹持装置未画出)如图2所示。将步骤3(蒸馏)的操作补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,,弃去前馏分,收集80.5℃的馏分。 II.丙烯酸甲酯含量的测定 步骤1:将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5 mol·L-1的KOH溶液10.00 mL,加热使之完全水解。 步骤2:用酚酞作指示剂,向冷却后的溶液中滴加0.5 mol·L-1的HCl溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00 mL。 (6)本次酯化反应丙烯酸的转化率为 。 27.(14分)高锰酸钾是锰的重要化合物和常用的氧化剂。下图是在实验室中制备KMnO4晶体的流程: 回答下列问题: (1)在实验流程中,操作①和②均需在坩埚中进行,根据实验实际应选择 (填序号)。 a.铁坩埚 b.石英坩埚 c.瓷坩埚 d.氧化铝坩埚 (2)“熔融物”中KClO3应过量的原因除了提高MnO2利用率外,还有 。 (3)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为 。若溶液碱性过强,则MnO4-又会转化为MnO42-,同时产生无色气体,该转化过程中发生反应的离子方程式为 。 (4)还可采用电解K2MnO4溶液(绿色)的方法制备KMnO4(装置如图所示)。 ①电解过程中右侧石墨电极的电极反应式为 。 ②随着电解的进行,溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能原因是 。 ③为避免该现象,请提出改进装置的措施: 。 28.(15分)甲酸在有机化工中有广泛的用途,工业上可有多种途径来制备甲酸。回答下列问题: (1)利用光催化制甲酸原理如图所示。 该装置能量转化方式为 。 (2)另一种以Ru化合物为催化剂,用H2和CO2制取甲酸的反应机理如下: 第一步:Ru(OH)2+2H2=RuH2+2H2O快速平衡 第二步:RuH2+2CO2→Ru(OOCH)2 慢反应(近似认为不影响第一步反应的平衡) 第三步:Ru(OOCH)2+2H2O→2HCOOH+Ru(OH)2快反应 下列表述正确的是 (填序号)。 A.平衡时v(第一步的逆反应)>v(第二步反应) B.反应的中间产物只有Ru(OOCH)2 C.第二步反应中RuH2与CO2的碰撞仅部分有效 D.第三步反应的活化能较低 (3)CO2加氢也可制备甲酸(HCOOH)。 ①工业上利用甲酸的能量关系转换图如下: 反应CO2(g)+H2(g)HCOOH(g)的焓变△H= kJ·mol-1。 ②温度为T1℃时,将等物质的量的CO2和H2充入体积为1 L的密闭容器中发生反应:CO2 (g)+H2(g)HCOOH(g) K=2 实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。 T1℃时,k逆= (以k正表示)。 ③当温度改变为T2℃时,k正=1.9k逆,则T2℃时平衡压强 T1℃时平衡压强(填“>”“<”或“=”),理由是 。 (4)甲酸是唯一能和烯烃发生加成反应的羧酸,目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。 ①写出该脱硝原理总反应的化学方程式: 。 ②为达到最佳脱硝效果,应采取的条件是 。 (5)T℃甲酸与醋酸钠溶液反应:HCOOH+CH3COO-HCOO-+CH3COOH,该反应的平衡常数为12.5,则该温度下醋酸的电离常数Ka(CH3COOH)= (T℃时甲酸的电离常数为2×10-4)。 (二)选考题 35.[化学—选修3:物质结构与性质](15分) 碳是地球上组成生命的最基本元素之一,与其他元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。回答下列问题: (1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。 ①Li+与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一对孤电子对作用形成稳定结构W(如图)。基态碳原子核外有 种运动状态不同的电子,其外围电子轨道表示式为 。 W中Li+与孤对电子之间的作用属于 (填标号)。 A.离子键 B.共价键 C.氢键 D.配位键 E.以上都不是 ②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是 。 ③冠醚分子中氧的杂化轨道的空间构型是 ,C—O—C的键角 (填“>”“<”或“=”)109°28′。 (2)碳的一种同素异形体——石墨,其晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为 个。已知石墨的密度为ρ g·cm-3,C—C键键长为r cm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距d为 cm。 (3)碳的另一种同素异形体——金刚石,其晶胞如图3所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图 (从A~D图中选填)。 36.[化学—选修5:有机化学基础](15分) 某抗肿瘤药物的有效成分为E,其一种合成路线如下: 回答下列问题: (1)质谱图显示有机物A的最大质荷比为 。 (2)E分子中官能团的名称是 ;A→B的反应类型包括中和反应和 。 (3)常温下,E不能与下列试剂反应的是 (填字母)。 a.H2 b.FeCl3溶液 c.溴水 d.NaHCO3 (4)在冰水浴条件下,E与乙酸酐[(CH3CO)2O]反应生成一种香料M,1个M分子中含2个酯基。由E合成M的化学方程式为 。 (5)T是C的同系物,T的相对分子质量比C多28,则T的同分异构体中,满足下列条件的同分异构体有 种(不考虑立体异构)。 ①属于芳香族化合物②既能发生水解反应又能发生银镜反应 其中核磁共振氢谱有4组峰且峰面积之比为1:1:2:6的T的所有可能结构为 。 (6)已知:RBrRMgBr。设计由环己烯和乙醛制备化合物的合成路线 (无机试剂和某些有机试剂任选)。 【参考答案】查看更多