- 2021-04-12 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
黑龙江省大庆实验中学2018-2019学年高二10月月考化学试题+Word版含答案
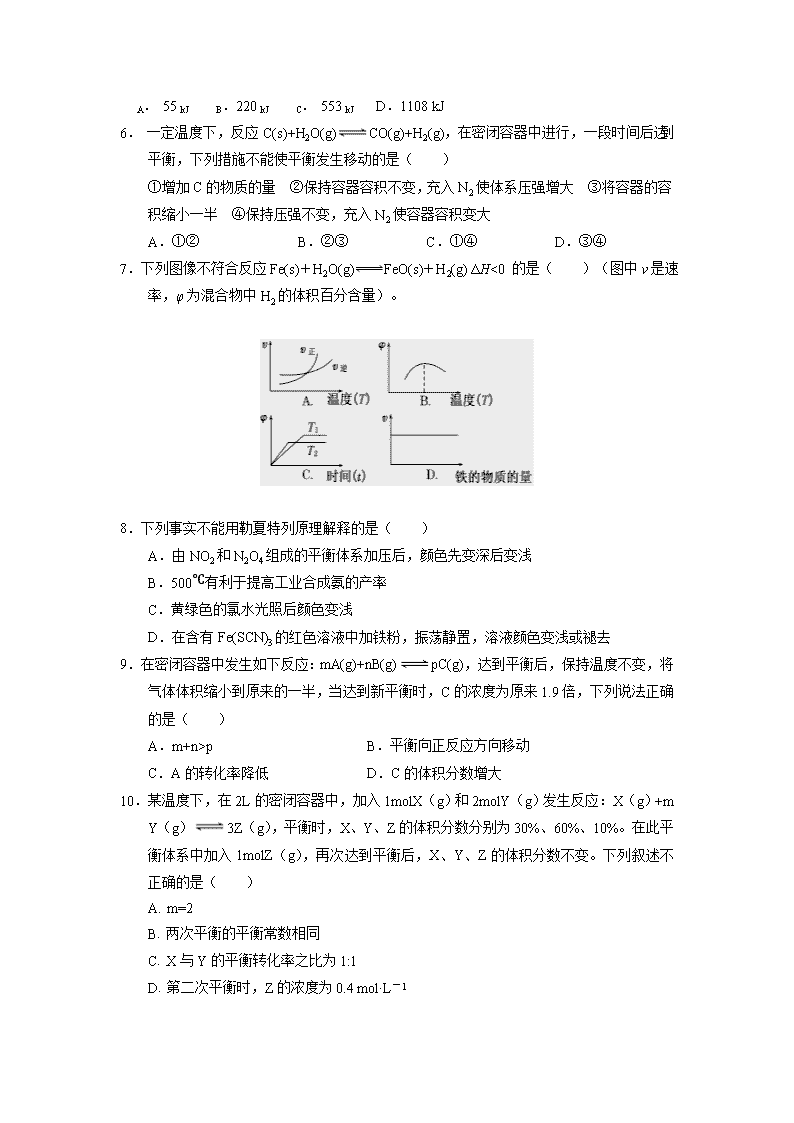
大庆实验中学2018—2019学年度上学期十月份月考 高二化学试题 说明:1. 本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间90分钟。 2. 可能用到的相对原子质量:H:1 C:12 O:16 第Ⅰ卷 选择题(共48分) 一、单项选择题(本题包括15小题,每小题2分,共30分,每小题只有一个选项符合题意。) 1.下列说法正确的是( ) A.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: B.甲烷的燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH= —890.3kJ·mol-1 C. 原电池中发生的反应达到平衡时,该电池仍有电流产生 D. 500 mL 2.0 mol·L-1的HCl(aq)和500 mL 2.0 mol·L-1的NaOH(aq)反应,产生的热量等于57.3 kJ 2.在做中和热实验测定中和热时,应使用的仪器正确的组合是( ) ①天平 ②量筒 ③烧杯 ④容量瓶 ⑤温度计 ⑥试管 ⑦酒精灯 A.①②④⑤ B.②③⑤ C.②③④⑦ D.全部 3.把下列四种溶液分别加入四个盛有10mL2mol·L-1盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸缓慢反应,其中反应最快的是( ) A.10 ℃ 20 mL 3 mol·L-1的X溶液 B.20 ℃ 30 mL 2 mol·L-1的X溶液 C.20 ℃ 10 mL 4 mol·L-1的X溶液 D.10 ℃ 10 mL 2 mol·L-1的X溶液 4.一定量的锌粒与足量稀硫酸反应,向反应混合液中加入某些物质,下列判断正确的是( ) A. 加入少量水,产生速率减小,H2体积不变 B. 加入NH4HSO4固体,产生H2速率不变,H2体积不变 C. 加入CH3COONa固体,产生H2速率减小,H2体积减小 D. 滴加少量CuSO4溶液,产生H2速率变大,H2体积不变 5.己知丙烷的燃烧热ΔH=—2215kJ·mol-1,若一定量的丙烷完全燃烧后生成18g水,则放出的热量约为( ) A. 55 kJ B.220 kJ C. 553 kJ D.1108 kJ 6. 一定温度下,反应C(s)+H2O(g)CO(g)+H2(g),在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( ) ①增加C的物质的量 ②保持容器容积不变,充入N2使体系压强增大 ③将容器的容积缩小一半 ④保持压强不变,充入N2使容器容积变大 A. ①② B.②③ C.①④ D.③④ 7.下列图像不符合反应Fe(s)+H2O(g)FeO(s)+H2(g) ΔH<0 的是( )(图中v是速率,φ为混合物中H2的体积百分含量)。 8.下列事实不能用勒夏特列原理解释的是( ) A.由NO2和N2O4组成的平衡体系加压后,颜色先变深后变浅 B.500℃有利于提高工业合成氨的产率 C.黄绿色的氯水光照后颜色变浅 D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 9.在密闭容器中发生如下反应:mA(g)+nB(g)pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法正确的是( ) A.m+n>p B.平衡向正反应方向移动 C.A的转化率降低 D.C的体积分数增大 10.某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( ) A.m=2 B.两次平衡的平衡常数相同 C.X与Y的平衡转化率之比为1:1 D.第二次平衡时,Z的浓度为0.4 mol·L-1 11.某反应的反应过程中能量变化如图1 所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能)。下列有关叙述正确的是( ) A.该反应为放热反应 B.催化剂能改变该反应的焓变 C.催化剂能降低该反应的活化能 D.逆反应的活化能大于正反应的活化能 12.SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)===SF6(g)的反应热ΔH为( ) A.-1780 kJ/mol B.-1220 kJ/mol C.-450 kJ/mol D.+430 kJ/mol 13.以NA代表阿伏加德罗常数的数值,则关于热化学方程式C2H2(g)+O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( ) A.转移10NA个电子时,该反应放出1300 kJ的能量 B.生成NA个液态水分子时,吸收1300 kJ的能量 C.有2NA个碳氧共用电子对生成时,放出1300 kJ的能量 D.有10NA个碳氧共用电子对生成时,放出1300 kJ的能量 14.X、Y、Z三种气体,取X和Y按1︰1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于( ) A.33% B.40% C.50% D.67% 15.已知H2的燃烧热为ΔH=-285.8 kJ·mol-1,CO的燃烧热为ΔH=-282.8 kJ·mol-1;现有H2和CO组成的混合气体5.6 L(标准状况),经充分燃烧后,放出总热量为71.15 kJ,并生成液态水。下列说法正确的是( ) A.CO燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-282.8 kJ·mol-1 B.H2燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1 C.燃烧前混合气体中CO的体积分数为60% D.燃烧后的产物全部与足量的过氧化钠作用可产生0.125 mol O2 二、多项选择题(本题包括6小题,每小题3分,共18分。每道题最多有2个选项符合题意。) 16.已经298K、101kPa时,下列说法不正确的是( ) 反应1:4Fe(s)+3O2(g) = 2Fe2O3 (s) ΔH1 =-1648 kJ/mol 反应2:C(s) + O2 (g) = CO2 (g) ΔH2 = -393 kJ/mol 反应3:2Fe(s)+2C(s) +3O2(g) = 2FeCO3(s) ΔH3 =-1480 kJ/mol 反应4:2FeCO3(s) +1/2O2(g) =2CO2(g) +Fe2O3(s) ΔH4 A. 上述反应1.2.3.4在热力学上自发趋势都很大 B. 反应1和3在较低温度下能自发反应,反应4是熵增反应 C. 自发反应代表反应一定能发生,可以判断过程的方向,但不能确定过程发生的速率 D. 反应1表示铁在氧气中燃烧的热化学方程式 17.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示: 已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( ) A.550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动 B.650℃时,反应达平衡后CO2的转化率为25.0% C.T℃时,若充入等体积的CO2和CO,平衡不移动 D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0p总 18.一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是( ) 3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g) ΔH=-Q(Q>0) A.v逆(N2)=3v正(H2) B.v正(HCl)=4v正(SiCl4) C.混合气体密度保持不变 D.c(N2):c(H2):c(HCl)保持不变 19.一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应 2SO2(g) + O2(g)2SO3(g)(正反应放热),相关数据如下,下列说法正确的是( ) 容器 1 容器 2 容器 3 反应温度 T/K 700 700 800 反应物投入量 2molSO2、 1molO2 4molSO3 2molSO2、 1molO2 平衡ν正(SO2 )/mol·L-1·s-1 ν1 ν1 ν1 平衡 c(SO3 )/ mol·L-1 c1 c2 c3 平衡体系总压强 p/Pa p1 p2 p3 物质的平衡转化率ɑ α1(SO2) α2(SO3) α3(SO2) 平衡常数 K K1 K2 K3 A. ν1<ν2,c2<2c1 B.K1>K3,p2>2p3 C.ν1< ν3,α1(SO2) > α3(SO2) D.c2>2c3,α2(SO3) +α3(SO2)<1 20.温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( ) t / s 0 50 150 250 350 n(PCl3) / mol 0 0. 16 0. 19 0. 20 0. 20 A.反应在前50 s 的平均速率ν(PCl3)= 0. 0032 mol·L-1·s-1 B.保持其他条件不变,升高温度,平衡时c(PCl3)= 0. 11 mol·L-1,则反应的ΔH<0 C.相同温度下,起始时向容器中充入1. 0 mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2,反应达到平衡前ν(正)>ν(逆) D.相同温度下,起始时向容器中充入2. 0 mol PCl3 和2. 0 mol Cl2,达到平衡时,PCl3 的转化率大于80% 21.羰基法提纯粗镍涉及的两步反应依次为: (1)Ni(s)+4CO(g)Ni (CO)4(g) ΔH < 0 (2)Ni(CO)4(g) Ni(s)+4CO(g) 下列说法正确的是( ) A. T1查看更多