- 2021-04-12 发布 |
- 37.5 KB |
- 24页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习最佳反应条件、原因解释课件(24张)
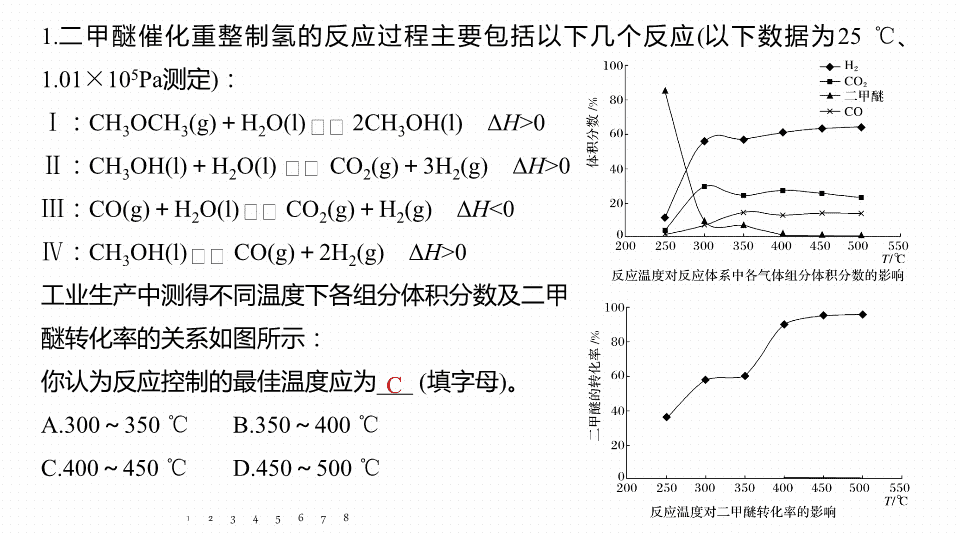
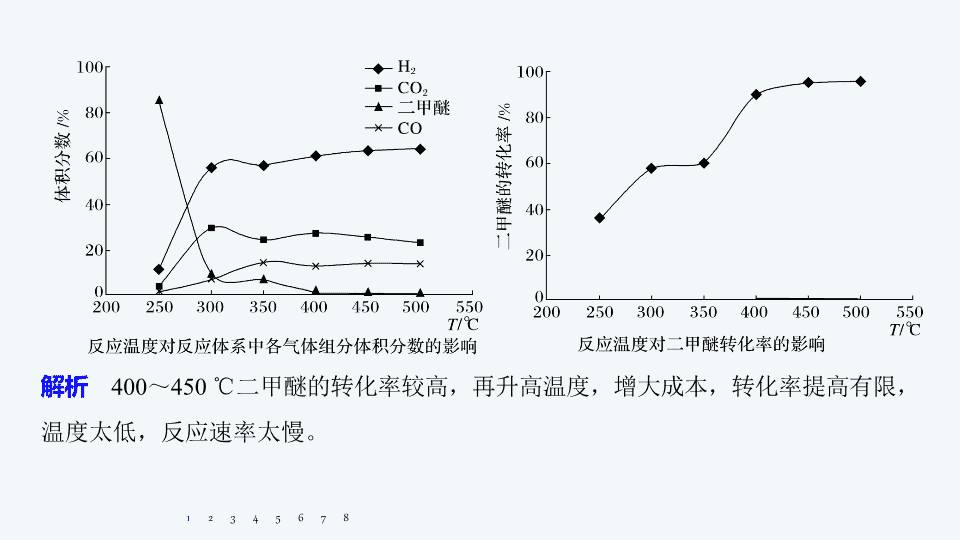
最佳反应条件、原因解释集训 专题 六 大题 题 空逐空突破 ( 十 ) 1. 二甲醚催化重整制氢的反应过程主要包括以下几个反应 ( 以下数据为 25 ℃ 、 1.01 × 10 5 Pa 测定 ) : Ⅰ : CH 3 OCH 3 (g) + H 2 O(l) 2CH 3 OH(l) Δ H >0 Ⅱ : CH 3 OH(l) + H 2 O(l) CO 2 (g) + 3H 2 (g) Δ H >0 Ⅲ : CO(g) + H 2 O(l) CO 2 (g) + H 2 (g) Δ H <0 Ⅳ : CH 3 OH(l) CO(g) + 2H 2 (g) Δ H >0 工业生产中测得不同温度下各组分体积分数及二甲 醚转化率的关系如图所示: 你认为反应控制的最佳温度应为 ___ ( 填字母 ) 。 A.300 ~ 350 ℃ B.350 ~ 400 ℃ C.400 ~ 450 ℃ D.450 ~ 500 ℃ 1 2 3 4 5 6 7 C 8 解析 400 ~ 450 ℃ 二甲醚的转化率较高,再升高温度,增大成本,转化率提高有限,温度太低,反应速率太慢。 1 2 3 4 5 6 7 8 2. 重晶石主要成分为 BaSO 4 ,含少量的 SiO 2 、 CaO 和 MgO 杂质,以下是一种制取 Ba(NO 3 ) 2 的工业流程。 1 2 3 4 5 6 7 焙烧过程中主反应为: BaSO 4 + 4C BaS + 4CO ↑ ,除此以外还可能有 BaCO 3 等副产物生成,通过改变温度以及煤粉的用量可减少副反应发生。 (1) 依据图 1 判断生成 BaS 的反应是 _____( 填 “ 放热 ” 或 “ 吸热 ” ) 反应;反应温度至少应控制在 _______ 以上。 吸热 600 ℃ 8 解析 由图可知升高温度, CO 的物质的量增大,则升高温度平衡正向移动,为吸热反应,为减少副反应的发生,应在 600 ℃ 以上进行。 1 2 3 4 5 6 7 8 (2) 控制 BaSO 4 的量不变,改变 C 的量,测得原料中碳的物质的量对平衡组成的影响如图 2 所示,判断原料中 至少为 ____( 填字母 ) 。 a.1.5 b.2.0 c.3.75 1 2 3 4 5 6 7 c 8 解析 由图像可知加入 C 可以减少副反应,使硫酸钡完全转化生成 BaS ,且 C 生成 CO , BaS 为 0.2 mol , CO 为 0.75 mol ,根据原子守恒,则判断原料中 至少为 3.75 。 1 2 3 4 5 6 7 8 3. 以乙烯 (C 2 H 4 ) 作为还原剂脱硝 (NO) ,脱硝机理如图 1 ,则总反应的化学方程式为 _______________________________________ ;脱硝率与温度、负载率 ( 分子筛中催化剂的质量分数 ) 的关系如图 2 ,为达到最佳脱硝效果,应采用的条件是 ___________ ___________ 。 1 2 3 4 5 6 7 350 ℃ 左右、 8 负载率 3.0% 解析 根据图 1 可以知道,在催化剂的作用下, C 2 H 4 与 NO 、 O 2 反应最终生成 N 2 、 CO 2 、 H 2 O ,总反应的化学方程式为: 6NO + 3O 2 + 2C 2 H 4 3N 2 + 4CO 2 + 4H 2 O ;由图可知, b 曲线的最高点处,脱硝率高,负载率低,温度适宜,适宜条件为 350 ℃ 左右、负载率 3.0% 。 1 2 3 4 5 6 7 8 4. 在密闭容器中充入 5 mol CO 和 4 mol NO ,发生反应 2NO(g) + 2CO(g) N 2 (g) + 2CO 2 (g) Δ H 1 =- 746.5 kJ·mol - 1 ,图 1 为平衡时 NO 的体积分数与温度、压强的关系。 (1) 温度: T 1 ____( 填 “ < ” 或 “ > ” ) T 2 。 1 2 3 4 5 6 7 > 8 解析 根据反应 2CO(g) + 2NO(g) N 2 (g) + 2CO 2 (g) Δ H =- 746.5 kJ·mol - 1 ,升高温度,平衡逆向移动,所以 NO 的体积分数会增大,即 T 1 > T 2 。 1 2 3 4 5 6 7 8 (2) 若在 D 点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中 A ~ G 点中的 ___ 点。 1 2 3 4 5 6 7 A 8 解析 若在 D 点对反应容器升温的同时扩大体积使体系压强减小,则平衡会逆向移动, NO 的体积分数增加,重新达到的平衡状态可能是图中 A 点。 1 2 3 4 5 6 7 8 (3) 某研究小组探究催化剂对 CO 、 NO 转化的影响。将 NO 和 CO 以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 NO 含量,从而确定尾气脱氮率 ( 脱氮率即 NO 的转化率 ) ,结果如图 2 所示。若低于 200 ℃ ,图 2 中曲线 Ⅰ 脱氮率随 1 2 3 4 5 6 7 温度升高而变化不大的主要原因为 __ ___________________________ ; a 点 _____( 填 “ 是 ” 或 “ 不是 ” ) 对应温度下的平衡脱氮率,说明其理由 ______ ________________ 温度较低时,催化剂的活性偏低 不是 ____________________________________________ 。 该反应 为放热反应,根据 线 Ⅱ 可知, a 点对应温度下的平衡脱氮率应该更高 8 解析 根据图像可知,温度较低时,催化剂的活性偏低,因此温度低于 200 ℃ ,曲线 Ⅰ 脱氮率随温度升高变化不大; a 点不是对应温度下的平衡脱氮率,因为该反应为放热反应,根据曲线 Ⅱ 可知, a 点对应温度下的平衡脱氮率应该更高。 1 2 3 4 5 6 7 8 从溶液中得到锡酸钠晶体的实验操作是 _________ 、趁热过滤、洗涤、干燥。 右 图是 “ 碱浸 ” 实验的参数,请选择 “ 碱浸 ” 的合适条件 __ _____________________________ 。 蒸发结晶 烧碱浓度为 100 g·L - 1 、温度为 85 ℃ 5. 锡酸钠可用于制造陶瓷电容器的基体、颜料和催化剂。以锡锑渣 ( 主要含 Sn 、 Sb 、 As 、 Pb 的氧化物 ) 为原料,制备锡酸钠的工艺流程图如图所示: 1 2 3 4 5 6 7 8 解析 由图可知,烧碱浓度为 100 g·L - 1 ,温度为 85 ℃ 时,锡浸出率最高。 1 2 3 4 5 6 7 8 6. 某实验室模拟反应 2C(s) + 2NO 2 (g) N 2 (g) + 2CO 2 (g) Δ H =- 64.2 kJ·mol - 1 ,在密闭容器中加入足量的 C 和一定量的 NO 2 气体,维持温度为 T ℃ ,如图为不同压强下该反应经过相同时间 NO 2 的转化率随着压强变化的示意图。请从动力学角度分析, 1 050 kPa 前,反应中 NO 2 转化率随着压强增大而增大的原因 _______________________ ________________________________________________ ;在 1 100 kPa 时, NO 2 的体积分数为 _____ 。 1 2 3 4 5 6 7 1 050 kPa 前反应未达平衡状态,随着压强增大,反应速率加快, NO 2 转化率提高 50% 8 2C(s) + 2NO 2 (g) N 2 (g) + 2CO 2 (g) 起始 /mol 1 0 0 变化 /mol 0.4 0.2 0.4 平衡 /mol 0.6 0.2 0.4 1 2 3 4 5 6 7 解析 根据示意图, 1 050 kPa 前,反应未达到平衡,随着压强增大,反应速率增大, NO 2 的转化率加快;假设通入 1 mol NO 2 , 8 7. T ℃ 时,向一恒容密闭容器中加入 3 mol H 2 和 1 mol Se ,发生反应: H 2 (g) + Se(s) H 2 Se (g) Δ H < 0 ,温度对 H 2 Se 产率的影响如图: 1 2 3 4 5 6 7 550 ℃ 时 H 2 Se 产率最大的原因: __________ ________________________________________________________________________________________________________________________________ 。 低于 550 ℃ 时,温度越高反应速率越快, H 2 Se 的产率越大;高于 550 ℃ 时,反应达到平衡,该反应为放热反应,温度升高平衡逆向移动, H 2 Se 的产率越小 8 8. 将甲醇转化耦合到丁烯裂解过程中生产丙烯,主要涉及下列反应: ① 2C 4 H 8 (g) —→ 2C 3 H 6 (g) + C 2 H 4 (g) Δ H > 0 ② 2CH 3 OH(g) —→ C 2 H 4 (g) + 2H 2 O(g) Δ H < 0 ③ C 2 H 4 (g) + C 4 H 8 (g) —→ 2C 3 H 6 (g) Δ H < 0 已知:甲醇吸附在催化剂上,可以活化催化剂;甲醇浓度过大也会抑制丁烯在催化剂上的转化。 1 2 3 4 5 6 7 1.0 8 1 2 3 4 5 6 7 8 (2) 图 2 是某压强下,将 CH 3 OH 和 C 4 H 8 按一定的物质的量之比投料,反应达到平衡时 C 3 H 6 的体积分数随温度的变化曲线。由图可知平衡时 C 3 H 6 的体积分数随温度的升高呈现先升高后降低,其原因可能是 ___________________________________________ ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 。 1 2 3 4 5 6 7 300 ~ 500 ℃ 时,丁烯裂解 ( 反应 ① ) 为主要反应,是吸热反应,升高温度,平衡正移,使 C 3 H 6 的体积分数增大;温度高于 500 ℃ 时,反应 ②③ 均为主要反应,是放热反应,升高温度,平衡逆移,使 C 3 H 6 的体积分数降低,同时温度升高易发生副反应, C 3 H 6 可能转化为 C 2 H 4 、 C 3 H 8 、 C 4 H 10 、 等,使 C 3 H 6 的体积分数降低 8 1 2 3 4 5 6 7 解析 由图 2 可知, 300 ~ 500 ℃ 时,丁烯裂解 ( 反应 ① ) 为主要反应,是吸热反应,升高温度,平衡正移,使 C 3 H 6 的体积分数增大; 温度高于 500 ℃ 时,反应 ②③ 均为主要反应,是放热反应,升高温度,平衡逆移,使 C 3 H 6 的体积分数降低,同时温度升高易发生副反应, C 3 H 6 可能转化为 C 2 H 4 、 C 3 H 8 、 C 4 H 10 、 等,使 C 3 H 6 的体积分数降低。 8查看更多