2017-2018学年安徽省六安市第一中学高二下学期开学考试化学试题(Word版)
安徽省六安市第一中学2017-2018学年高二下学期开学考试
化学试题
可能用到的相对原子质量: H-1 C-12 N-14 O-16 K-39 Mg-24 Al-27 S-32
一、选择题(每小题3分,共48分,每小题仅有一个最佳答案)
1、空温下,下列事实不能说明NH3·H2O为弱电解质的是
A.0.1mol/LNH3·H2O的 pH小于13
B.0.1mol/LNH4Cl的pH 小于7
C.相同条件下,浓度均为0.1mol/LNaOH溶液和氨水,氨水的导电能力弱
D.0.1mol/LNH3·H2O能使无色酚酞试液变红色
2、改变0.1mol/L二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数(x)
随pH的变化如图所示已知(x)=c(x)/[c(H2A)+c(HA-)+c(A2-)。下列叙述错误的是
A.pH=1.2时,c(H2A)=c(HA-) B.1g[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-) D.pH=4.2时,c(HA-)=c(A2-)=c(H2A)
3、常温下,下列各组离子在指定溶液中能大量共存的是
A.无色透明的溶液中: Fe3+、Mg2+、SCN-、Cl-
B.c(H+)/c(OH-)=1×10-12的溶液中: K+、Na+、CO32-、NO3-
C.(Fe2+)=1mol/L的溶液中: K+、NH4+、MnO4-、SO42-、
D.能使甲基橙变红的溶液中: Na+、NH4+、SO42-、HCO3-
4、已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体
积相同,发生反应: 2NO2(g)N2O4(g) ΔH<0,一段时间后相继达到平衡状态。下列说法中正确的是
A.平衡时NO2体积分数: 甲<乙
B.达到平衡所需时间,甲与乙相等
C.该反应的平衡常数表达式K=
D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
5、 根据理论研究证明,未来元素周期表可容纳164种元素,能否将其填满,还需要经历一个
漫长和极其艰苦的历程。理论上164号、114号元素位于同一主族。根据你所学知识,下列有关预测肯定不正确的是
A.164号元素是金属元素
B.164 号元素对应的最高价氧化物的水化物其碱性比114 号的强
C.164号元素位于IVA族
D.164 号元素存在稳定的气态氢化物,且还原性比SiH4弱
6、已知Ksp[Cu(OH)2]=22x10-20,Ksp[Fe(OH)3]=4.0x10-38,Cu2+和Fe3+完全生成氢氧化物沉淀时的pH分别为6.7和3.2。现在向pH=0、浓度均为0.04mol/L 的Cu2+、Fe3+溶液中加入某一固体,以中和H+调节pH(设溶液体积不变),该过程中Cu2+、Fe3+的浓度与pH 关系
正确的是
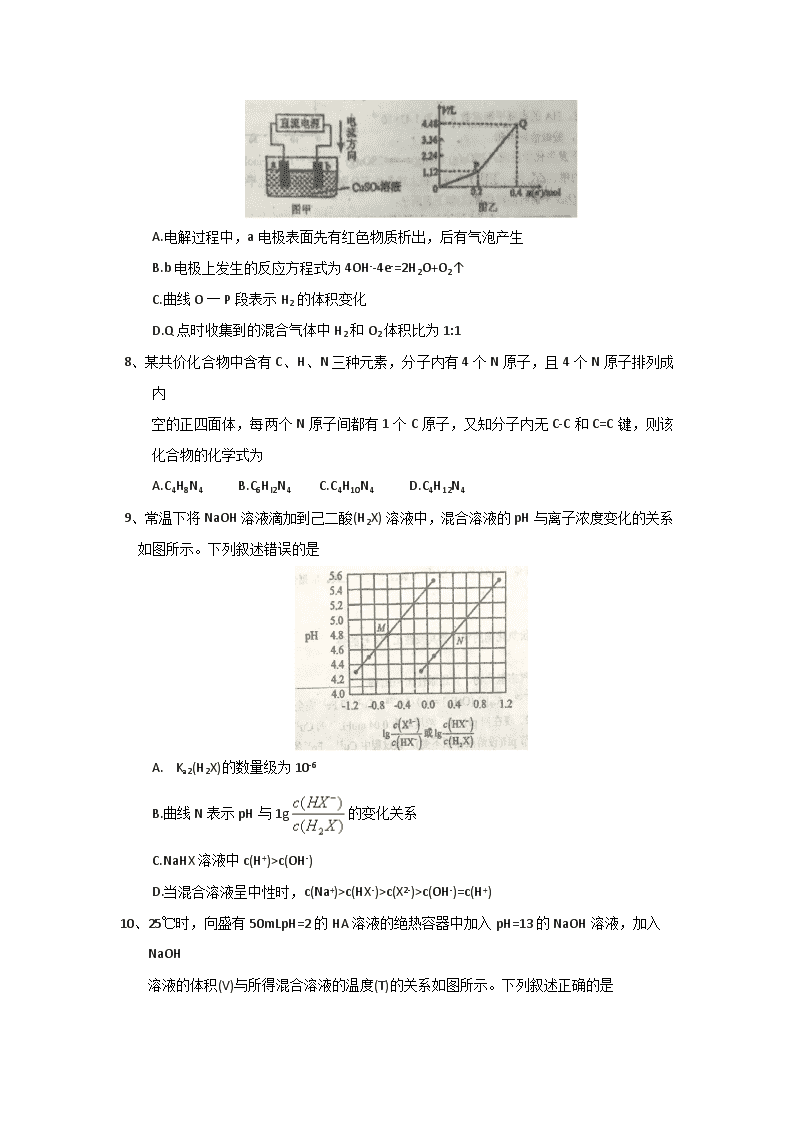
7、用情性电极电解一定量的硫酸铜溶液,实验装置如下图甲。电解过程中的实验数据如下图
乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法不正确的是
A.电解过程中,a电极表面先有红色物质析出,后有气泡产生
B.b 电极上发生的反应方程式为4OH--4e-=2H2O+O2↑
C.曲线O一P段表示H2的体积变化
D.Q点时收集到的混合气体中H2和O2体积比为1:1
8、某共价化合物中含有C、H、N 三种元素,分子内有4个N原子,且4个N原子排列成内
空的正四面体,每两个N原子间都有1个C原子,又知分子内无C-C和C=C键,则该化合物的化学式为
A.C4H8N4 B.C6Hl2N4 C.C4H10N4 D.C4H12N4
9、常温下将NaOH溶液滴加到己二酸(H2X) 溶液中,混合溶液的pH与离子浓度变化的关系
如图所示。下列叙述错误的是
A. Ka2(H2X)的数量级为10-6
B.曲线N表示pH与1g的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
10、25℃时,向盛有50mLpH=2 的HA溶液的绝热容器中加入pH=13 的NaOH溶液,加入NaOH
溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是
A.HA浴液的物质的量浓度为0.01mol/L
B.b→c 的过程中,温度降低的原因是溶液中发生了水解反应
C.25℃时,HA 的电离平衡常数K约为1.43X10-3
D.c 点处,酸碱恰好中和
11、一定条件下发生化学反应: 2SO2(g)+O2(g)2SO3(g) ΔH=-197kJ/mol。现有容积均为1L的甲、乙、丙、丁四个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热量(Q)及平衡时的转化率(X)如下表所示:
容器
起始时各物质的量(mol)
达到平衡时
放出的热量(Q kJ)
平衡时SO2
转化率(%)
SO2
O2
SO3
N2
甲
2
1
0
0
Q1
X1
乙
1
0.5
0
0
Q2=39.4
X2
丙
1
0.5
0
1
Q3
X3
丁
1.8
0.9
0.2
0
Q4
X4
下列叙述正确的是
A.Q1=78.8 B.Q1=Q4>Q2=Q3
C.X1>X3=40% D.X1=X4>X2=X3
12、 下列物质的电子式书写正确的是
A.次氯酸的 B.H2S
C.-CH3 D.NH4I
13、 已知同温度下的溶解度: Zn(OH)2>ZnS,MgCO3>Mg(OH)2,溶解或电离出S2-的能力为,
FeS>H2S>CuS,下列离子方程式错误的是
A.Mg2+ +2HCO3-+2Ca2++4OH-==Mg(OH)2↓+2CaCO3↓+2H2
O
B.Zn2++S2-+2H2O==Zn(OH)2↓+H2S↑
C.Cu2++H2S==CuS↓+2H+
D.FeS+2H+==Fe2+ +H2S↑
14、下列叙述中不正确的是
A.0.1mol /LNH4HS 溶液中 有.c(NH4+)
③>②
15、用图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-
将 CN-氧 化为 两 种无污染的气体,下列说法不正确的是
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为: Cl-+2OH--2e-=ClO-+H2O
C.阴极的电极反应式为: 2H2O+2e-=H2↑+2OH-
D.除去CN-的反应: 2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
16、由钾和氧组成的某种离子晶体中含钾的质量分数为78/126,其阴离子只有过氧离子(O22-)
和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为
A.2:1 B.1:1 C.1:2 D.1:3
二、填空题(共52分)习象055
17、(9分) 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe 三种金属元素组成。
(1) 基态Fe 原子有_____个未成对电子,Fe3+的电子排布式为__________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为_______。
(2)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2
O。乙醛中碳原子的杂化轨道类型为________,1mol 乙醛分子中含有的σ键的数目为______。乙酸的沸点明显高于乙醛,其主要原因是_________________。Cu2O为半导体材料,在其立方晶胞内部有4 个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。
(3) Al 单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_______。列式
表示Al 单质的密度______g·cm-3(不必计算出结果)。
18、(12分) 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:(i)CO(g)+2H2(g)==CH3OH(g) ΔH1=-90.1kJ/mol
(ii)CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH2=-49.0kJ/mol
煤气变换反应:(iii)CO(g)+H2O(g)==CO2(g)+3H2(g) ΔH3=-41.1kJ/mol
二甲醚合成反应: (iv)2CH3OH(g)==CH3OCH3(g)+H2O(g) ΔH4=-24.5kJ/mol
回答下列问题:
(1)分析二甲醚合成反应(iv)对于CO转化率的影响___________________________________。
(2) 由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式__________________。
(3) 有研究者在催化剂(含Cu-Zn-A1-O和A12O3)、压强为5.0 MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示。其中CO转化率随温度升高而降低的原因是______________。
(4)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93
kW·h·kg-1
)。若电解质为酸性,二甲醚直接燃料电池的负极反应为_________,一个二甲醚分子经过电化学氧化,可以产生个____电子的电量;该电池的理论输出电压为1.20V,能量密度E=______(列式计算。能量密度=电池输出电能/燃料质量,1kw·h=3.6×106 J)。
19、(9分) 结合下表回答下列问题:
物质
Fe(OH)2
Cu(OH)2
Fe(OH)3
溶度积/25℃
8.0×10-16
2.2×10-20
4.0×10-38
完全沉淀时的pH 范围
≥9.6
≥6.4
3~4
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
(1)最适合作氧化剂X的是_______(填字母),
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y 是_______(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为e(OH)3 沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2) 含Cr2O72-的废水毒性较大,某工厂废水中含5.0x10-3 mol/L的Cr2O72-,为了使废水的排放达标,进行如下处理:
①绿矾化学式为FeSO4·7H2O,
反应(I) 的离子方程式为______________________________。
②若处理后的废水中c(Cr3+)=3.0x10-6mol/L,则废水中c(Fe3+)=____mol/L。
(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
20、 (10分) (1) 二氧化氯(C1O2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安
全的杀菌消毒剂。目前已开发出用电解法制联C1O2的新工艺。
①图中用石墨作电极,在一定条件下电解饱和食盐水制取C1O2。则阳极产生C1O2的电极
反应式为___________________________。
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解,通过阳离子交换膜的阳离子的物质的量为______mol;用平衡移动原理解释阴极区pH增大的原因:__________________________________________________________。
(2) 为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-,电池工作时正极反应式为_____________________________。
若以该电池为电源,用石墨作电极电解100mL含有以下离子的溶液。
离子
Cu2+
H+
Cl-
SO42-
c/mol·L-1
1
4
4
1
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽路溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为_____mol。
中金万最(I)
21、(12分)Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿主要成分为(FeTiO3,还含有少量MgO、SiO2等杂质》来制备,工艺流程如下:
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为_________________。
(2)“酸浸”后,钛主要以TIOCl42-形式存在,写出相应反应的离子方程式________________。
(3) TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃
30
35
40
45
50
TiO2·xH2O转化率/%
92
95
97
93
88
分析40℃时 TiO2·xH2O转化率最高的原因____________________________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________。
(5) 若“滤液②”中c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)= 1.0x10-5mol/L,此时是否有Mg3(PO4)2沉淀生成___________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6) 写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式_______________________。
1-5:DDBAD 6-10:BCDDC 11-16:CCBDDC
二、 填空题(共52分)
17、(1)4 1s22s22p63s23p63d5 血红色
(2)sp3、sp2 6NA CH3COOH存在分子间氢键16
(3)12
18、(1) 消耗甲醇,促进甲醇合成反应(i) 平衡右移,CO转化率增大;生成的H2O,通过水煤
气变换反应(iii) 消耗部分CO。
(2)2CO(g)+4H2(g)==CH3OCH3(g)+H2O(g) ΔH=-204.7kJ/mol
(3) 反应放热,温度升高,平衡左移。
(4) CH3OCH3+3H2O= 2CO2+12H++12e- 12
=8.39kW·h·kg-1
19、 (1)C ;CuO或Cu(OH)2或CuCO3;4×10-3mol/L
(2)Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 2×10-13
mol/L
20、(1) ①Cl--5e-+2H2O=ClO2 ↑+4H+,
②0.01; 在阴极发生2H++2e-=H2↑,H+浓度减小,使得:H2OOH-+H+的平衡向右移动,
OH-浓度增大,pH 增大; (2) O2--4e-=O2 ↑ 0.1
21、(1) 90℃加热6h或100℃加热2h (2) FeTiO3+H++4Cl-=Fe2++TiOCl42-+2H2O
(3) 40℃前,未达到平衡状态,随着温度升高,转化率变大;40℃后,H2O2分解加剧,转化率降低
(4) 4 (5) Qc=[]2·[]3,Qc
查看更多