- 2021-04-12 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
陕西省渭南市韩城市司马迁中学2020届高三下学期质量检测化学试卷
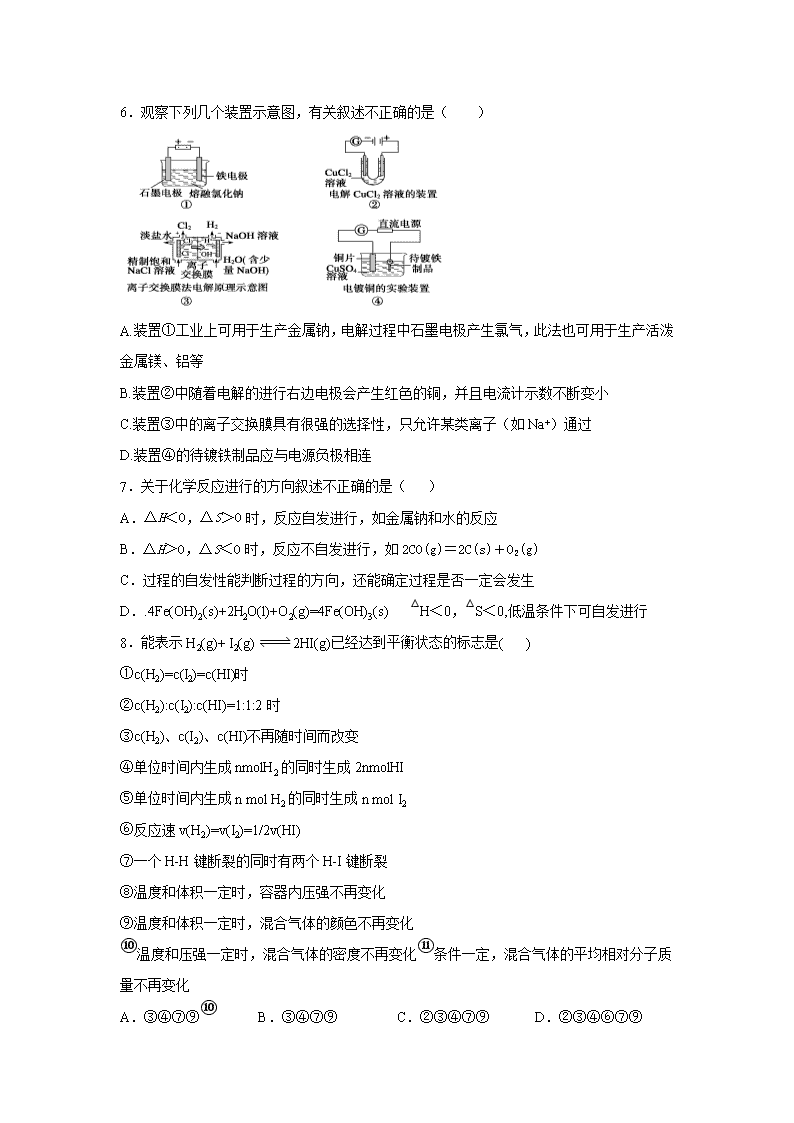
陕西省渭南市韩城市司马迁中学2020届高三下学期质量检测化学试卷 一、单选题(1-10每题2分;11-20每题3分,共50分) 1.化学与生产、生活、社会密切相关,下列说法正确的是( ) A.“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮的氧化物无关 B.高铁酸钾是一种新型高效、多功能的水处理剂,既能杀菌消毒又能净水 C.石灰石、铁粉、硅胶是食品包装中常用的干燥剂 D.纯碱是焙制糕点所用的发酵粉的主要成分之一,也可用纯碱除去物品表面的油污 2.设NA表示阿伏加德罗常数的值,下列说法中正确的是( ) A.常温常压下,56 g丙烯与环丁烷的混合气体中含有4NA个碳原子 B.25℃,pH=1的H2SO4溶液中,H+的数目为0.2NA C.标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA D.1 mol的P4O6中含有6 NA个P-O键(P4O6的结构如图: ) 3.下表是周期表的一部分,其中X、Y、Z、W为短周期主族元素,下列说法正确的是 ( ) A. W的最高价氧化物对应的水化物一定是强酸 B.Z的单质一定能溶于稀硫酸中 C.四种元素的最高正化合价均等于其族序数 D.四种原子中,Z的原子半径最小 4.对于可逆反应N2(g)+3H2(g)2NH3(g)(正反应为放热反应),要增大氨气产率,下列说法中不正确的是( )。 A.恒容时,增加氮气的物质的量 B.降低温度 C.增大压强 D.升高温度 5.对于在一个密闭容器中进行的反应C(s)+H2O(g) CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是 ( ) ①增加C的量; ②增加CO的量; ③将容器的体积缩小一半; ④保持体积不变,充入N2以增大压强; ⑤升高反应体系的温度; ⑥保持压强不变,充入N2以增大体积。 A.②③ B.①④ C.①⑥ D.④⑥ 6.观察下列几个装置示意图,有关叙述不正确的是( ) A.装置①工业上可用于生产金属钠,电解过程中石墨电极产生氯气,此法也可用于生产活泼金属镁、铝等 B.装置②中随着电解的进行右边电极会产生红色的铜,并且电流计示数不断变小 C.装置③中的离子交换膜具有很强的选择性,只允许某类离子(如Na+)通过 D.装置④的待镀铁制品应与电源负极相连 7.关于化学反应进行的方向叙述不正确的是( ) A.△H<0,△S>0时,反应自发进行,如金属钠和水的反应 B.△H>0,△S<0时,反应不自发进行,如2CO(g)=2C(s)+O2(g) C.过程的自发性能判断过程的方向,还能确定过程是否一定会发生 D..4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) △H<0,△S<0,低温条件下可自发进行 8.能表示H2(g)+ I2(g) 2HI(g)已经达到平衡状态的标志是( ) ①c(H2)=c(I2)=c(HI)时 ②c(H2):c(I2):c(HI)=1:1:2时 ③c(H2)、c(I2)、c(HI)不再随时间而改变 ④单位时间内生成nmolH2的同时生成2nmolHI ⑤单位时间内生成n mol H2的同时生成n mol I2 ⑥反应速v(H2)=v(I2)=1/2v(HI) ⑦一个H-H键断裂的同时有两个H-I键断裂 ⑧温度和体积一定时,容器内压强不再变化 ⑨温度和体积一定时,混合气体的颜色不再变化 ⑩温度和压强一定时,混合气体的密度不再变化⑪条件一定,混合气体的平均相对分子质量不再变化 A.③④⑦⑨⑩ B.③④⑦⑨ C.②③④⑦⑨ D.②③④⑥⑦⑨ 9.下列有关如图所示的说法正确的是 ( ) A.图甲中开关置于N处时铜锌合金腐蚀的速率增大 B.图乙中接通开关时,锌腐蚀的速率增大,锌上放出气体的速率增大 C.图丙中接通K2时铁棒不被腐蚀,属于牺牲阳极保护法 D.图丙中接通K1时,石墨棒周围溶液的pH增大 10.2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下: 饱和食盐水NaClO3NaClO4NaClO4NH4ClO4 下列说法错误的是( ) A.NH4ClO4属于离子化合物 B.溶解度:NaClO4>NH4ClO4 C.该流程中可循环利用的物质是NH4Cl D.高氯酸铵中氯元素的化合价为+7价 11.短周期五种主族元素A、B、C、D、E的原子序数依次增大。A、B、C的单质在常温下都呈气态,C原子最外层电子数是电子层数的3倍,C和E位于同主族。1 mol DAx与足量的A2C反应生成22.4 L(标准状况)A气体。下列选项中说法正确的是( ) A. A、B、C、D、E五种元素的简单离子半径大小关系为:A<C<B<D<E B. A和B可以组成既含有极性键又含有非极性键的共价化合物 C.B和D可以形成共价化合物 D.由A、C、D、E四种元素组成的盐溶于水,水溶液显碱性 12.高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜, 主要作用是在反应过程中只让 Li+通过。结构如图所示。原理如下:(1-x)LiFePO4+xFePO4+LixCnLiFePO4+nC。 下列说法不正确的是( ) A.放电时,正极电极反应式:xFePO4+xLi++xe-===xLiFePO4 B.放电时,电子由负极经导线、用电器、导线到正极 C.充电时,阴极电极反应式:xLi++xe-+nC===LixCn D.充电时,Li+向左移动 13.如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其它条件相同时,在Ⅰ、Ⅱ中分别加入2molX和2molY,开始时容器的体积均为VL,发生如下反应并达到平衡状态(提示:物质X、Y的状态均未知,物质Z的状态为气态):2X(?)+Y(?)⇌aZ(g)此时Ⅰ中X、Y、Z的物质的量之比为1:3:2。下列判断正确的是( ) A.物质Z的化学计量数a=2 B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态 C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ 14.下列根据实验操作和现象所得出的结论不正确的是( ) 选项 实验操作 实验现象 结论 A 向某溶液中加入盐酸酸化的BaCl2溶液 生成白色沉淀 该溶液中不一定含有SO42﹣ B 向FeCl2溶液中滴加KSCN溶液后再滴加氯水 滴加KSCN溶液无明显变化;再滴加氯水后溶液变红 氧化性:Cl2>Fe3+ C 取久置的Na2O2粉末,向其中滴加过量的盐酸 产生无色气体 Na2O2没有变质 D 将一片铝箔置于酒精灯外焰上灼烧 铝箔熔化但不滴落 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al 15.在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g)2SO3(g) △H<0的影响如图所示,下列说法正确的是( ) A.反应b、c点均为平衡点,a点未达平衡且向正反应方向进行 B.a、b、c三点中,a点时SO2的转化率最高 C.上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高 D.a、b、c三点的平衡常数Kb>Kc>Ka 16.将少量的a溶液加入到b溶液中,现象及对应的离子方程式正确的是 选项 a b 现象 离子方程式 A 稀硫酸 KI 在空气中放置一段时间后溶液呈棕黄色 4I-+ O2 + 2H2O = 2I2 + 4OH- B Na2CO3 稀盐酸 开始时无气泡,后来有气泡 CO32-+ H+ = HCO3-; HCO3-+ H+ = H2O + CO2↑ C 稀盐酸 Na2SiO3 产生白色胶状物 2H+ + SiO32-= H2SiO3(胶体) D 稀H2SO4 滴有酚酞的Ba(OH)2 有白色沉淀生成,溶液由红色变为无色 Ba2+ + OH-+ H+ + SO42- = BaSO4↓ + H2O 17.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确是( ) A.前8min A的平均反应速率为0.08mol/(L·s) B.30min时扩大容器的体积,40min时升高温度 C.反应方程式中的x=1,正反应为吸热反应 D.30min和54min的反应的平衡常数相等 18.我国科学家成功实现了电解气态HCl制备Cl2,其工作原理如图所示。下列说法错误的是( ) A.a为外接直流电源的负极 B.阳极的电极反应为2HCl - 2e- ═ Cl2 + 2H+ C.通电后H+从左室迁移至右室 D.左室中发生反应为4Fe2+ + O2 + 4H+ ═ 4Fe3+ + 2H2O, 实现了 Fe3+的再生 19.MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg): M2+(g)+CO32-(g) M2+(g)+O2−(g)+CO2(g) 已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是( ) A.ΔH1(MgCO3)>ΔH1(CaCO3)>0 B.对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3 C.ΔH2(MgCO3)=ΔH2(CaCO3)>0 D.ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO) 20.己知:CH4(g)+2H2S(g)CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示: 下列说法不正确的是 A.该反应的△H>O B.X 点CH4的转化率为20% C.X点与Y点容器内压强比为55:51 D.维持Z点温度,向容器中再充入CH4、H2S、CS2、H2 各0.1mol 时v(正)<v(逆) 二、综合题(21题10分,22-23每题14分,24题12分,共50分 21.以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下: (1)粉碎高硫铝土矿石的目的是 。 (2)第一次焙烧时发生氧化还原反应: . (3)碱浸时发生反应的化学方程式为 。 (4)过滤后向滤液中通入过量的CO2气体,反应的离子方程式为____ ; __。 (5)“过滤”得到的滤渣中含有大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)= 。 22.某同学在实验室进行铁盐与亚铁盐相互转化实验。 实验Ⅰ:将Fe3+转化为Fe2+ (1) Fe3+与Cu粉发生反应的离子方程式为 _________________________________。 (2)某学生用对比实验法探究白色沉淀产生的原因, 请填写实验方案: 实验方案 现象 结论 步骤1:取4mL①__________ mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 产生白色沉淀 CuSO4溶液与KSCN溶液反应产生了白色沉淀 步骤2:取4mL②__________mol/LFeSO4 溶液向其中滴加3滴0.1mol/LKSCN溶液 无明显现象 查阅资料: 已知①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2 Cu2+与SCN-反应的离子方程式为③___________________________________。 实验方案 现象 向3mL0.1mol/LFeSO4溶液中加入 3mL0.5mol/L稀硝酸 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 实验Ⅱ:将Fe2+转化为Fe3+ 探究上述现象出现的原因: 查阅资料:Fe2++NOFe(NO)2+(棕色) (3)用离子方程式解释NO产生的原因___________________________________。 (4)从化学反应速率与限度的角度对体系中存在的反应进行分析: 反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应 ①反应Ⅰ是一个不可逆反应,设计实验方案加以证明_____________________________。 ②请用化学平衡移动原理解释溶液由棕色变为黄色的原因_____________________________。 23.研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题: (1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下: ① SO2(g) + NH3•H2O(aq) =NH4HSO3(aq) △H1 = a kJ•mol-1; ② NH3•H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJ•mol-1; ③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJ•mol-1, 则反应 2SO2(g) + 4NH3•H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H = ______。 (2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)N2(g) + CO2(g) △H=-34.0 kJ•mol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示: ①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是 ; 在1100K 时,CO2的体积分数为______。 ②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________(已知:气体分压=气体总压×体积分数)。 (3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是_________(填字母标号)。 (4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)N2(g) + 2CO2(g) △H2 =-746.8 kJ•mol-1。实验测得,υ正=k正•c2(NO) •c2(CO) ,υ逆=k逆•c(N2) •c2(CO2) (k正、k逆为速率常数,只与温度有关)。 ①达到平衡后,仅升高温度,k正增大的倍数_____(填" >”、“< ”或“=”) k逆增大的倍数。 ②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则=_____(保留2位有效数字)。 24.《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下: (1)A的名称为________________;C的结构简式为_________________; (2)写出反应①的化学方程式_________________________________; (3)反应③的反应类型为__________________; (4)C通常有三种不同类别的芳香族同分异构体,试写出另两种不同类别的同分异构体的结构简式(各写一种)______________;_______________。 (5)反应 ________(填序号)原子的理论利用率为100%,符合绿色化学的。 (6)一种处理高浓度乙醛废水的方法——隔膜电解法,其原理如图所示,电解质溶液为一定浓度含乙醛的Na2SO4溶液,电解后乙醛在两个电极分別转化为乙醇和乙酸。写出阳极电极式:___________________________ 参考答案 一、单选题(1-10每题2分,11-20每题3分;共50分) 1.B 2.A 3.A 4.D 5.B 6.B 7.C 8.B 9.D 10.C 11.B 12.D 13.B 14.C 15.B 16.C 17.B 18.C 19.D 20.C 二、综合题(21题10分,22题14分,23题14分,24题12分) 21.(每空2分,共10分) (1) 增大接触面积,加快反应速率 (2)4FeS2+11O2=焙烧2_Fe2O3+8SO2 (3)Al2O3+2NaOH=2NaAlO2+H2O (4)OH-+CO2=HCO3-、AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ (5) 1:16 22.(每空2分,共14分) (1)2Fe3++Cu=2Fe2++Cu2+ (2) ①0.1 ②0.2 ③2Cu2++4SCN-=2CuSCN↓+(SCN)2 (3) 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O (4)①取少量反应Ⅰ的溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应Ⅰ是一个不可逆反应 ② Fe2+被硝酸氧化为Fe3+,溶液中Fe2+浓度降低,导致平衡Fe2++NOFe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色 23.(每空2分,共14分) (1)(2a+2b+c)kJ•mol-1 (2)①1050K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大. 20% ②4 (3)A (4) ① < ② 0.25 24.(共12分) (1)乙醛 (1分) (1分) (2) 2CH3CH2OH+O22CH3CHO+2H2O (2分) (3) 取代反应(或酯化反应) (1分) (4) (2分) (2分) (5) ② (1分) (6) CH3CHO-2e-+H2O=CH3COOH+2H+(2分)查看更多