- 2021-04-12 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学选修4人教版同步练习及测试题:第一章 第一节 化学反应与能量的变化(人教版)
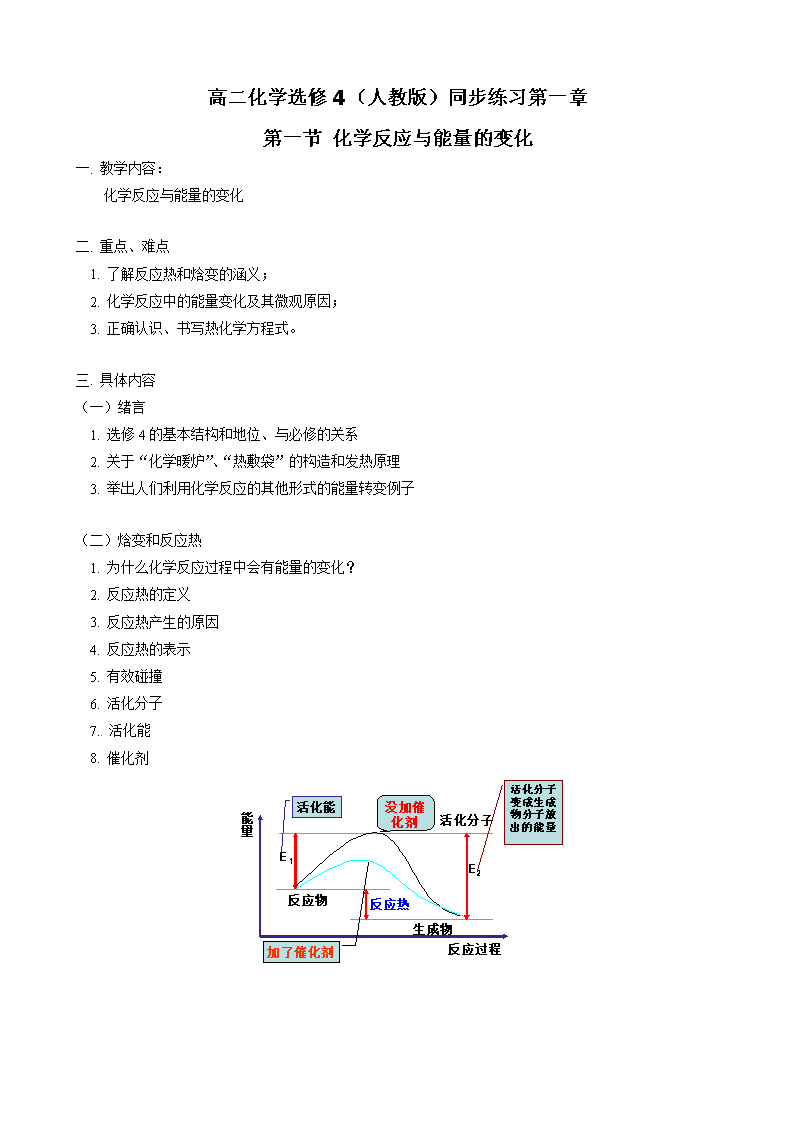
高二化学选修4(人教版)同步练习第一章 第一节 化学反应与能量的变化 一. 教学内容: 化学反应与能量的变化 二. 重点、难点 1. 了解反应热和焓变的涵义; 2. 化学反应中的能量变化及其微观原因; 3. 正确认识、书写热化学方程式。 三. 具体内容 (一)绪言 1. 选修4的基本结构和地位、与必修的关系 2. 关于“化学暖炉”、“热敷袋”的构造和发热原理 3. 举出人们利用化学反应的其他形式的能量转变例子 (二)焓变和反应热 1. 为什么化学反应过程中会有能量的变化? 2. 反应热的定义 3. 反应热产生的原因 4. 反应热的表示 5. 有效碰撞 6. 活化分子 7. 活化能 8. 催化剂 (三)热化学方程式 1. 定义 2. 表示意义 3. 与普通化学方程式的区别 4. 热化学方程式的书写应注意的问题 (四)实验:中和反应、反应热的测定 【典型例题】 [例1 ] 已知在25℃、101kPa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ的热量。表示上述反应的热化学方程式正确的是( ) A. C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g) △H=-48.40kJ·mol-1 B. C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) △H=-5518kJ·mol-1 C. C8H18(l)+25/2O2(g)=8CO2(g)+9H2O △H=+5518kJ·mol-1 D. C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) △H=-48.40kJ·mol-1 答案:B 解析:掌握书写热化学方程式的基本注意事项。 [例2] 0.3mol的气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态B2O3和液态水,放出649.5kJ的热量,其热化学方程式为________。 又知:H2O(l)=H2O(g) △H=+44kJ·mol-1,则11.2L (标准状况下)B2H6完全燃烧生成气态水时放出的热量是______kJ。 答案:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=-2165kJ·mol-1;1016.5。 解析:考察反应热的计算和两个热量变化过程的分析。 [例3 ] 已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出的热量为Q1。又知胆矾分解的热化学方程式为:CuSO4·5H2O(s)=CuSO4(s)+5H2O(l) △H=+Q2kJ·mol-1,则Q1和Q2的关系为( ) A. Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定 答案:A 解析:掌握含有结晶水的物质的特点。 [例4] 根据下表的数据,求H2(g)+Cl2(g)=2HCl(g)的反应热。 物质 H2 Cl2 HCl 键能/(kJ·mol-1) 436 243 431 答案:-183 kJ·mol-1 解析:掌握键能和反应热计算的关系。 [例5] 已知CH4(g)+2O2(g)== CO2(g)+2H2O(l);ΔH=-Q1kJ·mol-1, =2H2O(g);△H2=-Q2 kJ·, =2H2O(l);△H3=-Q3 kJ·。 常温下,取体积比4:1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为 。 答案:0.4Q1+0.05Q3 解析:根据物质的量和反应热的比例关系进行换算。 [例6] 实验中不能直接测出由石墨和氢气生成甲烷反应的反应热,但可测出CH4、石墨和H2的燃烧热。试求出石墨生成甲烷的反应热。 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.5kJ·mol-1; C(石墨)+O2(g)= CO2(g) △H2=-393.5kJ·mol-1 ; H2(g)+1/2O2(g)= H2O(l) △H3=-285.8kJ·mol-1。 求:C(石墨)+ 2H2(g)= CH4(g)△H4 答案:-74.6 kJ·mol-1 解析:学习根据间接的反应判断总反应的反应热。 [例7] 已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为: C(石墨,s)+O2(g)=CO2(g)△H=-393.51kJ·mol-1; C(金刚石,s)+O2(g)=CO2(g)△H=-395.41kJ·mol-1。 据此判断,下列说法正确的是( ) A. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 B. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高 C. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 D. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高 答案:A 解析:学会根据热化学方程式比较不同物质的转化和稳定性。 [例8] 下列各组热化学方程式中的△H,前者大于后者的是( ) ① C(s)+O2(g)=CO2(g) △H1;C(s)+1/2O2(g)=CO(g) △H2; ② S(s)+O2(g)=SO2(g) △H3;S(g)+O2(g)=SO2(g) △H4; ③ H2(g)+1/2O2(g)= H2O(l) △H5;2H2(g)+O2(g)= 2H2O(l) △H6; ④ CaCO3(s)=CaO(s)+CO2(g) △H7;CaO(s)+H2O=Ca(OH)2(s) △H8 A. ① B. ④ C. ②③④ D. ①②③ 答案:C 解析:考察对于△H的基本理解和比较。 【模拟试题】(答题时间:45分钟) 1. 下列反应不是放热反应的是( ) A. 生石灰与水反应 B. 木炭的燃烧反应 C. 盐酸和氢氧化钠的反应 D. 水蒸气液化 2. 下列说法正确的是( ) A. 需要加热才能发生的反应一定是吸热反应 B. 任何放热反应在常温条件下一定能发生反应 C. 反应物和生成物所具有的总能量决定了反应是放热还是吸热 D. 吸热反应在一定条件下(如常温、加热等)也能发生反应 3. 已知反应X+Y= M+N为放热反应,对该反应的下列说法中正确的( ) A. X的能量一定高于M B. Y的能量一定高于N C. X和Y的总能量一定高于M和N的总能量 D. 因该反应为放热反应,故不必加热就可发生 4. 今有如下三个热化学方程式: H2(g)+1/2O2(g)=H2O(g);ΔH=aKJ·mol-1, H2(g)+1/2O2(g)=H2O(l);ΔH== bkJ·mol-1, 2H2(g)+O2(g)=2H2O(l);ΔH== ckJ·mol-1, 关于它们的下列表述正确的是( ) A. 它们都是吸热反应 B. a、b和c均为正值 C. a== b D. 2b== c 5. 1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为 6. 下列说法正确的是( ) A. 活化分子碰撞即发生化学反应。 B. 某一反应的活化分子的百分数是个定值。 C. 升高温度会加快化学反应速率,原因是增加了活化分子的碰撞次数。 D. 活化分子间的碰撞不一定是有效碰撞。 7. 已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( ) A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2b kJ / mol B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH=2b kJ / mol C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-4b kJ / mol D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=b kJ / mol 8. 已知:; ; 欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为 A. 2:3.25 B. 12:3.25 C. 1:1 D. 393.5:241.8 9. 氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为: H2(g)+1/2O2(g)=H2O(l); △H=-285.8kJ/mol CO(g)+1/2O2(g)=CO2(g); △H=-283.0kJ/mol C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);△H=-5518kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(l); △H=-89.3kJ/mol 相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是( ) A. H2(g) B. CO(g) C. C8H18(l) D. CH4(g) 10. 已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( ) A. H2O(g)=2H 2(g)+O2(g) △H=+242kJ/mol B. 2H2(g)+O2(g)=2H2O(l) △H=-484kJ/mol C. H2(g)+1/2O2(g)=2H2O(g) △H=+242kJ/mol D. 2H2(g)+O2(g)=2H2O(g) △H=+484kJ/mol 11. 已知单质铁和硫粉反应时需用酒精灯加热反应方能发生,但在铁粉和硫粉开始化合后把酒精灯撤去,反应仍可进行完全。则此反应为____反应。(填“吸热”“放热”)原因是________。 12. 已知: (1)H2(g)+1/2O2(g)=H2O(g) △H1=akJ/mol (2)2H2(g)+O2(g)=2H2O(g) △H2=bkJ/mol (3)H2(g)+1/2O2(g)=H2O(l) △H3=ckJ/mol (4)2H2(g)+O2(g)=2H2O(l) △H4=dkJ/mol 下列关系式中正确的是( ) A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>0 【试题答案】 1. D 2. CD 3. C 4. D 5. C(S)+H2O(g)== CO(g)+H2(g) ΔH= +131.28 kJ· 6. D 7. C 8. B 9. D 10. A 11. 放热;反应开始后,不加热也可进行完全,说明此反应是放热反应,放出的热量足以维持反应继续进行。 12. C 【试题解析】 1. 考察吸热反应和放热反应都是化学变化。 2. 燃烧需要先加热至达到可燃物的着火点,但是放热反应;铁生锈的缓慢氧化是放热反应,但是在常温下进行;生成物的能量总和减去反应物的能量总和所得为反应热;吸热反应如氢氧化钡晶体和氯化铵在常温下进行,而碳和二氧化碳的吸热反应需要在高温的情况下进行。 3. 放热反应的本质是反应物的总能量大于生成物的总能量,所以放热。 4. 氢气的燃烧,均为放热反应,反应热为负值,而生成物状态不同,放出的热量不同,应该是等物质的量的氢气生成液态水放出的热量比生成气态水放出的热量多,因为气态水的能量高,而反应热和物质的量成正比,所以选择D。 5. 将1g碳换算成1mol碳计算其反应热的数值。 6. 活化分子发生有效碰撞才会发生化学变化;还要看条件,条件的改变,活化分子的数量也会改变;是增加了活化分子的有效碰撞。 7. 根据二氧化碳的物质的量,反应热与其成正比4倍,而乙炔燃烧是放热反应,所以为负值。 8. 由题意可列得方程 答案:B 9. 把反应热分别除所需可燃物的质量所得的值小的即为所得。 10. 根据生成水蒸气所以水为气体,则排除B,因为氢气燃烧是放热反应,所以氢气为反应物的反应热应为负值,所以选A,反向为正值。 12. 根据(1)和(2)所有物质的状态相同,物质的量为2倍关系,所以2a=b,而燃烧是放热反应,所以反应热为负值。查看更多