2018-2019学年安徽省合肥九中高二上学期期中考试化学试题(Word版)
合肥九中2018~2019学年第一学期高二期中考试
化学试题
满分:100分 时间:80分钟 命题:陈文静 审题:开庆梅
一、选择题(15题,每题3分,共45分)
1.页岩气是从页岩层中开采出来的天然气,是一种重要的非常规天然气资源。我国的页岩气储量超过其他任何一个国家,可采储量有1275万亿立方英尺。这些储量足够中国使用300多年,有关页岩气的叙述错误的是( )
A.页岩气属于清洁能源 B.页岩气属于一次能源
C.页岩气属于一种新能源 D.页岩气属于不可再生能源
2.下列物质分类组合正确的是( )
A
B
C
D
强电解质
CaCO3
FeCl3
H3PO4
NaOH
弱电解质
HF
CH3COOH
BaSO4
Na2S
非电解质
CCl4
Cu
H2O
C2H5OH
3.用pH试纸测定某无色溶液的pH时,规范操作是( )
A.将pH试纸放在溶液中观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥的的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D.在试管内放入少量溶液,把pH试纸放在试管口,观察颜色,跟标准比色卡比较
4.在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是( )
A. v(H2)=0.3 mol·L-1·min-1 B. v(N2)=0.05 mol·L-1·s-1
C. v(N2)=0.2 mol·L-1·min-1 D. v(NH3)=0.3 mol·L-1·min-1
5.在C(s)+CO2(g)=2CO(g)反应中,可使反应速率增大的措施是( )
①增大压强 ②增加炭的量 ③通入CO2 ④恒压下充入N2 ⑤恒容下充入N2 ⑥升温
A.①③④ B.③⑤⑥ C.②④⑥ D.①③⑥
6. 下列有关叙述正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热
ΔH=2×(-57.3) kJ·mol-1
B.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(g) ΔH<0且ΔS>0,能自发进行
D.浓硫酸的稀释和铝热反应均为放热反应
7.下列叙述中一定能判断某化学平衡发生移动的是( )
A. 平衡常数改变 B. 正、逆反应速率改变
C. 混合物中各组分的浓度改变 D. 混合体系的压强发生改变
8. 在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 80% B. 75% C. 50% D. 25%
9.反应mA(s)+nB(g) eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
A.到平衡后,加入催化剂则C%增大
B. 化学方程式中n
10 Vb B.Vb>10 Va C.Vb<10 Va D. Vb =10Va
二、填空题(4题,共55分)
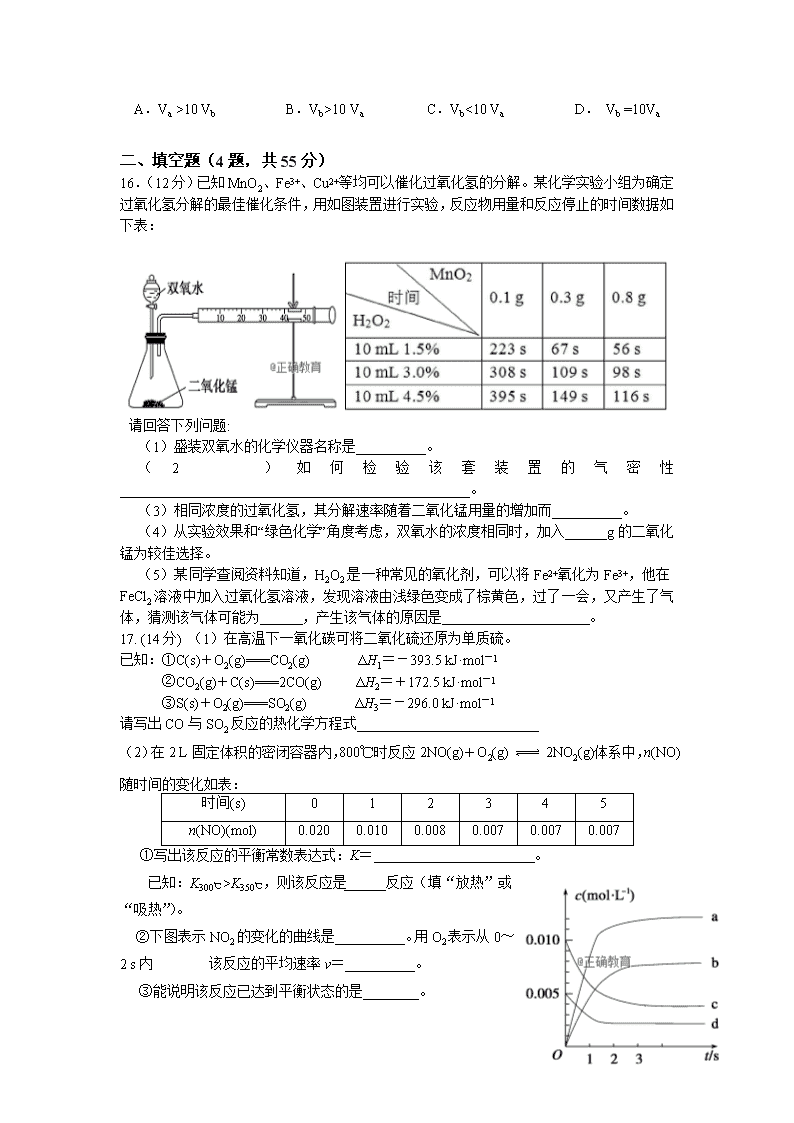
16.(12分)已知MnO2、Fe3+、Cu2+等均可以催化过氧化氢的分解。某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
请回答下列问题:
(1)盛装双氧水的化学仪器名称是__________。
(2)如何检验该套装置的气密性__________________________________________________。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而__________。
(4)从实验效果和“绿色化学”角度考虑,双氧水的浓度相同时,加入______g的二氧化锰为较佳选择。
(5)某同学查阅资料知道,H2O2是一种常见的氧化剂,可以将Fe2+氧化为Fe3+,他在FeCl2溶液中加入过氧化氢溶液,发现溶液由浅绿色变成了棕黄色,过了一会,又产生了气体,猜测该气体可能为 ,产生该气体的原因是 。
17. (14分) (1)在高温下一氧化碳可将二氧化硫还原为单质硫。
已知:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g) ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式__________________________
(2)在2 L固定体积的密闭容器内,800℃时反应2NO(g)+O2(g)
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s)
0
1
2
3
4
5
n(NO)(mol)
0.020
0.010
0.008
0.007
0.007
0.007
①写出该反应的平衡常数表达式:K=_______________________。
已知:K300℃>K350℃,则该反应是______反应(填“放热”或“吸热”)。
②下图表示NO2的变化的曲线是__________。用O2表示从0~2 s内 该反应的平均速率v=_____ ___。
③能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
④为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
18.(11分)用0.2000 mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000 mol/L的标准NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“ 0”或“0”刻度线稍下,并记下读数;④量取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴甲基橙溶液;⑤用标准液滴定至终点,记下滴定管液面读数。⑥重复以上滴定操作2-3次。请回答:
(1)以上步骤有错误的是(填编号)________
(2)步骤④中,量取20.00 mL待测液应使用________ (填仪器名称)
(3)步骤⑤滴定时眼睛应注视____________ ;判断到达滴定终点的依据是:________ 。
(4)以下是实验数据记录表
滴定
次数
盐酸体积
(mL)
NaOH溶液体积读数(mL)
滴定前
滴定后
1
20.00
0.00
18.10
2
20.00
0.00
16.20
3
20.00
0.00
16.16
从表中可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是
A. 锥形瓶装液前,留有少量蒸馏水 B. 滴定结束时,仰视计数
C.滴定前滴定管尖嘴无气泡,滴定结束有气泡 D.锥形瓶用待测液润洗
E. NaOH标准液保存时间过长,有部分变质
(5)根据表中记录数据,通过计算可得,该盐酸浓度为: ____________mol/L
19(18分).醋酸和碳酸都是常见的酸。
(1)碳酸的电离方程式为__________________________________________________。
(2)向0.1 mol·L-1 CH3COOH溶液中加水稀释,c(CH3COO-) / c(CH3COOH)的比值将________(填“变大”、“不变”或“变小”)。
(3)下列事实一定能说明CH3COOH是弱电解质的是____________(填字母)。
A. 相同温度下,浓度均为1 mol·L-1的盐酸和醋酸的导电性对比:盐酸>醋酸
B. 1 mol·L-1 CH3COOH溶液能使紫色石蕊试液变红
C. 25℃时,1 mol·L-1 CH3COOH溶液的pH约为2
D. 10 mL 1mol·L-1的CH3COOH溶液恰好与10 mL 1mol·L-1 NaOH溶液完全反应
(4)在25 mL氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示。
①该氢氧化钠溶液的物质的量浓度为________mol·L-1
②在B点,a________12.5 mL(填“大于”、“小于”或“等于”)。醋酸和NaOH恰好完全反应后溶液呈 (填“酸”或“碱”)性,原因是
(用离子方程式表示),此时溶液中各离子浓度大小为 。
③A、B、C、D几点中,水的电离程度最大的是 。
合肥九中2018~2019学年第一学期高二期中考试
化学参考答案
一、选择题(每题3分,共45分)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
C
A
C
B
D
B
A
B
C
D
B
D
C
D
B
二、填空题(共55分)
16.(12分)(1)分液漏斗
(2)关闭分液漏斗的活塞,将注射器的活栓向外拉出一段距离,若一段时间后活栓能够恢复到原位置,则装置的气密性好。
(3)加快 (4)0.3 (5)O2 生成的Fe3+催化了过氧化氢的分解
17(14分)每空2分
(1)2CO(g)+SO2(g)===S(s)+2CO2(g) ΔH=-270 kJ·mol-1
(2) ① 放热
②b 1.5×10-3 mol·L-1·s-1 ③ bc ④ c
18.(11分) (1) ① (2)酸式滴定管(1分)
(3)锥形瓶内颜色变化 当滴入最后一滴时,溶液由红色变橙色,且半分钟内颜色不变
(4)B D (5)0.1618
19(18分)每空2分
(1)略(写出第一步即得分) (2)变大 (3)AC
(4) ①0.1
②大于 碱
CH3COO-+H2O CH3COOH+OH-
c(Na+) > c(CH3COO-) > c(OH-) > c(H+)
③ B