- 2021-04-12 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
西藏拉萨市拉萨中学2019-2020学年高二下学期第六次月考化学试卷
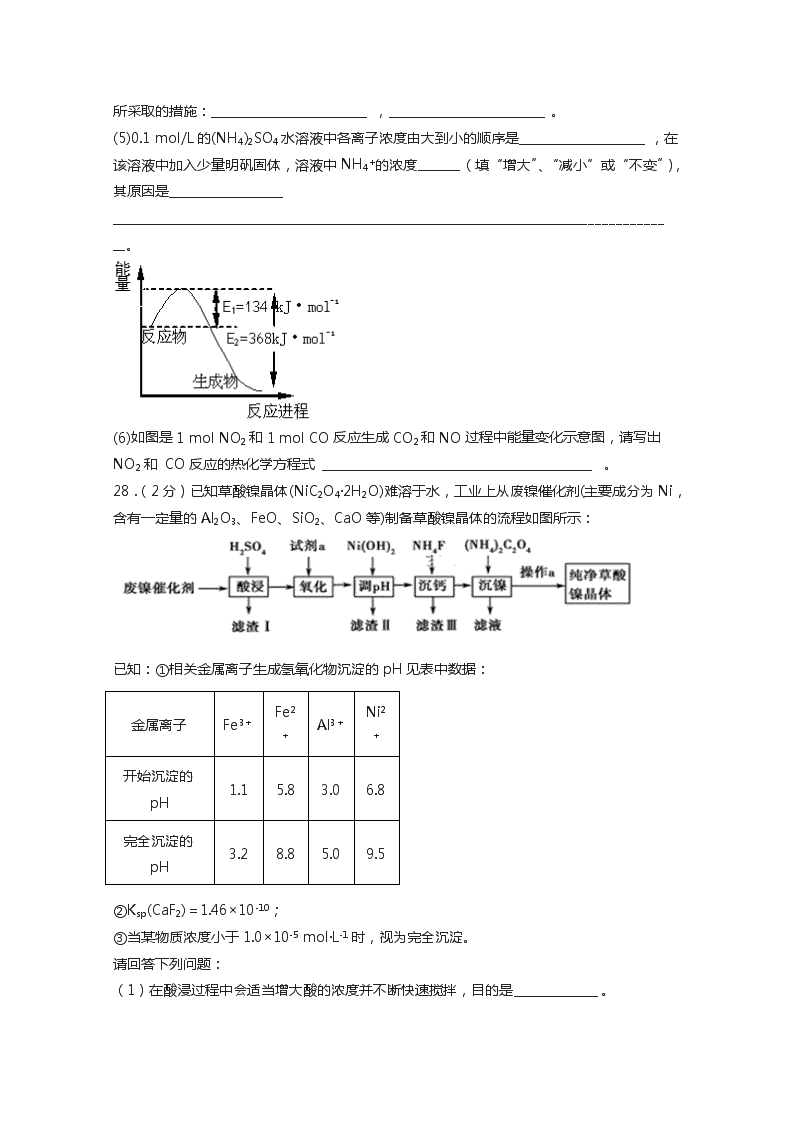
西藏自治区拉萨市拉萨中学2019-2020学年高二第六次月考理综化学试卷 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Fe 56 I 127 Ag 108 K 39 Cr 52 Ba 137 Cu 64 Br 80 Zn 65 一、单选题(每题6分,) 7.化学与社会、生产、生活密切相关。下列做法值得提倡的是( ) A.小苏打用作净水剂 B.“地沟油”加工为生物燃料 C.饮高度酒预防新冠肺炎 D.漂粉精作食品漂白剂 8.下列说法正确的是 A.氯气有氧化性,可使干燥布条漂白褪色 B.常温下,铁、铝不与浓硫酸反应,因此可用铁、铝容器贮存运输浓硫酸 C.已知电离能力H2CO3>HClO>HCO3-,则向氯水中加入碳酸氢钠晶体,能提高溶液中HClO的浓度 D.向BaCl2溶液中通入SO2可产生白色浑浊 9.异丁烯()是重要的化工原料,主要用于制备丁基橡胶、聚异丁烯塑料等。下列关于异丁烯的说法错误的是( ) A.异丁烯与HCl在一定条件下能发生加成反应且只能得到一种加成产物 B.异丁烯在一定条件下可以和氢气发生加成反应,加成产物的二氯代物有3种 C.异丁烯发生加聚反应生成聚异丁烯 D.异丁烯和环丁烷()互为同分异构体 10.设NA为阿伏加德罗常数值。下列有关叙述正确的是( ) A.1molN2与3molH2反应生成的NH3分子数为2NA B.14g乙烯(C2H4)和丙烯(C3H6)混合气体中的原子总数为3NA C.1molFe溶于过量硝酸,电子转移数为2NA D.标准状况下,2.24LCCl4含有的共价键数为0.4NA 11.如图为乙酸丁酯制备的实验装置,下列说法正确的是 A.玻璃导管的主要作用是平衡试管内外压强 B.该装置适用于乙酸乙酯的制备 C.加入过量乙酸可以提高丁醇的转化率 D.分离提纯乙酸丁酯的方法是将混合物直接分液 12.某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是 A.应该甲烷燃料电池的总反应:CH4+2O2=CO2+2H2O B.正极的电极反应是:O2+2H2O+4e-=4OH- C. a极是负极,发生氧化反应 D.甲烷燃料电池是环保电池 13.Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是 A.Y的原子半径比X的大 B.Q的最高价氧化物的水化物的酸性比Z的强 C.X、Y和氢3种元素形成的化合物中都只有共价键 D.Q的单质具有半导体的性质,Q与Z可形成化合物QZ4 27.(20分)氮及其化合物在工农业生产、生活中有着重要作用。完成下列填空: 合成氨工业中:N2(g) + 3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如表: t/℃ 200 300 400 K K1 K2 0.5 (1)试比较K1、K2的大小,K1 ________K2(填写“>”、“=”或“<”) (2) 400℃时,反应2NH3(g) N2(g) + 3H2(g)的化学平衡常数的值为_____________。 当测得NH3和N2、H2的物质的量浓度分别为3 mol/L和2 mol/L、1 mol/L时,则该反应υ(N2)(正) ___________υ(N2)(逆)(填写“>”、“=”或“<”) (3)在密闭恒容的容器中,下列能作为合成氨反应达到平衡的依据的是____________。 a.υ(N2)(正)=3υ (H2)(逆) b.混合气体的密度保持不变 c.容器内压强保持不变 d.N2、H2、NH3的浓度之比为1∶3∶2 (4)化工生产为做到又“快”又“多”采用多种方法,试写出两项合成氨工业中为实现“多” 所采取的措施:__________________________,__________________________。 (5)0.1 mol/L的(NH4)2SO4水溶液中各离子浓度由大到小的顺序是_____________________,在该溶液中加入少量明矾固体,溶液中NH4+的浓度_______(填“增大”、“减小”或“不变”),其原因是___________________ ____________________________________________________________________________________________。 (6)如图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式 _____________________________________________。 28.(2分)已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示: 已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据: 金属离子 Fe3+ Fe2+ Al3+ Ni2+ 开始沉淀的pH 1.1 5.8 3.0 6.8 完全沉淀的pH 3.2 8.8 5.0 9.5 ②Ksp(CaF2)=1.46×10-10; ③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。 请回答下列问题: (1)在酸浸过程中会适当增大酸的浓度并不断快速搅拌,目的是______________。 (2)写出“沉镍”时发生反应的离子方程式:______________________________,当Ca2+沉淀完全时,溶液中 c(F-)> ________mol·L-1(写出计算式即可)。 (3)试剂a是一种绿色氧化剂,写出“氧化”时反应的化学反应方程式:___________________________。 (4)操作a的内容包括过滤,洗涤,干燥。请用简洁语言描述洗涤的方法是________________________。 (5)“调pH”时pH的调控范围为______≤PH<6.8。 29.(14分)溴苯是一种常见的化工原料。查阅资料知:苯和液溴在溴化铁(FeBr3)存在的条件下可发生反应生成溴苯,此反应为放热反应。实验室合成溴苯的装置示意图及有关数据如下。先向A中加入16.0mL的无水苯和5.0mL液溴,再将混合液慢慢滴入反应器B中。请回答下列问题: 苯 溴 溴苯 相对分子质量 78 160 157 颜色状态 无色液体 深红棕色液体 无色液体 密度/g·cm-3 0.88 3.10 1.50 沸点/℃ 80 59 156 水中的溶解性 难溶 微溶 难溶 (1)仪器A的名称为____。 (2)反应器B中发生的主要有机反应的化学方程式是___。 (3)下列关于该实验操作或叙述错误的是___(填字母序号)。 a.向反应器B中滴加苯和溴的混合液前需先关闭K b.实验中装置C中的液体逐渐变为浅红色 c.实验中装置D中的导管口附近有白雾产生,溶液中产生淡黄色的沉淀,根据该现象说明苯和液溴发生的反应为加成反应 d.装置D中的导管不能插入液面以下和装置E中导管末端连接倒扣着的漏斗都是为了防倒吸 e.溴苯不能与AgNO3溶液反应产生淡黄色沉淀 (4)实验完毕待冷却后,经过下列步骤对溴苯进行分离提纯: ①向B中加入10mL水,然后过滤除去未反应的铁屑; ②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。用NaOH溶液洗涤的作用是___; ③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。 (5)经过上述分离操作后,粗溴苯中还含有的主要杂质为__,要进一步提纯,下列操作中必须的是___。 a.萃取 b.蒸馏 c.重结晶 d.过滤 e.分液 (6)若经过上述分离提纯的操作,经进一步精制得到6.2mL的溴苯,则该实验中溴苯的产率是___(计算结果保留三位有效数字)。 30.(12分)已知有机物A、B、C、D、E、F、G有如下转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为C9H10O2,试回答下列有关问题: (1)指出下列反应的反应类型:C转化为D: 。 (2)写出A中官能团的名称: 。 (3)写出下列反应的化学方程式: D生成E的化学方程式: ; E与银氨溶液反应的化学方程式 ; B和F生成G的化学方程式: 。 (4)写出符合下列条件的G的同分异构体的结构简式: 。 ①能与FeCl3发生显色反应 ②能与新制的银氨溶液反应产生光亮的银镜 ③核磁共振氢谱显示有四种不同化学环境氢 化学参考答案 1.B 2.C 3.A 4.B 5.C 6.A 7.D 8.> 2 > c 采用20MPa~50MPa高压 及时将产物液化除去 c(NH4+)> c(SO42-)> c(H+)> c(OH-) 增大 NH4+ 水解呈酸性,Al3+水解也呈酸性,两者相互抑制,c(NH4+)增大 NO2(g)+CO(g)=CO2(g)+NO(g)△H= -234kJ/mol 9.提高“酸浸”速率 Ni2++C2O42-+2H2O= 2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O 过滤结束后,沿玻璃棒往漏斗中注水至淹没沉淀待水自然流下,重复操作2-3次 5.0 10.分液漏斗 +Br2+HBr ac 除去溶解在溴苯中没有反应完的溴 苯 b 61.1% 11. 加成反应 氯原子 2CH3CH2OH+O22CH3CHO+2H2O CH3CHO+2Ag(NH3)2OH→CH3COONH4+3NH3+2Ag+H2O CH3COOH++H2O 、 查看更多