四川省仁寿第一中学北校区2019-2020学年高二6月月考(期中)理综-化学试题
7.下列有关说法正确的是( )
A.医用酒精和84消毒液(NaClO溶液)混合使用能增强它们的消毒效果
B.气溶胶被认为可以传播新冠病毒,它是气体分散质分散到液体分散剂中的一种胶体
C.“熔喷布”可用于制作口罩,生产“熔喷布”的主要原料是聚丙烯,它属于混合物
D.疫情期间可以多吃富含纤维素的食物,它们在人体内都可以通过水解反应提供能量
8.下列相关离子方程式书写正确的是( )
A.泡沫灭火器工作原理:2A13++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
B..Fe(OH)3溶于HI溶液:Fe(OH)3+3H+=Fe3++3H2O
C. 往Ba(OH)2溶液中滴加KHSO4溶液至溶液呈中性: Ba2++OH-+H++SO42-=BaSO4+H2O
D.酸性高锰酸钾溶液与草酸溶液混合:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
9.短周期主族元素X、Y、Z、W的原子序数依次增加。A、B、C、D均是由这些元素组成的二元化合物,甲是Y的固体单质,常温下0.05 mol/L乙溶液的pH为1。A是无色气体,是主要的大气污染物之一,上述物质的转化关系如图所示。下列说法错误的是( )
A.原子半径:X
Y
D.化合物YZW中键角为120°
10.下列关于有机物的说法错误的是( )
A.植物油分子结构中含有碳碳双键
B.现有乙烯、丙烯的混合气体共14 g,其原子数为3NA
C.同温同压下,等质量的乙炔和苯完全燃烧耗氧量相同
D.分子式为C5H10O2与碳酸氢钠溶液反应产生气体的有机物有3种
11.以NA表示阿伏加德罗常数的值,下列说法错误的是( )
A.18g冰(图1)中含O—H键数目为2NA
B.28g晶体硅(图2)中含有Si—Si键数目为2NA
C.44g干冰(图3)中含有NA个晶胞结构单元
D.石墨烯(图4)是碳原子单层片状新材料,12g石墨烯中含C—C键数目为1.5NA
12.某华人科学家和他的团队研发出“纸电池”.这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是 ( )
A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH-
D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023
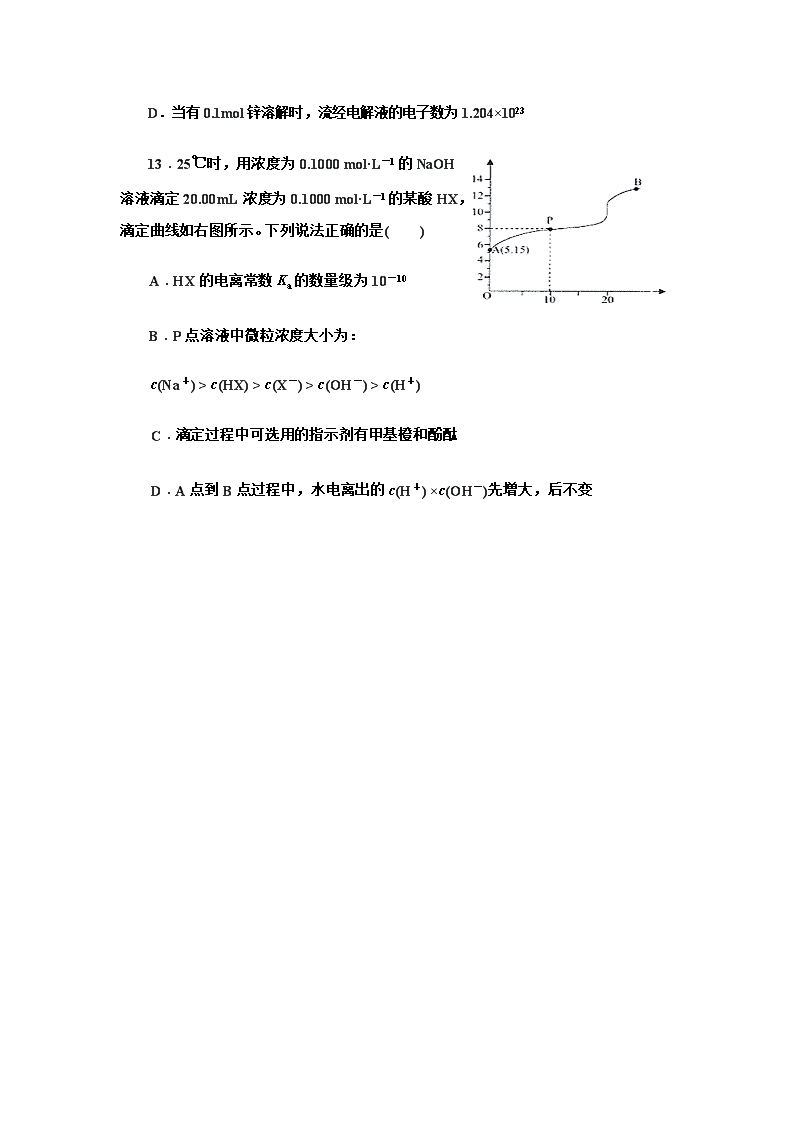
13.25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00mL浓度为0.1000 mol·L-1的某酸HX,滴定曲线如右图所示。下列说法正确的是( )
A.HX的电离常数Ka的数量级为10-10
B.P点溶液中微粒浓度大小为:
c(Na+) > c(HX) > c(X-) > c(OH-) > c(H+)
C.滴定过程中可选用的指示剂有甲基橙和酚酞
D.A点到B点过程中,水电离出的c(H+) ×c(OH-)先增大,后不变
(16分)
(1)基态氧原子的价层电子排布式不能表示为,因为这违背了 原理或规则。
(2)基态Cu原子核外电子排布式为 ,则高温下的稳定性CuO Cu2O(填“>”或“<”)
(3)在尿素CO(NH2)2中C、N的杂化方式分别为 OF2的空间构型是
(4)在Fe(NO3)3溶液中加入Na2SO3,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。又变为棕黄色的原因是 (用离子方程式表示)。
(5)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,写出氨硼烷的结构式 ,并写出一种与氨硼烷互为等电子体的分子_______(填化学式)。
28.(14分)
某无色溶液X,由Na+、Mg2+、Ba2+、Al3+、AlO、MnO4—、CO32—、SO42—中的若干种离子组成,取溶液进行如下连续实验:
(1)气体A的成分是_______(填电子式),气体B的成分是_______(填结构式)
(2)X溶液中一定不存在的离子是______________。
(3)写出步骤①
中发生反应的所有离子方程式: 。
(4)写出步骤②中形成白色沉淀的离子方程式: 。
(5)通过上述实验,溶液X中不能确定是否存在的离子是______________;只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是 。
29.(14分)
为了测定实验室长期存放的Na2SO3固体的纯度,准确称取Wg固体样品,配成250mL溶液。设计了以下两种实验方案:
方案Ⅰ:取25.00mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1g。
方案Ⅱ:取25.00mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2g。
(1)配制250mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、天平、药匙、____________、 。
(2)写出Na2SO3固体氧化变质的化学方程式 。
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是 ,在过滤前,需要检验是否沉淀完全,其操作是 。
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果 (填“偏高”或“偏低”)。
(5)若操作正确,结果为m1<m2,试分析原因是 。
(6)取25.00mL上述溶液,用cmol/L酸性KMnO4溶液滴定测定Na2SO3
的纯度,已知酸性条件下,KMnO4通常被还原为Mn2+滴定达到终点时的现象为 。
30.(14分)
某化学实验小组以电镀废渣(Cr2O3、CuO、Fe2O3及CaO)为原料制取铜粉和K2Cr2O7。主要流程如下:
(1)加入适量Na2S溶液后生成的沉淀X为 ,若加入的Na2S溶液过量,除生成X外还会发生反应的离子方程式为 。
(2)请配平[Cu(NH3)4]SO4·H2O加热发生分解反应的化学方程式:
[Cu(NH3)4]SO4·H2O Cu + NH3↑ + SO2↑ + N2↑ + H2O
(3)“沉 CuNH4 SO3 ”时可用如下图装置(夹持、加热仪器略):
①“沉 CuNH4SO3 ”时,反应温度需控制在 45℃,合适的加热方式是 。
②NaOH溶液的作用是 。
(4)测定产品中 K2Cr2O7含量的方法如下:称取产品试样 2.0 g 配成 250 mL 溶液,取出25.00 mL 于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用 0.1000
mol/L 硫酸亚铁铵(NH4)2 Fe(SO4 )2标准液进行滴定,重复进行三次实验。(已知Cr2O被还原为Cr 3+ )
①若三次实验消耗(NH4 )2 Fe(SO4)2 标准液的平均体积为20.00 mL,则所得产品K2Cr2 O7的纯度为 %。
②上述流程中K2Cr2O7发生反应后所得溶液中除含有 Cr 3+ ,还含有一定浓度的Fe3+,可通过调pH的方法使两者转化为沉淀。假设两种离子初始浓度均为2×10-3 mo/L,当溶液中刚开始析出Cr(OH)3沉淀时,c(Fe3+)= mo/L。{已知:Ksp [Fe(OH)3 ]=4.0×10 -38 ,Ksp [Cr(OH)3 ]=6.0×10 -31 }
7 C 8 D 9 D 10 D 11 C 12 C 13 A
27(16分每空2分)(1)洪特
(2)[Ar]3d104s1或1s22s22p63s23p63d104s1 , <
(3)sp2、sp3 V形 (4)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(5)第一空答案在QQ群上 C2H6
28(14分每空2分)
(1)CO2(电子式) NH3(结构式)(自己写不好打得)(2)Mg2+、Ba2+、Al3+、MnO4-
(3)CO32—+2H+=H2O+CO2↑ AlO2—+4H+=Al3++2H2O
(4)Al3++3HCO3—=Al(OH)3↓+3CO2↑ (5)SO42—
在沉淀乙中加入足量盐酸,若白色沉淀能完全溶解,则X中不存在SO42—;若不完全溶解,则X中存在SO42—
29(14分,除标注外每空2分)(1)胶头滴管 (1分) 250 mL容量瓶 (1分)
(2)2Na2SO3+O2===2Na2SO4 (3)使SO32-充分转化为气体
静置,在上层清液中再滴入氯化钡溶液,观察是否继续有沉淀生成
(4) 偏高
(5) 方案Ⅱ中盐酸提供的H+与Ba(NO3)2提供的NO3-形成稀HNO3,
将一部分SO32-氧化成SO42-,导致BaSO4质量增大
(6)当滴加最后一滴标准液时,溶液由无色刚好变为浅红色,且半分钟不褪色
30(共14分每空2分)
(1)CuS , 2Fe3++3S2-=2FeS↓+S↓或2Fe3++S2-=2Fe2++S↓
(2)3,3,8,3,2,9
(3)① 水浴加热 ② 吸收SO2防止污染空气
(4)①49 ②1.3×10 -10