化学卷·2018届江西省上饶市玉山一中高二上学期期中考试(2016
一、选择题(本题包括15个小题,没小题只有一个选项正确,每小题3分,共45分)
1. 上海世博会提出了“低碳、和谐、可持续发展城市”三大主题。下列做法不符合这一要求的是
A.大量使用LED节能路灯
B.燃烧一些含碳量少的物质来供能
C.将煤液化、气化,提高燃料的燃烧效率
D.进一步推广使用太阳能等一系光伏产品供能
2. 符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在△H=△H1+△H2满足上述条件的X、Y可能是
①C、CO②S、SO2③Na、Na2O④AlCl3、Al(OH)3⑤Fe、Fe(NO3)2⑥NaOH、Na2CO3.
A.①④⑤ B.①②③ C.①③④ D.①③④⑤⑥
3. 已知:①101KPa时,2C(s)+O2(g)=2CO(g) △H=-221KJ/mol
②稀溶液,H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol
下列结论正确的是
A.碳的燃烧热的能量变化可用图1-3表示
B.反应①的反应热为221kJ/mol
C.98%的浓硫酸与稀NaOH溶液发生反应生成1mol水的中和热为△H =-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
4. 用纯净的CaCO3与100ml稀盐酸反应制取CO2,实验过程记录如图1-4所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是
A.OE段表示的平均速率最快
B.EF段,用盐酸表示该反应的平均反应速率为0.04mol/(L•min)
C.OE、EF、FG三段中,该反应用CO2表示的平均反应速率之比为2:6:7
D.F点表示收集的CO2的量最多
5. 已知反应:①PCl5(g) PCl3(g)+Cl2(g)
②2HI(g) H2(g)+I2(g)
③2NO2(g)N2O4(g)
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各反应的温度和容器的压强都不变,分别再加入一定量的各自的反应物,重新达到平衡时,反应物的转化率
A.均不变 B.①增大,②不变,③减小
C.均增大 D.①减少,②不变,③增大
6. 硫碘循环分解水制氢主要涉及下列反应:
①SO2+2H2O+I2=H2SO4+2HI
②2HI H2↑+I2
③2H2SO4=2SO2+O2↑+2H2O
则通过分析上述反应,下列判断正确的是
A.反应③易在常温下进行
B.反应①中H2SO4分子的氧化性比I2弱
C.循环过程中需补充的是I2
D.循环过程中产生1molO2的同时产生1 molH2
7. N2O5是一种新型硝化剂,在一定温度下能发生反应:2N2O5(g)4NO2(g)+ O2(g) △H >0, 在其他条件不变时,该反应在T温度下,N2O5浓度(mol/L)随时间的变化如下:
t/s
0
500
1000
1500
c(N2O5)
5.00
3.52
2.50
2.50
则下列说法不正确的是
A.T温度下该反应的平衡常数为K=125
B.500s内N2O5分解速率为2.96×10-3 mol/(L·s)
C.T温度下的平衡常数为K,若T1温度下的平衡常数为K1,且K>K1,则T>T1
D.其他条件不变时,T1温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T
c(H+)>c(OH-)
D.这两次滴定都可以用酚酞作指示剂
12. 酸式盐NaHX的水溶液中,下列有关叙述正确的是
A.若H2X在水溶液中只存在HX-H++X2-,则NaHX的溶液中的离子关系为:c(X2-)+c(OH-)=c(H+)+c(H2X)
B.若NaHX溶液呈酸性:则有c(Na+)>c(HX-)> c(X2-)> c(H+)> c(OH-)
C.若NaHX溶液呈碱性:则有c(Na+)=2c(X2-)+ c(HX-)+ c(H2X)
D.若NaHX溶液呈碱性:则一定有c(H+)- c(OH-)= c(X2-)- c(H2X)
13. 化学平衡常数(K)、电离常数(Ka)、浓度积常数(KSP)是判断物质性质或变化的重要的常数。下列关于这些常数的说法中,正确的是
A.化学平衡常数的大小与温度、浓度、压强、催化剂有关
B.CH3COONH4溶液几乎呈中性,说明Ka(CH3COOH)与Kb(NH3·H2O)近似相等
C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-=AgI(s)+Cl-能够发生
D.Ka(HCN)<Ka(CH3COOH),说明相同浓度时,氢氰酸的酸性比醋酸强
14. 已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,测得放出热量a KJ,已知碳的燃烧热为b KJ/mol,则热化学方程式:C(s)+1/2O2(g)=CO(g)△H=ω中ω等于
A.-(a-b)kJ·mol―1 B.-(a+b)kJ·mol―1
C.-(5a-0.5b)kJ·mol―1 D.-(10a-b)kJ·mol―1
15. 下表是四种难溶电解质的浓度积常数
化学式
FeS
Fe(OH)3
CuS
ZnS
浓度积常数
6.3×10-18
4.0×10-38
6.3×10-36
1.3×10-24
下列有关说法正确的是
A.25℃的Fe(OH)3溶解度小于CuS的溶解度
B.25℃时,饱和ZnS溶液中,Zn2+的浓度约为1.3×10-24mol/L
C.除去含Fe2+溶液中的Cu2+,可以选择FeS作沉淀剂
D.由于H2SO4为强酸,因此Cu2++H2S= CuS↓+2H+
第Ⅱ卷 非选择题(共55分)
16.(10分)Na2S2O3·5H2O是照相业常用的一种定影剂,也是分析化学常用的一种还原剂。
(1)分析上常用已知浓度的碘水滴定Na2S2O3溶液,测定溶液中Na2S2O3的物质的量浓度。现有下列仪器及用品:酸式滴定管、碱式滴定管、滴定管架(带夹)、锥形瓶,2%的淀粉溶液。已知:I2+2Na2S2O3=2NaI+Na2S4O6
①用 (填酸式或碱式)滴定管准确量取25.00mL碘水于锥形瓶中,再迅速加入约1mL2%的淀粉溶液于锥形瓶中;往锥形瓶中逐渐滴加Na2S2O3溶液,当Na2S2O3溶液用去20.00mL时恰好到达滴定终点。
②上述滴定操作过程中不要剧烈摇动锥形瓶内的溶液,最好用带有玻璃塞的锥形瓶。其目的是 。
③已知碘水的物质的量浓度为0.0400mol·L-1,则c(Na2S2O3)= mol·L-1(保留3倍小数)。
(2)工业上制备的Na2S2O3·5H2O晶体中常含有NaCl、Na2SO3、Na2SO4杂质,其中Na2SO3甚少。为了测定工业制品中Na2S2O3·5H2O的质量分数,称取四份质量不等的样品,分别加入相同浓度的稀H2SO4溶液各50.00mL,充分反应后滤出沉淀硫,洗涤、干燥并称量。实验记录如下(不考虑Na2S2O3所消耗的H2SO4):
[已知:Na2S2O3·5H2O摩尔质量为:248g·mol-1 Na2S2O3+H2SO4= Na2SO4+SO2↑+S↓+H2O]
第一份
第二份
第三份
第四份
样品的质量/g
6.50
13.0
26.0
32.5
硫的质量/g
0.80
1.60
3.20
3.20
①所用稀H2SO4的物质的量浓度为:c(H2SO4)= mol·L-1
②工业制品中Na2S2O3·5H2O的质量分数为:W(Na2S2O3·5H2O)= 。
17.(16分)化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g)△H﹥0 (I)
反应(I)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1molI2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
(2)如图所示,反应(I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。
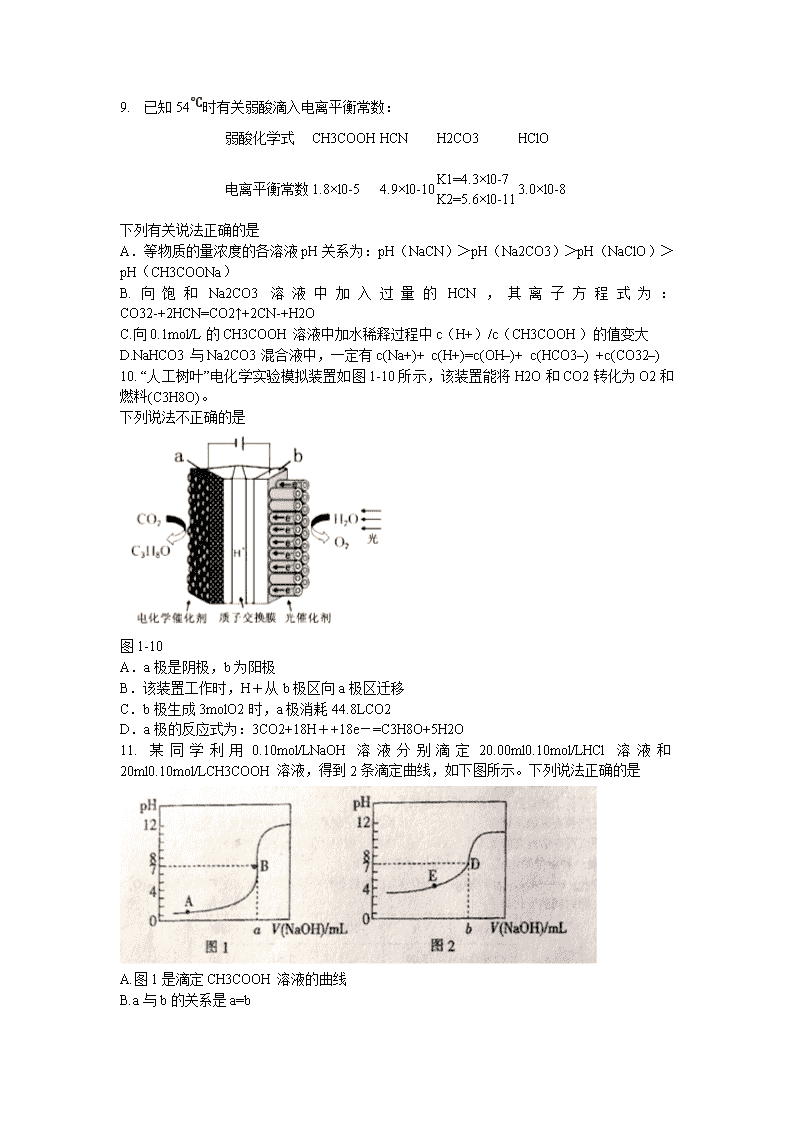
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为 。
(4)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中将 (填“增大”“减小”或“不变”)。
20.(12分)已知-氨热化学循环分解水的示意图如下:
(1)从反应物和生成物的角度来看反应I属于____________(填序号)。
a.离子反应 b.化合反应 c.中和反应 d.氧化还原反应
(2)反应II是将太阳能转化为电能,再进行电解,电解池阳极的反应式是______________。
(3)反应IV是由(a)、(b)两步反应组成:
H2SO4(l)=SO3(g)+H2O(g) △H=+177kJ·mol﹣1…(a)
2SO3(g) 2SO2(g)+O2(g) △H=+196kJ·mol﹣1…(b)
H2O(l)=H2O(g) △H=+44kJ·mol﹣1…(c)
则H2SO4(l)分解为SO2(g)、O2(g)及H2O(l)的热化学方程式为:________________________。
(4)某硫酸厂用活性炭还原法处理SO2尾气。其反应原理如下
2C (s)+2SO2(g)S2(g)+2CO2(g) 。
在恒温恒容的容器中测得反应进行到不同时间时各物质的浓度如图所
①0~20min反应速率表示为V(SO2)= ;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是 ;40min时,该反应的平衡常数为____。
③已知碳的气化反应在不同温度下的平衡常数的对数值(lgK)如下表:
lgK
CO(g)+H2O(g)CO2(g)+H2(g)
700K
900K
1200K
-2.64
-0.39
1.58
则反应:CO(g)+H2O(g)CO2(g)+H2(g),该反应的△H 0(选填:“>”、“<”、“=”)
1-15BACBD BDACC DDBCC
16. (每空2分,共10分)⑴①酸式 ②减少 I-、S2O32-等被空气中的氧气氧化 ③0.100
⑵①2.00 ②0.954 或 95.4%
17. (每空2分,共16分)
(1)66.7%
(2)<,I2
(3)淀粉溶液,H2SO3+I2+H2O=4H++SO42-+2I-
(4)1.0×10-12,增大
20. (共14分,每空2分)
(1)ab
(2)SO32-+H2O-2e-=SO42-+2H+
(3)2H2SO4(I) 2SO2(g)+O2(g)+2H2O(I) △H=+462KJ/mol
(4)①0.03mol/(L·min)
②减小CO2的浓度;0.675
③<