四川省棠湖中学2020届高三下学期第一次在线月考化学试题
7.化学与生产、生活及环境密切相关,下列有关说法不正确的是
A.二氧化硫有毒,严禁将其添加到任何食品和饮料中
B.工业生产时加入适宜的催化剂,除了可以加快反应速率之外,还可以降低反应所需的温度,从而减少能耗
C.《本草经集注》中记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,这是利用了“焰色反应”
D.用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的
8.已知NA从阿伏加德罗常数的值,下列说法正确的是
A.6g 3He含有的中子数为2NA
B.1mol CH3CH2OH被氧化为CH3CHO转移的电子数为NA
C.20g正丁烷和38g异丁烷的混合物中非极性键数目为10NA
D.0.1mol·L-1Na2SO4溶液中含有的SO42-数目为0.1NA
9.山梨酸是应用广泛的食品防腐剂,其分子结构如图所示。下列说法错误的是
A.山梨酸的分子式为C6H8O2
B.1 mol山梨酸最多可与2 mol Br2发生加成反应
C.山梨酸既能使稀KMnO4酸性溶液褪色,也能与醇发生置换反应
D.山梨酸分子中所有碳原子可能共平面
10.在下列各溶液中,一定能大量共存的离子组是
A.有色透明溶液中:Fe2+、Ba2+、[Fe(CN)6]3-、NO3-
B.强酸性溶液中:Cu2+、K+、ClO-、SO42-
C.含有大量AlO2-的溶液中:K+、Na+、HCO3-、I-
D.常温下水电离的c(H+)为1×10-12mol/L的溶液中:K+、Na+、Cl-、NO3-
11.X、Y、Z、W为四种短周期主族元素,X与Z同族,Y与Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6。下列说法正确的是
A.Y的最高价氧化物对应的水化物是二元强酸
B.原子半径:X
c(Na+)>c(CH3COO-)
C.c点溶液中:c(OH-)=c(CH3COOH)+ c(H+)
D.d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)
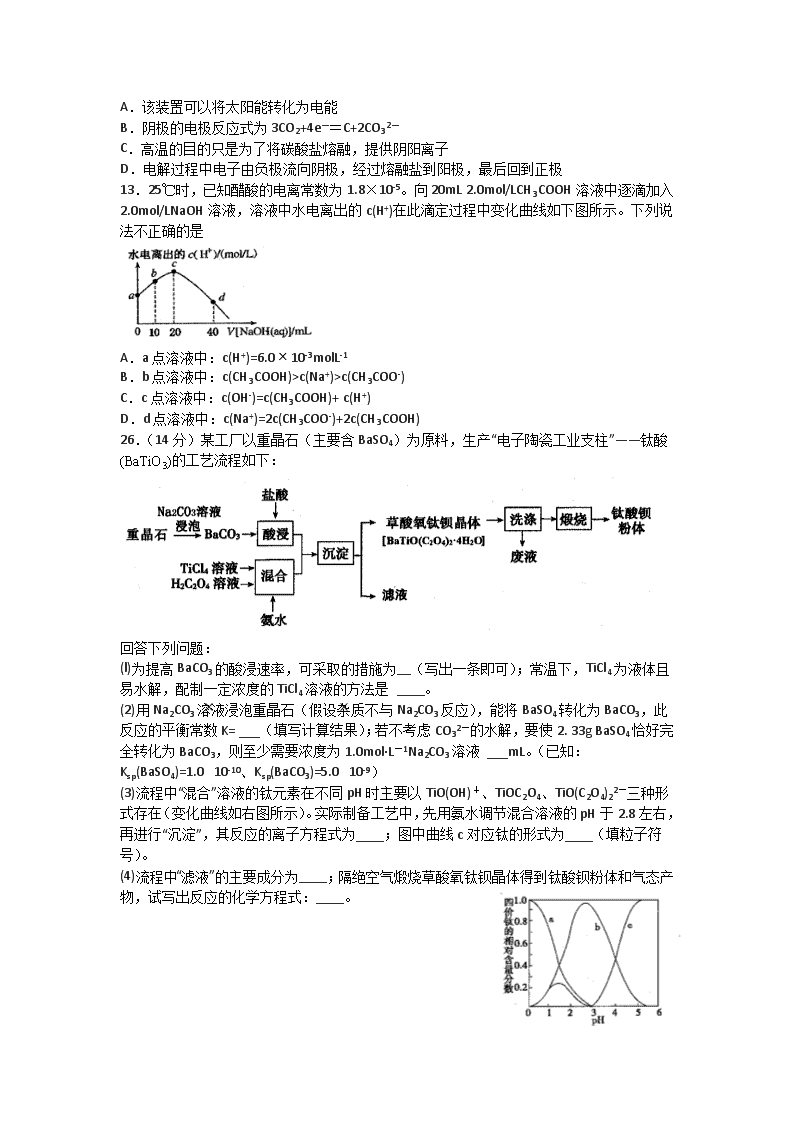
26.(14分)某工厂以重晶石(主要含BaSO4)为原料,生产“电子陶瓷工业支柱”——钛酸(BaTiO3)的工艺流程如下:
回答下列问题:
(l)为提高BaCO3的酸浸速率,可采取的措施为__(写出一条即可);常温下,TiCl4为液体且易水解,配制一定浓度的TiCl4溶液的方法是 ____。
(2)用Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K= ___(填写计算结果);若不考虑CO32-的水解,要使2. 33g BaSO4恰好完全转化为BaCO3,则至少需要浓度为1.0mol·L-1Na2CO3溶液 ___mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)
(3)流程中“混合”溶液的钛元素在不同pH时主要以TiO(OH)+、TiOC2O4、TiO(C2O4)22-三种形式存在(变化曲线如右图所示)。实际制备工艺中,先用氨水调节混合溶液的pH于2.8左右,再进行“沉淀”,其反应的离子方程式为____;图中曲线c对应钛的形式为____(填粒子符号)。
(4)流程中“滤液”的主要成分为____;隔绝空气煅烧草酸氧钛钡晶体得到钛酸钡粉体和气态产物,试写出反应的化学方程式:____。
27.(15分)工业上“固定”和利用CO2能有效地减轻“温室效应”。
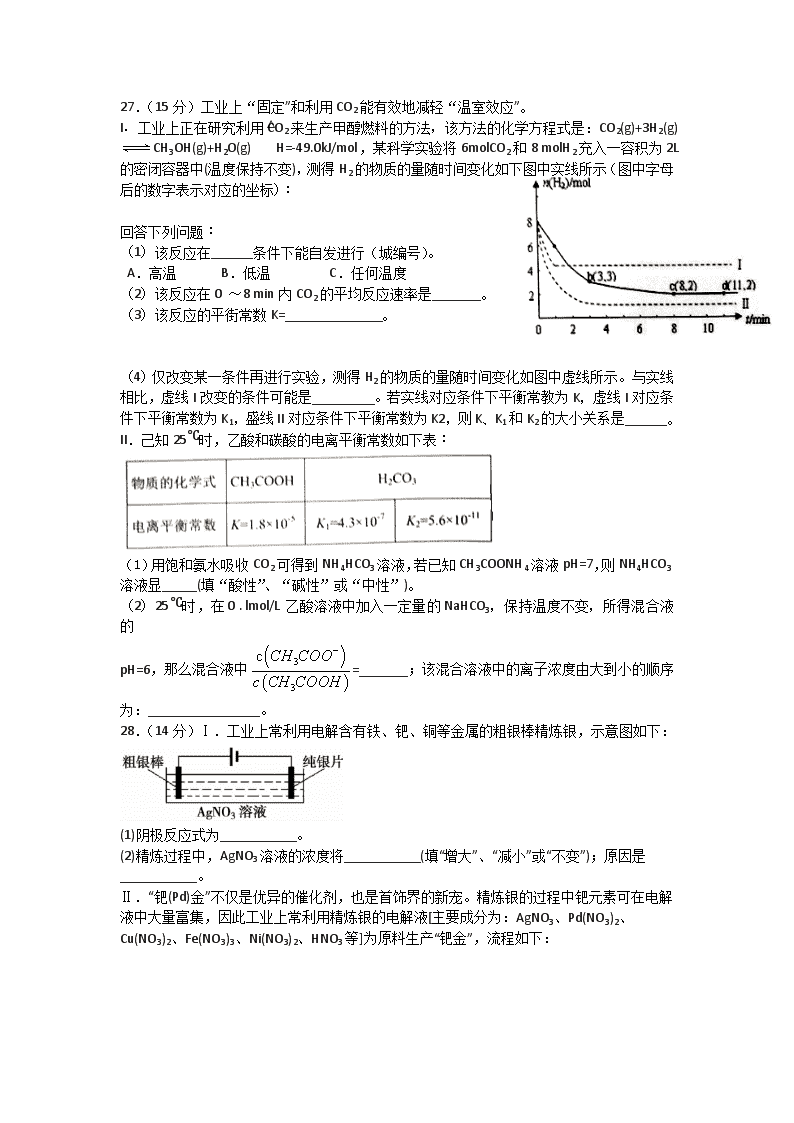
I.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol,某科学实验将6molCO2和8 molH2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标):
回答下列问题:
(1)该反应在______条件下能自发进行(城编号)。
A.高温 B.低温 C.任何温度
(2)该反应在0 ~8 min内CO2的平均反应速率是_______。
(3)该反应的平街常数K=______________。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,虚线I改变的条件可能是_________。若实线对应条件下平衡常教为K,虚线I对应条件下平衡常数为K1,盛线II对应条件下平衡常数为K2,则K、K1和K2的大小关系是______。
II.己知25℃时,乙酸和碳酸的电离平衡常数如下表:
(1)用饱和氨水吸收CO2可得到NH4HCO3溶液,若已知CH3COONH4溶液pH=7,则NH4HCO3溶液显_____(填“酸性”、“碱性”或“中性”)。
(2)25℃时,在0 . lmol/L乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的
pH=6,那么混合液中=_______;该混合溶液中的离子浓度由大到小的顺序为:________________。
28.(14分)Ⅰ.工业上常利用电解含有铁、钯、铜等金属的粗银棒精炼银,示意图如下:
(1)阴极反应式为___________。
(2)精炼过程中,AgNO3溶液的浓度将___________(填“增大”、“减小”或“不变”);原因是___________。
Ⅱ.“钯(Pd)金”不仅是优异的催化剂,也是首饰界的新宠。精炼银的过程中钯元素可在电解液中大量富集,因此工业上常利用精炼银的电解液[主要成分为:AgNO3、Pd(NO3)2、Cu(NO3)2、Fe(NO3)3、Ni(NO3)2、HNO3等]为原料生产“钯金”,流程如下:
(3)定量实验检测表明,当滤液1中c(Ni2+)=2×10-3mol·L-1时,Pd2+仍没有开始沉淀,计算此时溶液中c(Fe3+)=___________,(Ksp[Ni(OH)2]=2.0×10-15、Ksp[Fe(OH)3]=4.0×10-38)。
(4)“氧化”过程中氧化剂与还原剂的物质的量之比为___________。
(5)为保证产品的纯净,“沉淀”过程中所得滤渣需要洗涤,简述检验滤渣是否洗净的实验方法___________。
(6)写出“还原”步骤中发生反应的离子方程式:___________。
35.(15分)新型储氢材料是氢能的重要研究方向。
(1)化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。A在一定条件下通过多步去氢可最终转化为氮化硼(BN)。
①基态O原子的电子占据了___________个能层,最高能级有___________种运动状态不同的电子。
②CH4、H2O、CO2分子键角从大到小的顺序是___________。生成物H3BNH3中是否存在配位键___________(填“是”或“否”)。
(2)掺杂T基催化剂的NaAlH4是其中一种具有较好吸、放氢性能的可逆储氢材料。NaAlH4由Na+和AlH4-构成,与AlH4-互为等电子体的分子有____(任写一个),Al原子的杂化轨道类型是____。Na、Al、H元素的电负性由大到小的顺序为_____。
(3)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在中国已实现了产业化。该合金的晶胞结构如图所示。
①该晶体的化学式为___________。
②已知该晶胞的摩尔质量为Mg/mol,密度为dg/cm3。设NA为阿伏加徳罗常数的值,则该晶胞的体积是___________cm3(用含M、d、NA的代数式表示)。
③已知晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较温定,晶胞参数分别为apm、apm、cpm。标准状况下氢气的密度为Mg/cm3;若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为___________。(用相关字母表示已知储氢能力= )。
36.(15分)对甲氧基肉桂酸异辛酯是目前世界上最常用的防晒剂之一,具有极高的紫外光吸收率,安全性良好,毒性极小,因此广泛应用于日用化工、塑料、橡胶和涂料等领域。其合成路线如下:
回答下列问题:
(1)C的化学名称是___________。E中的两种含氧官能团的名称___________、___________。
(2) B为单卤代烃,请写出合成线路中①的反应方程式___________。
(3)写出由C生成D和由D生成E的反应类型___________、___________。
(4)写出合成甲基肉桂酸异辛酯所需的F的结构简式___________。
(5)X与F互同分异构体。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为6:2:1。写出符合上述条件的X的结构简式___________。
(6)巴豆酸乙酯存在于苹果、木瓜、草莓、可可等中,在引发剂的作用下可以生成聚巴豆酸乙酯。请运用所学知识,结合上述合成过程,请写出以乙烯和丙二酸为原料合成聚巴豆酸乙酯的合成路线(无机试剂可任选)。_______________________________________________
化学参考答案
7.A 8.A 9.C 10.D 11.D 12.B 13.B
26.将BaCO3研成粉末或适当增大盐酸浓度或适当加热或搅拌等 溶于浓盐酸,再加适量水稀释至所需浓度 0.02 510 TiO(C2O4)22-+Ba2++4H2O=BaTiO(C2O4)2·4H2O↓ TiO(OH)+ NH4Cl BaTiO(C2O4)2·4H2OBaTiO3+2CO↑+2CO2↑+4H2O
27. B 0.125mol/(L·min) 0.5(L/mol)2 升温 K=K2>K1 碱性 18 c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
28.Ag++e-= Ag 减小 阳极参与失电子的金属除了银还有比银活泼的金属,例如铁,但阴极得电子的却只有Ag+,所以AgNO3浓度减小 4.0×10-20mol·L-1 1∶1 用一支洁净的小试管,取最后清洗液1~2mL,向其中滴入过量的稀硝酸酸化,之后滴加几滴AgNO3溶液,若出现白色沉淀,说明没有洗干净,反之则洗涤干净 (NH4)2PdCl6+2HCOOH=Pd↓+2CO2↑+2NH4++6Cl-+4H+
35.2 4 CO2>CH4>H20 是 CH4 sp3 H>Al>Na LaNi5 M/NAd 61030/(NAa2csin60M)
36. 对甲基苯酚 醛基 醚键 取代反应 氧化反应