- 2021-02-27 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
湖南省长沙市长沙县第六中学2020届高三上学期月考化学试卷
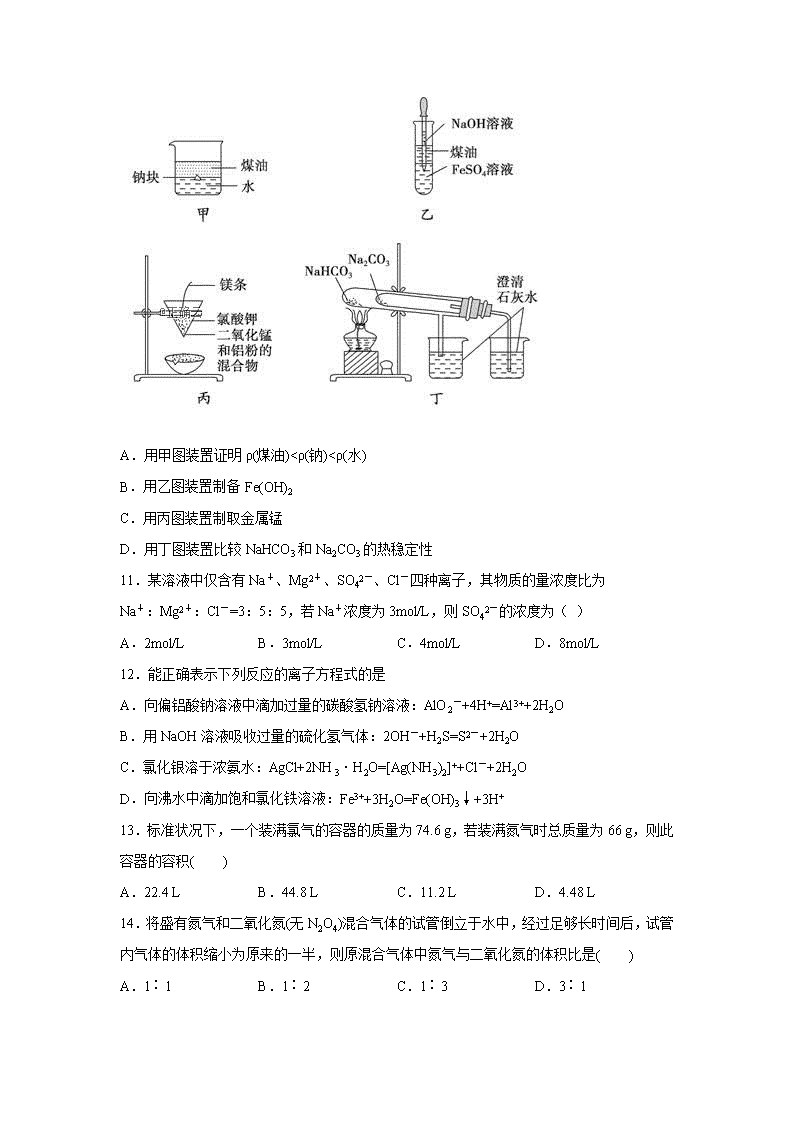
化学试题 考试范围:物质分类及其变化;考试时间:90分钟 注意事项: 1.答题前在答题卡上填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上 3 . 可能所需的相对原子质量:H-1,O-16,N-14,S-32,Cl-35.5,Al-27,Cu-64 第I卷(选择题) 一、单选题(48分) 1.下列说法正确的是( ) A.明矾净水过程中不涉及化学变化 B.由同种元素组成的物质一定是纯净物 C.风化、石油分馏和碘的升华都是物理变化 D.为除去蛋白质溶液中少量的NaCl,可以利用渗析的方法 2.雾霾、PM2.5已经成为公众耳熟能详的热词。“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物,也称为可入肺颗粒物。下列有关说法中,错误的是( ) A.雾霾有可能产生丁达尔效应 B.雾霾的形成与工业排放的烟气和汽车尾气有关系 C.“PM2.5”分散在大气中形成气溶胶,性质稳定,没有必要纳入空气质量评价指标 D.雾霾天气严重危害人体健康 3.已知氨气极易溶于水,而难溶于有机溶剂CCl4.下列装置中不适宜做氨气的尾气吸收的是( ) A. B. C. D. 4.已知阿伏加德罗常数为NA,下列说法正确的是( ) A.2mol水中含有NA个H2O分子 B.1g氢气含有NA个H2分子 C.2mol钠与过量稀盐酸反应生成NA个H2分子 D.16g氧气中含有NA个氧分子 5.下列说法中正确的是 A.某无色溶液中可能含有下列离子:H+、Cl-、Na+、Fe2+ B.能使石蕊变红的溶液中可能含有Cl-、K+、Na+、NO3- C.取少量某溶液,向其中加入盐酸酸化的BaCl2 溶液,通过观察是否有白色沉淀生成,可证明该溶液中是否含有SO42- D.H++OH-=H2O可描述所有酸碱中和反应的实质 6.下列各组物质间的反应,既属于氧化还原反应,又属于离子反应的是( ) A.锌与稀硫酸 B.盐酸与硝酸银溶液 C.氢气在氯气中燃烧 D.氧化钠溶于水 7.在酸性溶液中,能大量共存的离子组是 A.、、、 B.、、、 C.、、、 D.、、、 8.将5.4 g Al投入到200 mL 2.0 mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余,该溶液可能为( ) A.NaOH溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液 9.下列实验及检验方法合理的是 选项 实验 检验方法 A 向NaOH溶液中滴加饱和FeCl3溶液制备胶体 用可见光束照射 B 确认铜与浓硫酸反应生成CuSO4 将水加入到反应后溶液中 C 区分AgNO3溶液和Al2(SO4)3溶液 分别取少量溶液,滴加BaCl2溶液 D 证明氯水中起漂白作用的不是Cl2 用CCl4充分萃取,将红纸条分别浸入分层后的溶液中 A.A B.B C.C D.D 10.用下列装置不能达到有关实验目的的是 A.用甲图装置证明ρ(煤油)<ρ(钠)<ρ(水) B.用乙图装置制备Fe(OH)2 C.用丙图装置制取金属锰 D.用丁图装置比较NaHCO3和Na2CO3的热稳定性 11.某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子,其物质的量浓度比为 Na+:Mg2+:Cl-=3:5:5,若Na+浓度为3mol/L,则SO42-的浓度为( ) A.2mol/L B.3mol/L C.4mol/L D.8mol/L 12.能正确表示下列反应的离子方程式的是 A.向偏铝酸钠溶液中滴加过量的碳酸氢钠溶液:AlO2-+4H+=Al3++2H2O B.用NaOH溶液吸收过量的硫化氢气体:2OH-+H2S=S2-+2H2O C.氯化银溶于浓氨水:AgCl+2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O D.向沸水中滴加饱和氯化铁溶液:Fe3++3H2O=Fe(OH)3↓+3H+ 13.标准状况下,一个装满氯气的容器的质量为74.6 g,若装满氮气时总质量为66 g,则此容器的容积( ) A.22.4 L B.44.8 L C.11.2 L D.4.48 L 14.将盛有氮气和二氧化氮(无N2O4)混合气体的试管倒立于水中,经过足够长时间后,试管内气体的体积缩小为原来的一半,则原混合气体中氮气与二氧化氮的体积比是( ) A.1∶1 B.1∶2 C.1∶3 D.3∶1 15.某溶液中含有SO42-、SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是 ①反应前后,溶液中离子浓度基本保持不变的有SO42-、Na+;②有胶状物质生成;③有气体产生;④溶液颜色发生变化; ⑤共发生了2个氧化还原反应。 A. ②③④ B.①②③ C.①③⑤ D.②④⑤ 16.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法正确的是 A.该硫酸的物质的量浓度为9.2mol·L-1 B.该硫酸与等体积的水混合所得溶液的质量分数小于49% C.配制200mL4.6mol·L-1的稀硫酸需取该硫酸50.0mL D.该硫酸50.0mL与足量的铜反应可得到标准状况下SO2气体10.304L 第II卷(非选择题) 二、填空题(52分) 17.离子反应是中学化学中重要的反应类型。回答下列问题: (1)在发生离子反应的反应物或生成物中,一定存在________。 ①单质 ②氧化物 ③电解质 ④盐 ⑤化合物 (2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系_________________。 (3)离子方程式是中学生应熟练掌握的化学用语,请写出下列反应的离子方程式: 向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,反应的离子方程式为_________________________在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为_______________________。 18. 由几种离子化合物组成的混合物,含有以下离子中的若干种: K+、NH4+、Mg2+、Cu2+、Ba2+、C1-、SO42-、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验: 实验序号 实验内容 实验结果 a 加AgNO3溶液 有白色沉淀生成 b 加足量NaOH溶液并加热 收集到气体1.12L(已折算成标准 状况下的体积) c 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 第一次称量读数为6. 27g,第二次 称量读数为2.33g 试回答下列问题: (1)该混合物中一定不存在的离子是__________________________。 (2)溶液中一定存在的阴离子是____________________。 (3)试写出实验b发生反应的离子方程式____________________________________。 (4)判断混合物中是否存在K+?__________________(填“是”或“否”)。 19.已知有4种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复: Ba2+、H+、Na+、NH、CO、NO、OH-、SO,将这4种溶液分别标记为A、B、C、D并进行如下实验: ①在A或D中滴入C,均有沉淀生成;②A和B反应生成的气体能被D吸收; ③A和D反应生成的气体能被B吸收。 试回答下列问题: (1)A的化学式是________。 (2)写出其他几种物质的化学式:B________、C________、D________。 (3)写出实验③中有关反应的离子方程式________、__________。 20.测我国了“神舟”系列载人飞船的成功发射,标志着“炎黄子孙千年飞天梦想实现了” (1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是_____(填写编号)。 A.在高温下不融化 B.在高温下可分解气化 C.在常温下就分解气化 D.该涂料不可能发生分解 (2)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是: N2O4+ N2H4→ N2+ H2O 。请配平该反应方程式: ————N2O4+————N2H4→————N2+————H2O 这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是_______。 (3)为了向宇航员提供氧气,飞船上有专门的供氧装置。现有供氧剂过氧化钠与超氧化钾(KO2)。 ①写出它们与二氧化碳反应的化学方程式(超氧化钾与二氧化碳的反应产物与过氧化钠类似): ____________________;_________________________。 ②你选择的供氧剂是:_______________。 21.节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。 (1)他们设计如下实验装置,请你参与探究,并回答问题: ①装置A1中发生反应的化学方程式为 ; ②装置B用于检验SO2的漂白性,其中所盛试剂为 ,装置D用于检验SO2的 性质; ③装置C中反应的离子方程式为 ; ④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写一点即可) ; (2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体、实验在标准状况下测定)。 你认为哪个装置可行(填序号) ,使用你所选用的装置测定SO2含量时,还需要测定的物理量是 ;查看更多