- 2021-02-27 发布 |
- 37.5 KB |
- 21页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届高考二轮复习苏教版第21讲物质的检验与定量分析课件(21张)
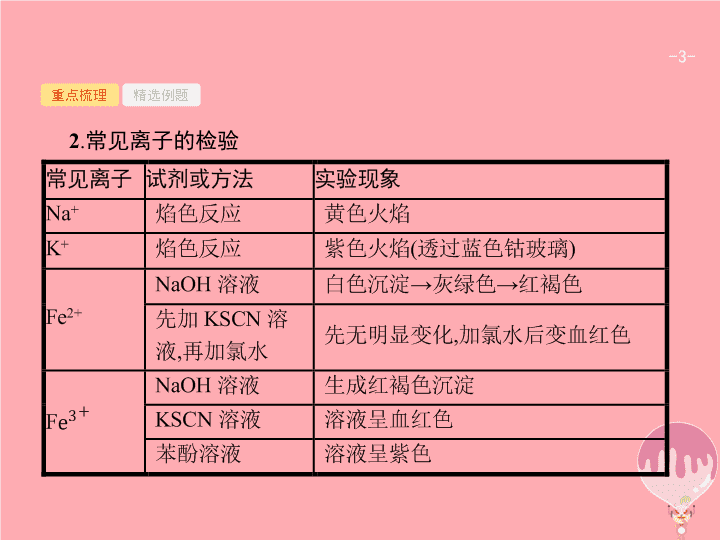
第 21 讲 物质的检验与定量分析 - 2 - 重点梳理 精选例题 考点一 物质的检验 1 . 物质的检验方法 物质的检验通常有鉴定、鉴别和推断三类 , 它们的共同点是 : 依据物质的特殊性质和特征反应 , 选择适当的试剂和方法 , 准确观察反应现象 , 如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等 , 通过现象进行判断、推理。 - 3 - 重点梳理 精选例题 2 . 常见离子的检验 - 4 - 重点梳理 精选例题 - 5 - 重点梳理 精选例题 - 6 - 重点梳理 精选例题 3 . 常见气体的检验 - 7 - 重点梳理 精选例题 - 8 - 重点梳理 精选例题 4 . 牙膏和火柴头成分检验 - 9 - 重点梳理 精选例题 5 . 多角度鉴别 NaNO 2 和 NaCl 溶液 - 10 - 重点梳理 精选例题 (2017·11· 浙江选考 ) 下列方法 ( 必要时可加热 ) 不合理的是 ( ) A. 用澄清石灰水鉴别 CO 和 CO 2 B. 用水鉴别苯和四氯化碳 C. 用氢氧化钡溶液鉴别 NH 4 Cl 、 (NH 4 ) 2 SO 4 和 K 2 SO 4 D. 用淀粉碘化钾试纸鉴别碘水和溴水 答案 解析 解析 关闭 A.CO 不能使澄清石灰水变浑浊 ,CO 2 可以使澄清石灰水变浑浊 ;B. 苯的密度比水小 , 在上层 , 四氯化碳的密度比水大 , 在下层 ;C. 氢氧化钡与 NH 4 Cl 混合产生有刺激性气味的气体 , 与 (NH 4 ) 2 SO 4 反应产生白色沉淀硫酸钡 , 同时产生有刺激性气味的气体 , 与 K 2 SO 4 反应只产生白色沉淀 , 故可鉴别 ;D. 碘水中有碘单质 , 溴水可以氧化淀粉碘化钾试纸中的碘离子变为碘单质 , 都可以使淀粉碘化钾试纸变蓝 , 故无法鉴别 , 选 D 。 答案 解析 关闭 D - 11 - 重点梳理 精选例题 跟踪训练 1 . 某白色粉末由两种物质组成 , 为鉴别其成分进行如下实验 : ① 取少量样品加入足量水仍有部分固体未溶解 ; 再加入足量稀盐酸 , 有气泡产生 , 固体全部溶解 ; ② 取少量样品加入足量稀硫酸有气泡产生 , 振荡后仍有固体存在。 该白色粉末可能为 ( ) A.NaHCO 3 、 Al(OH) 3 B.AgCl 、 NaHCO 3 C.Na 2 SO 3 、 BaCO 3 D.Na 2 CO 3 、 CuSO 4 答案 解析 解析 关闭 NaHCO 3 、 Al(OH) 3 中加入足量稀硫酸有气泡产生 , 无固体存在 ,A 项错误。 AgCl 不溶于盐酸 , ①中固体不能全部溶解 ,B 项错误。 BaCO 3 不溶于水 , 加入稀盐酸 , 固体全部溶解 ; 再将样品加入足量稀硫酸 , 稀硫酸和 BaCO 3 反应生成 BaSO 4 沉淀 ,C 项正确。 Na 2 CO 3 、 CuSO 4 中加入足量稀硫酸 , 振荡后无固体存在 ,D 项错误。 答案 解析 关闭 C - 12 - 重点梳理 精选例题 2 . 下列设计的实验方案能达到实验目的的是 ( ) A. 制备 Al(OH) 3 悬浊液 : 向 1 mol·L -1 AlCl 3 溶液中加过量的 6 mol·L -1 NaOH 溶液 B. 提纯含有少量乙酸的乙酸乙酯 : 向含有少量乙酸的乙酸乙酯中加入适量饱和 NaOH 溶液 , 振荡后静置分液 , 并除去有机相的水 C. 检验溶液中是否含有 Fe 2+ : 取少量待检验溶液 , 向其中加入少量新制氯水 , 再滴加 KSCN 溶液 , 观察实验现象 D. 探究催化剂对 H 2 O 2 分解速率的影响 : 在相同条件下 , 向一支试管中加入 2 mL 5% H 2 O 2 溶液和 1 mL H 2 O, 向另一支试管中加入 2 mL 5% H 2 O 2 溶液和 1 mL FeCl 3 溶液 , 观察并比较实验现象 答案 解析 解析 关闭 A 项 ,AlCl 3 与过量 NaOH 溶液反应生成 NaAlO 2 , 错误 ;B 项 , 乙酸乙酯会与 NaOH 溶液反应 , 错误 ;C 项 , 没有排除 Fe 3+ 的干扰 , 正确的检验方法是 : 取少量的待检验溶液 , 滴加 KSCN 溶液 , 若不变红色 , 再滴加少量的新制氯水 , 若变红色 , 则说明原溶液中存在 Fe 2+ , 错误 ;D 项 , 两试管中 H 2 O 2 浓度相同 , 后者加入 FeCl 3 溶液 , 若后者放出 O 2 速率大 , 说明 FeCl 3 对 H 2 O 2 的分解有催化作用 , 正确。 答案 解析 关闭 D - 13 - 重点梳理 精选例题 规律小结 检验类型与检验方法 - 14 - 重点梳理 精选例题 考点二 物质组成的定量分析 1 . 食醋总酸含量测定与容量分析法 (1) 把食醋中的总酸都看成一元弱酸 ( 乙酸 ) 进行测定。 (2) 容量分析法 : 用一种已知浓度溶液 ( 准确 ) 测定未知浓度溶液的方法 , 其核心是体积测定精确和终点判断准确。 (3) 基本实验操作 : 取样 → 稀释 → 滴定 → 数据处理。 2 . 镀锌铁皮锌镀层厚度的测定 (1) 镀层厚度测定最常用的方法是用游标卡尺或螺旋测微器。如果镀层很薄 , 可以用化学方法测定 , 一般通过溶解镀层前后质量差 , 计算镀层金属的质量 ; 求算镀锌铁皮的表面积 ; 用镀层金属质量除以镀件的表面积 , 即可得到镀层的厚度。 (2) 锌镀层厚度测定实验的关键是准确判断锌完全溶解并及时取出、干燥和称量。 - 15 - 重点梳理 精选例题 3. 物质纯度测定方法 ( 以 NaCl 中混有 Na 2 CO 3 为例 ) (1) 气体体积法 : 将其中一种物质通过反应产生气体并测定其体积 , 根据体积计算该成分的物质的量或质量 , 从而得到物质的纯度。例如 ,NaCl(Na 2 CO 3 ), 可以加盐酸 , 收集测定 CO 2 在标准状况下的体积 , 然后计算 Na 2 CO 3 的质量 , 进而计算 NaCl 的纯度。 (2) 气体质量法 : 将其中一种物质通过反应产生气体 , 测定气体质量 , 根据气体质量计算该成分的物质的量或质量 , 从而得到物质的纯度。例如 ,NaCl(Na 2 CO 3 ), 可以加盐酸 , 利用碱石灰吸收挥发出来 CO 2 , 通过测碱石灰吸收气体前后的质量差确定 CO 2 的质量 , 从而计算 Na 2 CO 3 质量 , 进而计算 NaCl 纯度。 - 16 - 重点梳理 精选例题 (3) 沉淀质量法 : 将一种物质转化为沉淀 , 通过测沉淀质量计算某一成分质量 , 从而计算其纯度。例如 ,NaCl(Na 2 CO 3 ), 溶解后加入足量 BaCl 2 溶液 , 过滤 , 洗涤、干燥 , 称量 BaCO 3 质量 , 计算 Na 2 CO 3 质量 , 进而计算 NaCl 纯度。 (4) 晶体质量法 : 将混合物转化为一种物质 , 称量晶体质量 , 然后利用差量法计算某一成分质量。例如 ,NaCl(Na 2 CO 3 ), 加入足量稀盐酸 , 蒸发结晶 , 称量实验前后固体质量 , 进而计算 NaCl 纯度。 (5) 容量分析法 : 利用滴定原理 , 根据标准液用量计算某一成分质量 , 从而计算纯度。例如 ,NaCl(Na 2 CO 3 ), 取一定量样品配制成溶液 , 用一定物质的量浓度盐酸滴定至不再产生气泡为止 , 根据盐酸用量计算碳酸钠质量 , 进而计算 NaCl 纯度。 - 17 - 重点梳理 精选例题 下列关于食醋中总酸含量的测定实验 , 说法错误的是 ( ) A. 实验室若选用陈醋 , 需用活性炭脱色 B. 食醋量取后要立即将试剂瓶瓶盖盖好 C. 稀释食醋的蒸馏水不需要煮沸 D. 食醋中总酸含量的测定实验主要利用中和滴定法 答案 解析 解析 关闭 A 项是为了防止陈醋的颜色影响滴定终点的判断 ,B 项立即盖紧瓶盖是防止食醋挥发 , 蒸馏水中含有二氧化碳 , 煮沸时可除去二氧化碳。 答案 解析 关闭 C - 18 - 重点梳理 精选例题 跟踪训练 硫酸亚铁铵又称摩尔盐 , 是浅绿色晶体。它在空气中比一般亚铁盐稳定 , 是常用的 Fe 2+ 试剂。某实验小组利用工业废铁屑制取摩尔盐 , 并测定其组成 , 他们进行了摩尔盐的制取 , 请回答下列问题。 - 19 - 重点梳理 精选例题 (1) 废铁屑中含氧化铁 , 无需在制备前除去 , 理由是 、 ( 用离子方程式回答 ), 实验前需将废铁屑放入碳酸钠溶液中煮沸 , 倾倒出液体 , 用水洗净铁屑。从以下仪器中选择组装 , 完成该操作必需的仪器有 ( 填编号 ) 。 ① 铁架台 ② 玻璃棒 ③ 广口瓶 ④ 石棉网 ⑤ 烧杯 ⑥ 漏斗 ⑦ 酒精灯 (2) 步骤 2 中加热方式 ( 填 “ 直接加热 ” ﹑ “ 水浴加热 ” 或 “ 沙浴 ”); 必须在铁屑少量剩余时 , 进行热过滤 , 其原因是 。 - 20 - 重点梳理 精选例题 ①②④⑤⑦ (2) 水浴加热 防止 Fe 2+ 被氧化 , 同时热过滤可防止硫酸亚铁以晶体形式析出 【解析】 (1) 废铁屑中的氧化铁与硫酸反应生成 Fe 3+ ,Fe 3+ 与 Fe 反应转化为 Fe 2+ , 因此无需在制备前除去 Fe 2 O 3 , 反应的离子方程 放入碳酸钠溶液中煮沸 , 倾倒 , 水洗 , 需要用到铁架台、玻璃棒、石棉网、烧杯、酒精灯。 (2) 在 70~75 ℃ 加热 , 用水浴加热。在铁屑少量剩余时 , 进行热过滤 , 其原因是防止 Fe 2+ 被氧化 , 同时热过滤可防止硫酸亚铁以晶体形式析出。 - 21 - 重点梳理 精选例题 规律小结 定量型实验题的解题模板查看更多