- 2021-02-27 发布 |
- 37.5 KB |
- 58页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版高考化学一轮复习专题7化学反应速率与化学平衡3化学平衡的移动课件苏教版
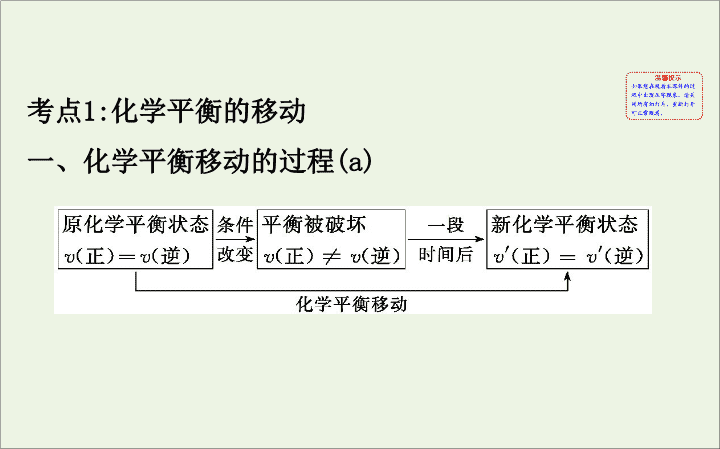
第三单元 化学平衡的移动 考点 1: 化学平衡的移动 一、化学平衡移动的过程 (a) 二、化学平衡移动与化学反应速率的关系 (a) v ( 正 )__ v ( 逆 ): 平衡向正反应方向移动。 v ( 正 )__ v ( 逆 ): 反应达到平衡状态 , 平衡不发生移动。 v ( 正 )< v ( 逆 ): 平衡向 _______ 方向移动。 > = 逆反应 三、外界因素对化学平衡的影响 (b) 【 典例精析 】 【 典例 】 室温下 , 向圆底烧瓶中加入 1 mol C 2 H 5 OH 和含 1 mol HBr 的氢溴酸 , 溶液中发生反应 :C 2 H 5 OH+HBr C 2 H 5 Br+H 2 O, 充分反应后达到平衡。已知常压下 ,C 2 H 5 Br 和 C 2 H 5 OH 的沸点分别为 38.4 ℃ 和 78.5 ℃ 。下列有关叙 述错误的是 ( ) 世纪金榜导学号 A. 加入 NaOH, 可增大乙醇的物质的量 B. 增大 HBr 浓度 , 有利于生成 C 2 H 5 Br C. 若反应物均增大至 2 mol, 则两种反应物平衡转化率之比不变 D. 若起始温度提高至 60 ℃, 可缩短反应达到平衡的时间 【 解题思路 】 解化学平衡移动题的思维过程 【 解析 】 选 D 。加入 NaOH 后 ,NaOH 能与 HBr 反应 , 使平衡向逆 反应方向移动 , 增大乙醇的物质的量 ,A 正确 ; 增大 HBr 浓度 , 使平衡向正反应方向移动 , 有利于生成 C 2 H 5 Br,B 正确 ; 加入反 应物的物质的量之比与反应物的化学计量数之比相等 , 两种 反应物平衡转化率之比不变 ,C 正确 ; 温度提高到 60 ℃, 反应 速率加快 , 而 C 2 H 5 Br 挥发 , 导致 C 2 H 5 Br 浓度减小 , 反应速率减 慢 , 不能判断反应达到平衡的时间与原平衡时间的长短 ,D 错 误。 【 考题变式 】 增大 C 2 H 5 OH 浓度 , 平衡正向移动 ,C 2 H 5 OH 及 HBr 的转化率均增大。这种说法是否正确 ? 为什么 ? 提示 : 不正确。当增大一种反应物的浓度 , 使化学平衡向正反应方向移动时 , 会使另一种反应物的转化率提高 , 而本身的转化率降低。 【 强化训练 】 1. 思维诊断 ( 正确的打“√” , 错误的打“ ×”) (1) 升高温度 , 平衡向吸热反应方向移动 , 此时 v 放 减小 , v 吸 增大。 ( ) 提示 : × 。升高温度 , 正逆反应速率都增大 , 增大倍数不同。 (2) 正逆反应速率发生变化 , 平衡一定发生移动。 ( ) 提示 : × 。如果加入催化剂或改变反应前后气体体积不 变的可逆反应的压强 , 反应速率改变 , 平衡不移动。 (3) 在 FeCl 3 +3KSCN 3KCl+Fe(SCN) 3 平衡体系内加入 KCl 固体 , 平衡逆向移动。 ( ) 提示 : × 。在本质上 KCl 没有参与该离子反应。 (4) 在某温度下 , 反应达到化学平衡 , 增加或减少一部分物质 , 化学平衡一定发生移动。 ( ) 提示 : × 。改变固体或纯液体的量 , 平衡不移动。 (5) 改变温度 , 所有的化学平衡都会发生移动。 ( ) 提示 : √ 。任何化学反应都有能量变化 , 升高温度向吸热方向移动 , 降低温度向放热方向移动。 (6) 合成氨反应 N 2 (g)+3H 2 (g) 2NH 3 (g) 达到化学平 衡时 , 增加适量 N 2 , 平衡正向移动 , K 值增大。 ( ) 提示 : × 。 K 值只受温度影响 , 与其他因素无关。 2. 一定温度下 ,1 mol X 和 n mol Y 在体积为 2 L 的密闭 容器中发生如下反应 :X(g)+Y(g) 2Z(g)+M(s), 5 min 后达到平衡 , 此时生成 2 a mol Z 。下列说法正确 的是 世纪金榜导学号 ( ) A. 用 X 表示此反应的反应速率是 (0.1- 2 a ) mol·L -1 ·min -1 B. 当混合气体的质量不再发生变化时 , 说明反应达到平衡状态 C. 向平衡后的体系中加入 1 mol M, 平衡向逆反应方向移动 D. 向上述平衡体系中再充入 1 mol X, v 正 增大 , v 逆 减小 , 平衡正向移动 【 解析 】 选 B 。由题给反应的化学方程式可知 , 生成 2 a mol Z 消耗 a mol X, 利用化学反应速率的定义可知 , v (X)= =0.1 a mol·L -1 ·min -1 ; 因 M 为固态 , 故平衡向右 移动 , 气体质量变小 ; 若平衡向左移动 , 气体质量增加 , 故当 混合气体质量不再发生变化时 , 可说明反应达到平衡状态 ; 增大 M 的量 , 平衡不发生移动 ; 向平衡体系中再充入 X, 反应物 浓度增大 , 平衡正向移动 , v 正 、 v 逆 都增大。 【 归纳总结 】 1. 解答化学平衡移动类试题的一般思路 2. 化学平衡移动的目的是“减弱”外界条件的改变 , 而不是“抵消”外界条件的改变 , 改变是不可逆转的。新平衡时此物理量更靠近于改变的方向。 如①增大反应物 A 的浓度 , 平衡右移 ,A 的浓度在增大的基础上减小 , 但达到新平衡时 ,A 的浓度一定比原平衡大 ; ② 若将体系温度从 30 ℃ 升高到 50 ℃, 则化学平衡向吸 热反应方向移动 , 达到新的平衡状态时 30 ℃< T <50 ℃; ③ 若对体系 N 2 (g)+3H 2 (g) 2NH 3 (g) 加压 , 如从 10 MPa 加压到 20 MPa, 化学平衡向气体分子数减小的方 向移动 , 达到新的平衡时 ,10 MPa< p <20 MPa 。 3. 几种特殊情况说明 (1) 改变固体或纯液体的量 , 对化学平衡没影响。 (2)“ 惰性气体”对化学平衡的影响。 ①恒温、恒容条件 原平衡体系 体系总压强增大 体系 中各组分的浓度不变 平衡不移动。 ② 恒温、恒压条件 原平衡体系 容器容积增大 , 各反应气体的 分压减小 (3) 同等程度地改变反应混合物中各物质的浓度时 , 应 视为压强的影响。 考点 2: 化学平衡图象问题的解题方法 (c) 【 典例 】 (2016· 四川高考 ) 一定条件下 ,CH 4 与 H 2 O(g) 发 生反应 :CH 4 (g)+H 2 O(g) CO(g)+3H 2 (g) 。设起始 = Z , 在恒压下 , 平衡时 CH 4 的体积分数 φ (CH 4 ) 与 Z 和 T ( 温度 ) 的关系如图所示。下列说法正确的是 世纪金榜导学号 ( ) A. 该反应的焓变 Δ H >0 B. 图中 Z 的大小为 a >3> b C. 图中 X 点对应的平衡混合物中 =3 D. 温度不变时 , 图中 X 点对应的平 衡在加压后 φ (CH 4 ) 减小 【 解题思路 】 解决化学平衡图象题的步骤 【 解析 】 选 A 。据图分析 , 随着温度升高甲烷的体积分 数逐渐减小 , 说明升温平衡正向移动 , 则正反应为吸热 反应 , 故 A 正确 ; 的比值越大 , 起始时水蒸气浓度 越大 , 则甲烷的转化率越大 , 甲烷的体积分数越小 , 故 a <3< b , 故 B 错误 ; 起始加入量的比值为 3, 但反应中甲烷 和水是按等物质的量反应的 , 所以达到平衡时比值不是 3, 故 C 错误 ; 温度不变时 , 加压 , 平衡逆向移动 , 甲烷的体 积分数增大 , 故 D 错误。 【 考题变式 】 (1) 若图象中横坐标改为压强 , φ (CH 4 ) 将如何变化 ? 提示 : 增大压强 , 平衡向逆反应方向移动 , 甲烷的含量增加 , 体积分数 φ (CH 4 ) 变大。 (2) 若反应改为 CO(g)+2H 2 (g) CH 3 OH(g) Δ H = -99 kJ·mol -1 如图曲线所示中 ,A 可以表示反应中的哪 种物质 ? 提示 : 反应的 Δ H <0, 正反应是放热反应。 M 点前 , 表示化学反应从反应物开始 ,M 点为刚达到的平衡点 ;M 点后表明升高温度 , 平衡逆向移动 ,A% 增大 , 则 A 应表示 CO 或 H 2 。 【 强化训练 】 1.(2017· 浙江 11 月选考真题 ) 在催化剂作用下 , 用乙醇制乙烯 , 乙醇转化率和乙烯选择性 ( 生成乙烯的物质的量与乙醇转化的物质的量的比值 ) 随温度、乙醇进料量 ( 单位 :mL·min -1 ) 的关系如图所示 ( 保持其他条件相同 ) 。 在 410 ~ 440 ℃ 温度范围内 , 下列说法不正确的是 ( ) 世纪金榜导学号 A. 当乙醇进料量一定 , 随乙醇转化率增大 , 乙烯选择性升高 B. 当乙醇进料量一定 , 随温度的升高 , 乙烯选择性不一定增大 C. 当温度一定 , 随乙醇进料量增大 , 乙醇转化率减小 D. 当温度一定 , 随乙醇进料量增大 , 乙烯选择性增大 【 解析 】 选 A 。由图象可知 , 当乙醇进料量一定 , 随乙醇转化率增大 , 乙烯选择性先升高后减小 , 故 A 错误、 B 正确 ; 由图象可知 , 当温度一定 , 随乙醇进料量增大 , 乙醇转化率减小 , 故 C 正确 ; 由图象可知 , 当温度一定 , 随乙醇进料量增大 , 乙烯选择性增大 , 故 D 正确。 2. 在密闭容器中进行反应 :X(g)+3Y(g) 2Z(g), 有 关下列图象的说法不正确的是 世纪金榜导学号 ( ) A. 依据图 a 可判断正反应为放热反应 B. 在图 b 中 , 虚线可表示使用了催化剂 C. 若正反应的 Δ H <0, 图 c 可表示升高温度使平衡向逆反应方向移动 D. 由图 d 中混合气体的平均相对分子质量随温度的变化情况 , 可推知正反应的 Δ H >0 【 解析 】 选 D 。依据图象分析 , 温度升高逆反应速率大 于正反应速率 , 平衡逆向移动 , 则正向是放热反应 ,A 正 确 ; 催化剂能加快反应速率 , 缩短反应达到平衡的时间 , 化学平衡不移动 , 则 X 的转化率不变 ,B 正确 ; 若正反应的 Δ H <0, 升温平衡逆向移动 , 逆反应速率大于正反应速率 , 图象符合反应速率的变化 ,C 正确 ; 图象分析 , 温度升高 平均相对分子质量减小 , 总质量不变 , 说明气体物质的量变大 , 所以平衡逆向进行 , 逆反应是吸热反应 , 正反应是放热反应 , 即 Δ H <0,D 错误。 3.(2017· 全国卷 Ⅱ, 节选 ) 丁烯是一种重要的化工原料 , 可由丁烷催化脱氢制备。回答下列问题 : (1) 正丁烷 (C 4 H 10 ) 脱氢制 1- 丁烯 (C 4 H 8 ) 的热化学方程式 如下 : 世纪金榜导学号 ① C 4 H 10 (g) C 4 H 8 (g)+H 2 (g) Δ H 1 已知 :②C 4 H 10 (g)+ O 2 (g) C 4 H 8 (g)+H 2 O(g) Δ H 2 =-119 kJ·mol -1 ③H 2 (g)+ O 2 (g) H 2 O(g) Δ H 3 =-242 kJ·mol -1 图 (a) 是反应①平衡转化率与反应温度及压强的关系 图 , x ________0.1( 填“大于”或“小于” ); 欲使丁烯 的平衡产率提高 , 应采取的措施是 ________( 填标 号 ) 。 A. 升高温度 B. 降低温度 C. 增大压强 D. 降低压强 (2) 丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器 ( 氢气的作用是活化催化剂 ), 出口气中含有丁烯、丁烷、氢气等。图 (b) 为丁烯产率与进料气中 n ( 氢气 )/ n ( 丁烷 ) 的关系。图中曲线呈现先升高后降低的变化趋势 , 其降低的原因是 ___________________ 。 (3) 图 (c) 为反应产率和反应温度的关系曲线 , 副产物主 要是高温裂解生成的短碳链烃类化合物。丁烯产率在 590 ℃ 之前随温度升高而增大的原因可能是 ________ ________________________________________; 590 ℃ 之后 , 丁烯产率快速降低的主要原因可能是 ____ __________________________________________ 。 【 解析 】 (1) 由图 (a) 可以看出 , 温度相同时 , 由 0.1 MPa 变化到 x MPa, 丁烷的转化率增大 , 即平衡正向移动 , 所 以 x 的压强更小 , x <0.1 。由于反应①为吸热反应 , 所以 温度升高时 , 平衡正向移动 , 丁烯的平衡产率增大 , 因此 A 正确、 B 错误 ; 反应①正向进行时体积增大 , 加压时平 衡逆向移动 , 丁烯的平衡产率减小 , 因此 C 错误 ,D 正确。 (2) 反应初期 ,H 2 可以活化催化剂 , 进料气中 n ( 氢气 )/ n ( 丁烷 ) 较小 , 丁烷浓度大 , 反应向正反应方向进行的程 度大 , 丁烯产率升高 ; 然后进料气中 n ( 氢气 )/ n ( 丁烷 ) 增 大 , 原料中过量的 H 2 会使反应①平衡逆向移动 , 所以丁烯 产率下降。 (3)590 ℃ 之前 , 温度升高时反应速率加快 , 生成的丁烯会更多 , 同时由于反应①是吸热反应 , 升高 温度平衡正向移动 , 平衡体系中会含有更多的丁烯。而温度超过 590 ℃ 时 , 由于丁烷高温会裂解生成短链烃类 , 所以参加反应①的丁烷也就相应减少。 答案 : (1) 小于 AD (2) 原料中过量 H 2 会使反应①平衡逆向移动 , 所以丁烯产率下降 (3)590 ℃ 前升高温度 , 反应①平衡正向移动 , 升高温度时 , 反应速率加快 , 单位时间产生丁烯更多 温度高于 590 ℃ 时有更多的 C 4 H 10 裂解导致产率降低 【 归纳总结 】 1. 化学平衡图象题的解答二原则 以可逆反应 a A(g)+ b B(g) c C(g) 为例 : (1)“ 定一议二”原则。 在化学平衡图象中 , 包括纵坐标、横坐标和曲线所表示的意义三个量 , 确定横坐标所表示的量后 , 讨论纵坐标与曲线的关系或确定纵坐标所表示的量 , 讨论横坐标与曲线的关系。如图 : 这类图象的分析方法是“定一议二” , 当有多条曲线及两个以上条件时 , 要固定其中一个条件 , 分析其他条件之间的关系 , 必要时 , 作一辅助线分析。 (2)“ 先拐先平 , 数值大”原则。 在化学平衡图象中 , 先出现拐点的反应先达到平衡 , 先出现拐点的曲线表示的温度较高 ( 如图 A) 或表示的压强较大 ( 如图 B) 。 图 A 表示 T 2 > T 1 , 正反应是放热反应。 图 B 表示 p 1 < p 2 ,A 是反应物 , 正反应为气体总体积缩小的反应 , 即 a + b > c 。 2. 化学平衡图象题解题时的三大注意事项 (1) 在图象题中一定要注意看清横、纵坐标表示的意义及图象中曲线的变化趋势。 (2) 不要忽视图象中的比例关系 , 比例关系一般涉及计算问题。 (3) 有些图象中曲线的斜率可以反映出变化的程度 , 不要忽视。 【 加固训练 】 在恒容密闭容器中通入 X 并发生反应 : 2X(g) Y(g), 温度 T 1 、 T 2 下 X 的物质的量浓度 c (X) 随时间 t 变化的曲线如图所示 : (1) 该反应进行到 M 点时放出的热量 ________( 填“ >” 或“ <”) 进行到 W 点时放出的热量。 (2) T 2 下 , 在 0 ~ t 1 时间内 , v (Y)= ______ mol·L -1 ·min -1 。 (3)M 点的正反应速率 ________( 填“ >” 或“ <”)N 点的逆反应速率。 (4)M 点时再加入一定量 X, 平衡后 X 的转化率 ______( 填“增大”或“减小” ) 。 【 解析 】 根据图象可知 W 点消耗的 X 的物质的量比 M 点消耗的 X 的物质的量大 , 因此反应进行到 W 点时放热多些 ;0 ~ t 1 时间 内 X 的浓度减小了 ( a - b ) mol·L -1 , 则 Y 浓度增加 0.5( a - b ) mol·L -1 , 因此 v (Y)= mol·L -1 ·min -1 ; 根 据先拐先平知 T 1 > T 2 ,M 点的反应速率大于 W 点的反应速率 ,N 点 没有达到平衡 , 此时反应正向进行 , 即 N 点的正反应速率大于 逆反应速率 , 因此 M 点的正反应速率大于 N 点的逆反应速率 ;M 点时 , 再加入一定量的 X, 则相当于增大压强 , 平衡正向 移动 ,X 的转化率增大。 答案 : (1)< (2) (3)> (4) 增大查看更多