2017-2018学年福建省福州市长乐高级中学高二上学期期末考试化学(理)试题 Word版
长乐高级中学2017-2018学年第一学期期末考
高二化学(理科)试卷
命题人: 审核人:
命题内容:《化学反应原理》专题一至专题三
班级 姓名 座号 成绩
说明:1、本试卷分第I、II 两卷,考试时间:90分钟 满分:100分
2、Ⅰ卷的答案用2B铅笔填涂到答题卡上;Ⅱ卷的答案用黑色签字笔填写在答题卡上。
可能用到的相对原子质量:H:1 He:4 C:12 N:14 O:16 Na:23 Al:27 P:31
S:32 Cl:35.5 K:39 Ca:40 Fe:56 Cu:64 Zn:65 Ag:108 Ba:137 Pb:207
第Ⅰ卷(选择题 共45分)
一、选择题(本题包括15小题,每小题3分,每小题只有一个答案符合题意。)
1.关于化学反应与能量,下列说法不正确的是( )
A.人类利用的能量大部分是由化学反应产生
B.化学反应一定伴随着能量变化
C.植物光合作用将太阳能转化为化学能
D.人体运动所消耗的能量与化学反应无关
2.沼气是一种能源,它的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和液态水时放出445 kJ的热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) ΔH=+890 kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890 kJ·mol-1
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
D.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890 kJ·mol-1
3.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作
原理见下图,下列说法正确的是( )
A.正极电极反应式为O2+2H2O+4e-=4OH-
B.CO32-向负极移动
C.a为CH4,b为CO2
D.此电池在常温时也能工作
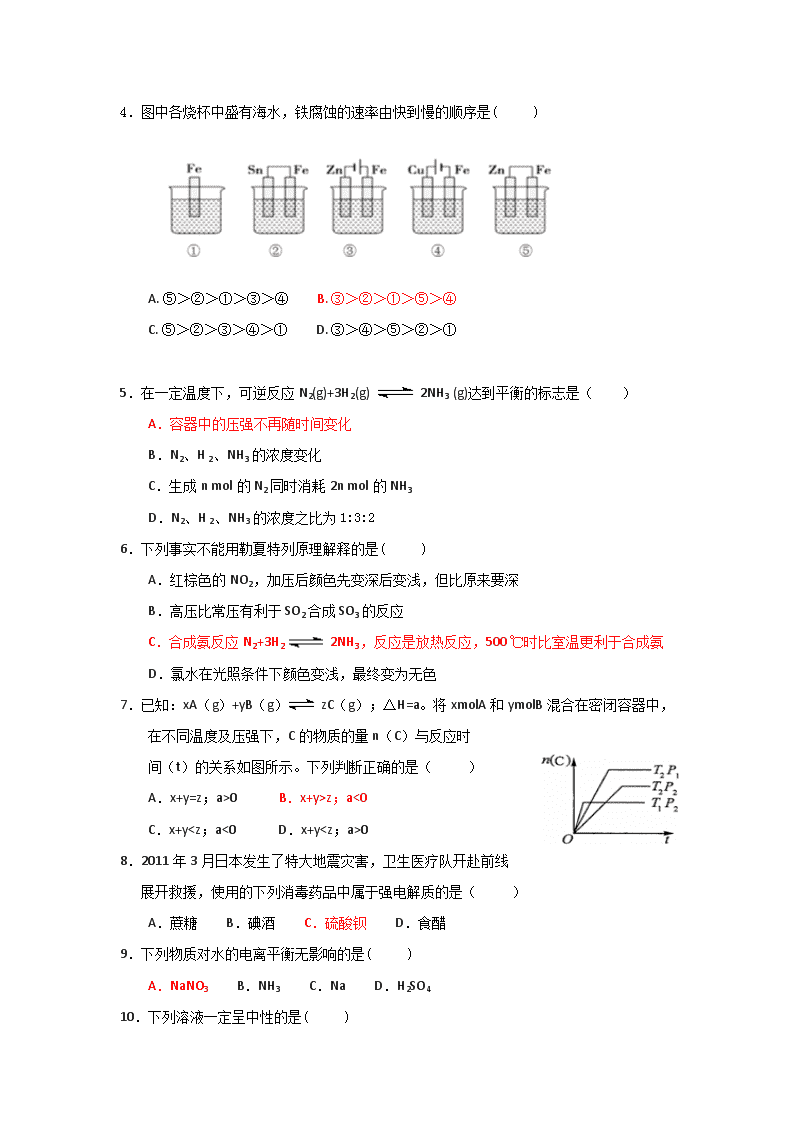
4.图中各烧杯中盛有海水,铁腐蚀的速率由快到慢的顺序是( )
A. ⑤>②>①>③>④ B. ③>②>①>⑤>④
C. ⑤>②>③>④>① D. ③>④>⑤>②>①
5.在一定温度下,可逆反应N2(g)+3H2(g) 2NH3 (g)达到平衡的标志是( )
A.容器中的压强不再随时间变化
B.N2、H 2、NH3的浓度变化
C.生成n mol的N2同时消耗2n mol的NH3
D.N2、H 2、NH3的浓度之比为1:3:2
6.下列事实不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅,但比原来要深
B.高压比常压有利于SO2合成SO3的反应
C.合成氨反应N2+3H2 2NH3,反应是放热反应,500 ℃时比室温更利于合成氨
D.氯水在光照条件下颜色变浅,最终变为无色
7.已知:xA(g)+yB(g) zC(g);△H=a。将xmolA和ymolB混合在密闭容器中,在不同温度及压强下,C的物质的量n(C)与反应时
间(t)的关系如图所示。下列判断正确的是( )
A.x+y=z;a>0 B.x+y>z;a<0
C.x+y
0
8.2011年3月日本发生了特大地震灾害,卫生医疗队开赴前线
展开救援,使用的下列消毒药品中属于强电解质的是( )
A.蔗糖 B.碘酒 C.硫酸钡 D.食醋
9.下列物质对水的电离平衡无影响的是( )
A.NaNO3 B.NH3 C.Na D.H2SO4
10.下列溶液一定呈中性的是( )
A.pH =7的溶液 B.c(H+)= c(OH﹣) 的溶液
C.c(H+)• c(OH﹣)= 1×10﹣14 的溶液 D.CH3COONa的溶液
11.有一支50 mL酸式滴定管,其中盛有溶液,液面恰好在10.0 ml刻度处,把滴定管中的溶液全部流下排出,盛接在量筒中,量筒内溶液的体积 ( )
A、大于40.0 ml B、为40.0 ml C、小于40.0 ml D、为10.0 ml
12.物质的量浓度相同的下列溶液中,NH4+浓度最大的是( )
A.NH4Cl B.NH4HSO4 C.CH3COONH4 D.NH3·H2O
13.在蒸发皿中将下列物质的溶液加热蒸干并灼烧,可以得到该物质固体的是( )
A.氯化铁 B.碳酸氢钠 C.硫酸铝 D.高锰酸钾
14.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl>AgI>Ag2CrO4 B.AgCl>Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl
15.某温度时,BaSO4在水中的沉淀溶解平衡曲线
如图所示,下列说法不正确的是( )
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发不可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp等于c点对应的Ksp
第II卷(非选择题 共55分)
二、填空题(本题共5小题,共55分。)
16.(8分)在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
锌的质量/g
锌的形状
温度/℃
完全溶于溶液的时间/s
A
2
薄片
5
400
B
2
薄片
15
200
C
2
薄片
25
100
D
2
薄片
35
t1
E
2
细小颗粒
15
t2
F
2
粉末
15
t3
G
2
薄片(含少量杂质Cu)
35
t4
(1)t1= s;本反应属于 反应(填吸热或放热)
(2)总结并得出的关于温度影响反应速率的结论是 ;
(3)t1 t4(填“>”或“<”),原因是
;t2 t3(填“>”或“<”),原因是 ;
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为 ;
17.(8分)下图为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图。
电池总反应为:2CH3OH+3O2 2CO2+4H2O。
(1)该装置中 (填a或b)为电池的负极,
其电极反应为 。
(2)已知任何反应都具有一定的可逆性。该甲醇质子
交换膜燃料电池在实际工作中,各反应物、生成物均以气
态的形式存在且反应也具有一定可逆性,即其反应原理可
表示为2CH3OH(g)+3O2(g)2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K= ;在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将 (填增大、减小、不变),其反应的正反应速率将 (填增大、减小、不变);逆反应速率将 (填增大、减小、不变);温度升高 (填有利或不利)于电池将化学能转化为电能。
18. (15分)已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃
700
900
830
1000
1200
平衡常数
1.7
1.1
1.0
0.6
0.4
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
A.压强不随时间改变 B.气体的密度不随时间改变
C.c(A)不随时间改变 D.单位时间里生成C和D的物质的量相等
(3)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为 。
19.(12分)欲测定某HCl溶液的物质的量浓度,可用0.1000mol•L﹣1的NaOH标准溶液进行中和滴定(用酚酞作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测HCl溶液的仪器名称为 ;
(2)盛装标准NaOH溶液的仪器名称为 ;
(3)滴定至终点的颜色变化为 ;
(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.60mL,
滴定后液面如图,则此时消耗标准溶液的体积为 ;
(5)乙学生做了三组平行实验,数据记录如下:
选取下述合理数据,计算出待测NaOH溶液的物质的量浓度
为 (保留四位有效数字);
实验
序号
待测HCl溶液的体积/mL
0.1000mol•L﹣1 NaOH溶液的体积/mL
滴定前刻度
滴定后刻度
①
25.00
0.00
26.29
②
25.00
1.00
26.10
③
25.00
1.00
25.90
(6)下列哪些操作会使测定结果偏低 (填序号)。
A、锥形瓶用待测液润洗 B、碱式滴定管用蒸馏水洗净后再用标准液润洗
C、滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D、滴定前读数正确,滴定后俯视滴定管读数
20.(12分)碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)碳酸钠俗称 ,可作为碱使用的原因是(用离子方程式表示):
。
(2)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4 kJ·mol−1
②NaOH(s)+CO2(g)= NaHCO3(s) ΔH2=−131.5 kJ·mol−1
反应2NaHCO3 (s)= Na2CO3(s)+ H2O(g) +CO2(g)的ΔH= kJ·mol−1,该反应的平衡常数表达式K= 。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中= (保留三位有效数字)。已知Ksp(BaCO3)=2.6×10−9,Ksp(BaSO4)=1.1×10−10。
(4)已知室温时,Ksp[Mg(OH)2]=4.0×10−11。在0.1 mol/L的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全),溶液的pH是 (已知lg2=0.3) 。
长乐高级中学2017-2018学年第一学期期末考
高二化学(理科)参考答案
一、选择题(本题包括15小题,每小题3分,每小题只有一个答案符合题意。)
1.D 2.C 3.B 4.B 5.A 6.C 7.B 8.C 9.A 10.B
11.A 12.B 13.C 14.C 15.A
二、填空题(本题共5小题,共55分。)
16.(8分)
(1)50; 放热;
(2)温度越高,反应越快。
(3)>; 锌中含有杂质铜,可形成原电池,反应加快。
>; 锌表面积增大,反应加快。
(4)mF>mE>mB
17.(8分)
(1)a; CH3OH+H2O-6e-=CO2↑+6H+ (2分)
(2) ;减小;增大;增大;不利。
18. (15分)
(1); <(1分); (2)c;(3)0.022;0.09;80%;80%;(4)2.5。
19.(12分)
(1)锥形瓶 (2)碱式滴定管 (3)溶液由无色变为粉红色且半分钟内不褪色
(4)26.80mL (5)0.1000mol/L (6)D
20.(12分)
(1)纯碱或苏打;CO32-+H2O HCO3-+OH-
(2) +135.6; c(H2O)﹒c(CO2) (3)23.6; (4)11.3
【解析】(4)已知c(MgCl2)=0.1mol•L-1,逐滴加入NaOH溶液,当Mg2+完全沉淀时,c(Mg2+)=10-5 mol/L,即Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-),故c(OH-)===2×10-3,
Kw=1.0×10-14,故c(H+)==×10-11,pH=11.3,故答案为:11.3。