- 2021-02-26 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习化学实验基础知识作业
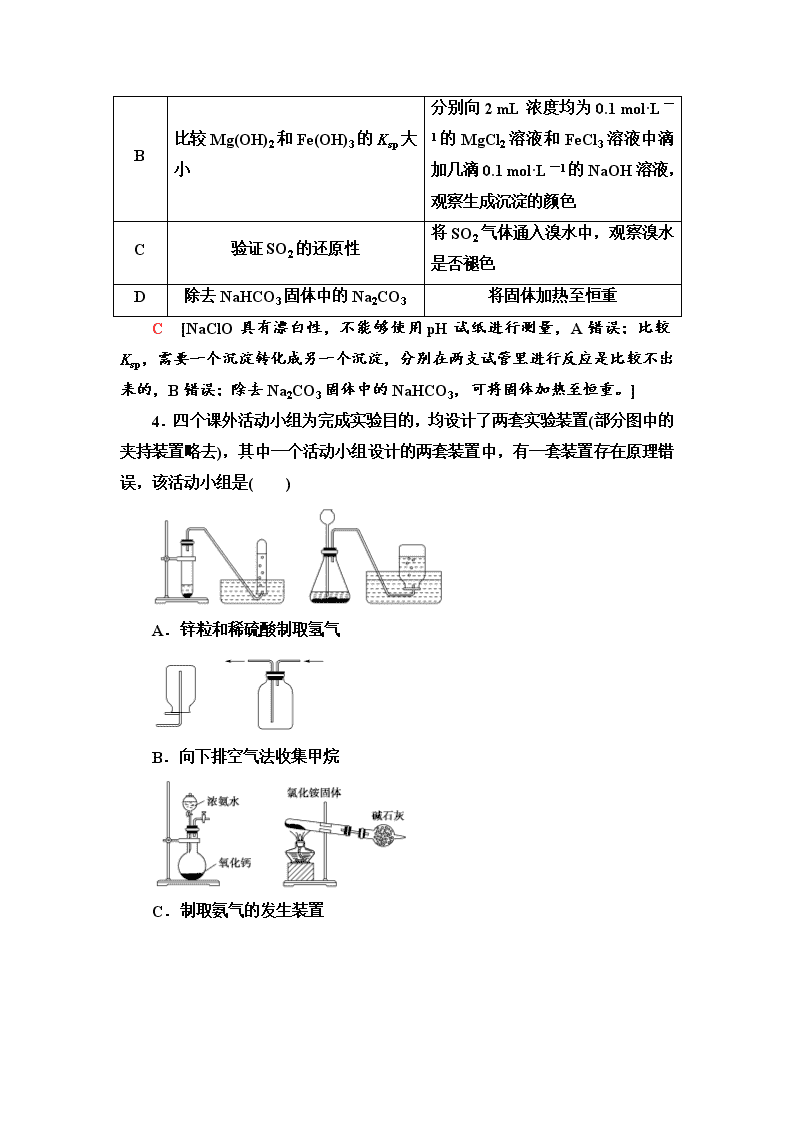
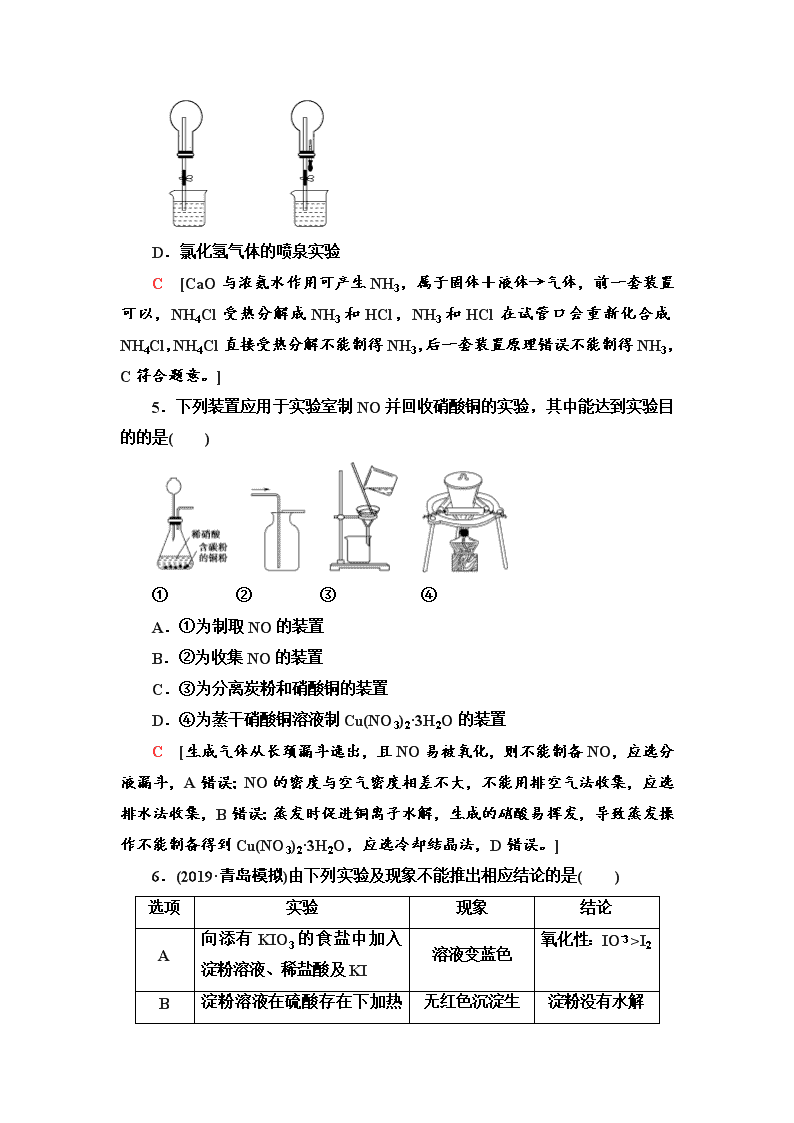
小题分点集训(三) 化学实验基础知识 (建议用时:25分钟) (对应学生用书第159页) 1.下列说法中,正确的是( ) A.少量金属钠保存在煤油、四氯化碳等有机溶剂中 B.用容量瓶配置溶液,定容时俯视刻度线,所配溶液浓度偏大 C.提纯混有少量硝酸钾的氯化钠,应采用加热溶解、冷却结晶、过滤、洗涤、干燥的方法 D.通过对比同体积同浓度且过量的草酸跟同体积不同浓度的KMnO4溶液反应褪色时间的长短来说明浓度越大化学反应速率越快 B [Na能保存在煤油中,但是不能保存在四氯化碳中,因为钠的密度比四氯化碳低,会浮在四氯化碳上面与空气接触,起不到保护的作用,A错误;提纯混有少量硝酸钾的氯化钠,由于NaCl的溶解度随着温度的增加变化较少,而硝酸钾变化较大,NaCl要结晶,而硝酸钾会溶在热的水中,应趁热过滤、洗涤、干燥,C错误;浓度不同的KMnO4溶液,开始的颜色不同,无法比较,应该使用不同浓度的草酸溶液,D错误。] 2.在实验室中,下列除杂或分离的方法正确的是( ) A.硝基苯中混有浓硫酸和浓硝酸,将其倒入NaOH溶液中,静置、分液 B.乙烷中混有乙烯,将混合气体通入酸性高锰酸钾溶液中除去乙烯 C.溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出碘 D.氧化铝中含有二氧化硅,将其溶于足量NaOH溶液中,过滤、洗涤、干燥 A [乙烯被酸性高锰酸钾溶液氧化成CO2,乙烯被除去了,但是引入新的杂质,B错误;汽油为有机物,会和溴苯溶在一起,不能萃取出碘,C错误;氧化铝、二氧化硅均溶于NaOH溶液,D错误。] 3.下列试验方案的设计能达到实验目的的是( ) 选项 实验目的 实验方案 A 证明HClO是弱酸 用pH试纸测定NaClO溶液的pH B 比较Mg(OH)2和Fe(OH)3的Ksp大小 分别向2 mL浓度均为0.1 mol·L-1的MgCl2溶液和FeCl3溶液中滴加几滴0.1 mol·L-1的NaOH溶液,观察生成沉淀的颜色 C 验证SO2的还原性 将SO2气体通入溴水中,观察溴水是否褪色 D 除去NaHCO3固体中的Na2CO3 将固体加热至恒重 C [NaClO具有漂白性,不能够使用pH试纸进行测量,A错误;比较Ksp,需要一个沉淀转化成另一个沉淀,分别在两支试管里进行反应是比较不出来的,B错误;除去Na2CO3固体中的NaHCO3,可将固体加热至恒重。] 4.四个课外活动小组为完成实验目的,均设计了两套实验装置(部分图中的夹持装置略去),其中一个活动小组设计的两套装置中,有一套装置存在原理错误,该活动小组是( ) A.锌粒和稀硫酸制取氢气 B.向下排空气法收集甲烷 C.制取氨气的发生装置 D.氯化氢气体的喷泉实验 C [CaO与浓氨水作用可产生NH3,属于固体+液体→气体,前一套装置可以,NH4Cl受热分解成NH3和HCl,NH3和HCl在试管口会重新化合成NH4Cl,NH4Cl直接受热分解不能制得NH3,后一套装置原理错误不能制得NH3,C符合题意。] 5.下列装置应用于实验室制NO并回收硝酸铜的实验,其中能达到实验目的的是( ) ① ② ③ ④ A.①为制取NO的装置 B.②为收集NO的装置 C.③为分离炭粉和硝酸铜的装置 D.④为蒸干硝酸铜溶液制Cu(NO3)2·3H2O的装置 C [生成气体从长颈漏斗逸出,且NO易被氧化,则不能制备NO,应选分液漏斗,A错误;NO的密度与空气密度相差不大,不能用排空气法收集,应选排水法收集,B错误;蒸发时促进铜离子水解,生成的硝酸易挥发,导致蒸发操作不能制备得到Cu(NO3)2·3H2O,应选冷却结晶法,D错误。] 6.(2019·青岛模拟)由下列实验及现象不能推出相应结论的是( ) 选项 实验 现象 结论 A 向添有KIO3的食盐中加入淀粉溶液、稀盐酸及KI 溶液变蓝色 氧化性:IO>I2 B 淀粉没有水解 淀粉溶液在硫酸存在下加热一段时间后,再与新制的Cu(OH)2悬浊液混合,加热煮沸 无红色沉淀生成 C 常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞 两份溶液均变红,NaHCO3溶液红色更深 常温下的水解平衡常数:Kh(CH3COO-)<Kh(HCO) D 常温时,用两支试管各取5 mL 0.1 mol·L-1 酸性KMnO4溶液,分别加入0.1 mol·L-1和0.2 mol·L-1 H2C2O4溶液各2 mL 两试管溶液均褪色,且加0.2 mol·L-1 H2C2O4溶液的试管中褪色更快 其它条件不变,H2C2O4溶液的浓度越大,化学反应速率越大 B [淀粉溶液在硫酸存在下加热一段时间后,应该加入碱中和至碱性,再与新制的Cu(OH)2悬浊液混合,加热煮沸,B错误。] 7.利用下列实验器材(规格和数量不限),能完成相应实验的一项是 ( ) 选项 实验器材(夹持装置省略) 相应实验 A 坩埚、玻璃棒、泥三角 CuSO4溶液的浓缩结晶 B 烧杯、玻璃棒、胶头滴管、滤纸 用盐酸除去BaSO4中的少量碳酸钡 C 烧杯、玻璃棒、胶头滴管、容量瓶 用固体氯化钠配制0.5 mol·L-1的溶液 D 烧杯、玻璃棒、胶头滴管、分液漏斗 用溴水和CCl4除去NaBr溶液中少量NaI [答案] D 8.用如图所示装置(夹持装置已省略)进行下列实验,能得出相应实验结论的是( ) 选项 ① ② ③ 实验结论 A 稀硫酸 Na2S AgNO3 Ksp(AgCl) >Ksp(Ag2S) 与AgCl的浊液 浓硫酸 蔗糖 溴水 浓硫酸具有脱水性、氧化性 C 稀硫酸 Na2CO3 CaCl2溶液 CO2可与氯化钙反应 D 浓硝酸 Na2CO3 Na2SiO3溶液 酸性:硝酸>碳酸>硅酸 B [图中装置和试剂不发生沉淀的转化,在AgNO3与AgCl的浊液中,AgNO3与H2S反应生成Ag2S沉淀,可发生沉淀的生成,不能说明发生了沉淀的转化,则不能比较溶度积Ksp(AgCl)和Ksp(Ag2S)的大小,A错误;稀硫酸与Na2CO3反应生成二氧化碳,二氧化碳通入CaCl2溶液中没有明显现象,不能证明CO2可与氯化钙是否发生反应,C错误;浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅酸钠溶液反应生成硅酸沉淀,则不能比较碳酸与硅酸的酸性,应排除硝酸的干扰,D错误。] 9.下列物质制备方法正确的是( ) A.用稀硫酸、空气和铜粉反应可制备硫酸铜 B.用碘化钾与浓硫酸反应可制备碘化氢 C.将Na2S溶液与AlCl3溶液混合可制取Al2S3 D.高温条件下,用H2还原MgO可制取单质Mg A [浓硫酸具有强氧化性,能够将HI氧化,因此不能用浓硫酸与碘化钾反应制取HI,B错误;Na2S溶液与AlCl3溶液相互促进水解生成氢氧化铝沉淀和H2S气体,所以不能用Na2S溶液与AlCl3溶液混合制取Al2S3,C错误;制备单质Mg应该用电解熔融MgCl2的方法,D错误。] 10.(2019·厦门一模)实验室制备NaClO2的装置如下图,其中C装置内生成ClO2。下列说法正确的是( ) A.实验开始时,应打开分液漏斗的活塞及弹簧夹乙,关闭弹簧夹甲 B.可用98.3%硫酸代替75%硫酸 C.H2O2是制备NaClO2反应的还原剂 D.F中的试剂可用饱和Ca(OH)2溶液 C [A项,C装置中的竖直玻璃管用于平衡系统的气压并可防止堵塞,实验开始时,应打开弹簧夹甲,故A错误;B项,98.3%硫酸中H2SO4大多以分子的形式存在,其与亚硫酸钠反应较慢,不能用其代替75%硫酸,故B错误;C项,C中产生的ClO2通入D中后与H2O2反应生成NaClO2,氯元素的化合价降低被还原,故H2O2作还原剂,C正确;D项,饱和Ca(OH)2溶液浓度较低,无法充分吸收尾气中的二氧化硫和二氧化氯,故D错误。]查看更多