- 2021-02-26 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学复习身边的化学物质专题复习提纲及典型习题集无答案
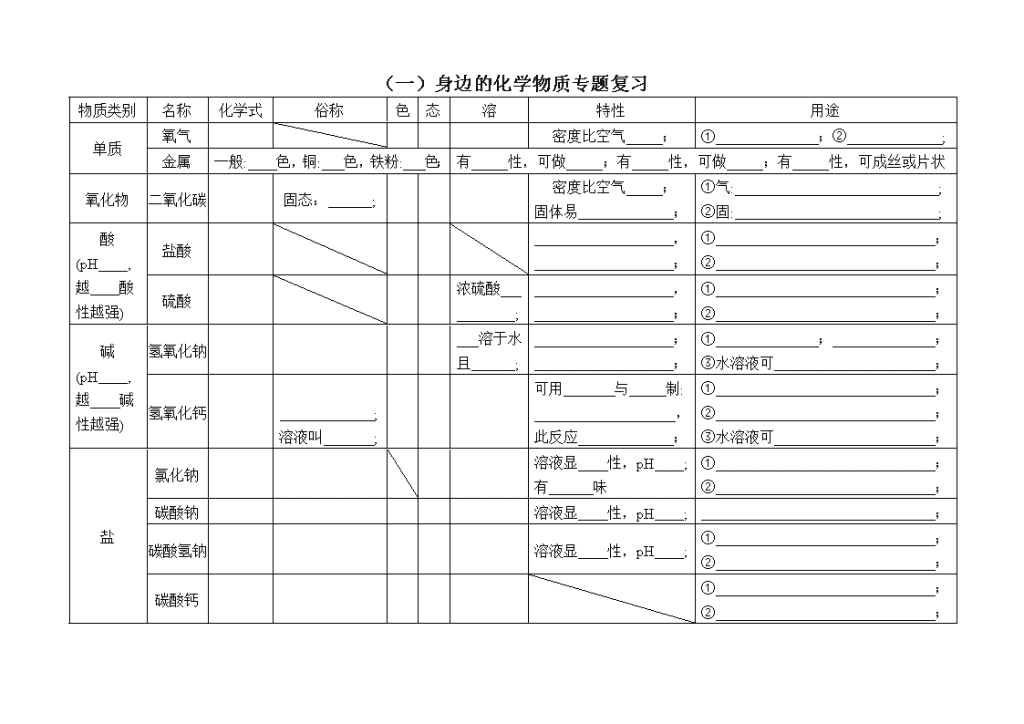
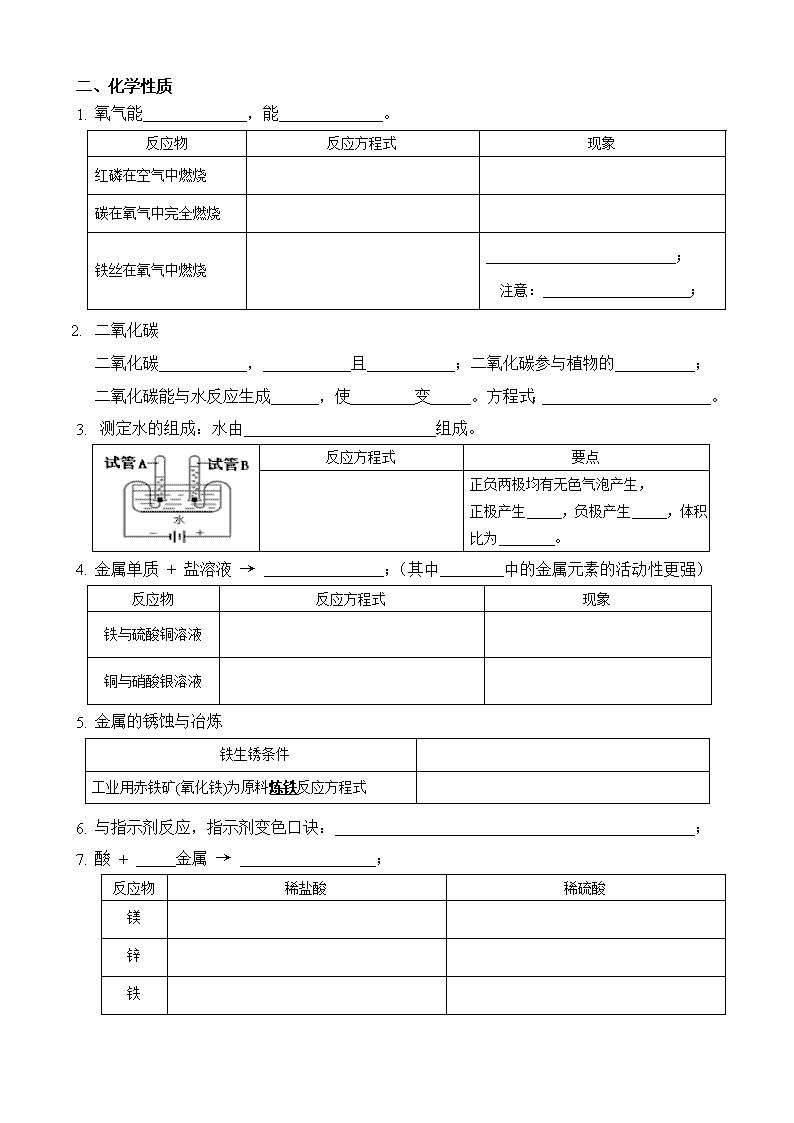
初三化学中考复习提纲及典型习题集 班级 姓名 2019.3-6 (一)身边的化学物质专题复习 物质类别 名称 化学式 俗称 色 态 溶 特性 用途 单质 氧气 密度比空气 ; ① ;② ; 金属 一般: 色,铜: 色,铁粉: 色; 有 性,可做 ;有 性,可做 ;有 性,可成丝或片状 氧化物 二氧化碳 固态: ; 密度比空气 ; 固体易 ; ①气: ; ②固: ; 酸 (pH , 越 酸性越强) 盐酸 , ; ① ; ② ; 硫酸 浓硫酸 ; , ; ① ; ② ; 碱 (pH , 越 碱性越强) 氢氧化钠 溶于水且 ; ; ; ① ; ; ③水溶液可 ; 氢氧化钙 ; 溶液叫 ; 可用 与 制: , 此反应 ; ① ; ② ; ③水溶液可 ; 盐 氯化钠 溶液显 性,pH ; 有 味 ① ; ② ; 碳酸钠 溶液显 性,pH ; ; 碳酸氢钠 溶液显 性,pH ; ① ; ② ; 碳酸钙 ① ; ② ; 二、化学性质 1. 氧气能 ,能 。 反应物 反应方程式 现象 红磷在空气中燃烧 碳在氧气中完全燃烧 铁丝在氧气中燃烧 ; 注意: ; 2. 二氧化碳 二氧化碳 , 且 ;二氧化碳参与植物的 ; 二氧化碳能与水反应生成 ,使 变 。方程式: 。 3. 测定水的组成:水由 组成。 反应方程式 要点 正负两极均有无色气泡产生, 正极产生 ,负极产生 ,体积比为 。 4. 金属单质 + 盐溶液 → ;(其中 中的金属元素的活动性更强) 反应物 反应方程式 现象 铁与硫酸铜溶液 铜与硝酸银溶液 5. 金属的锈蚀与冶炼 铁生锈条件 工业用赤铁矿(氧化铁)为原料炼铁反应方程式 6. 与指示剂反应,指示剂变色口诀: ; 7. 酸 + 金属 → ; 反应物 稀盐酸 稀硫酸 镁 锌 铁 1. 酸 + 金属氧化物 → ; 反应物 反应方程式 现象 注意 稀盐酸除铁锈 若酸过量则会 , 标志: 稀硫酸除铁锈 2. 碱 + 非金属氧化物 → ; 反应物 反应方程式 现象 石灰水与二氧化碳 氢氧化钠与二氧化碳 3. 反应:酸 + 碱 → ; 反应物 反应方程式 现象 盐酸与氢氧化钠 , 需使用 证明。 盐酸与氢氧化钙 硫酸与氢氧化钠 硫酸与氢氧化钙 4. 酸 + 盐 → ,主要为酸与 的反应。 反应物 反应方程式 现象 实验室制二氧化碳 , 若此类反应检验碳酸盐,则还需要 。 稀盐酸与碳酸钠 稀硫酸与碳酸钠 稀盐酸与碳酸氢钠 5. 碱 + 盐 → ; 反应物 反应方程式 现象 碳酸钠溶液与石灰水 6. 其他化学反应见导学案“初中化学重要反应方程式总结”。 三、重要物质的关系 1.相互反应:将下图中能发生反应的物质类别间用“—”连接。 单质 金属 非金属 盐 酸 碱 金属 非金属 氧化物 将下图中能发生反应的物质用“—”连接。 H2 CO CaO C O2 Fe2O3 H2O CO2 Fe 酸 HCl H2SO4 NaOH Ca(OH)2 CaCO3 NaHCO3 Na2CO3 2.转化:请用“→”表示下图中由某物质反应生成另一种物质的反应关系。 HCl H2SO4 H2 H2CO3 H2O H2O2 NaCl NaHCO3 NaOH Na2CO3 Ca(OH)2 CaCO3 CaO CaCl2 C Na2CO3 CO CO2 CaCO3 H2CO3 NaHCO3 四、混合物 1.空气: (1)成分按体积计算: 占 %, 占 %, 占0.94%,二氧化碳占0.03%,其他气体及杂质占0.03%。 (2)测定氧气体积分数方法详见“实验专题复习”。 2.合金:铁的两种合金为 和 。 3.溶液 (1)下列物质放入水中,能形成溶液的是 。 A.面粉 B.牛奶 C.白糖 D.花生油 E.食盐 F.酒精 G.白醋 H.冰 I.豆浆 (2) 组成:溶液 :被溶解的物质。如硝酸钾溶液中的 。 :溶解其他物质的物质。如硝酸钾溶液中的 。 (3)饱和溶液: 的溶液,如图 。 通常: ( ) 不饱和溶液 饱和溶液 特例:Ca(OH)2饱和溶液与不饱和溶液转化时, 。 (4)溶质质量分数 = 。 (5)溶解度:单位 。 ①20℃时,氯化钠的溶解度为36g,其四要素是 。 20℃时,氯化钠的饱和溶液中溶质、溶剂、溶液的质量比为 。 20℃时,将80g氯化钠加入到200g水中,所得溶液质量为 ,得到氯化钠的 溶液。 ②意义:在 ,此物质加入这么多就 。 或 。 ③请在右图中简单绘制出硝酸钾、氯化钠、氢氧化钙的溶解度随温度变化趋势。 ④根据右图回答问题: a.20℃时C的溶解度为 。 b.P点的含义: c.20℃时A、B、C溶解度由大到小的顺序为: 。 练习一 1. [2019中考]铜能被加工成厚度仅为7μm的超薄铜箔,说明铜具有良好的 A.导电性 B.延展性 C.导热性 D.抗腐蚀性 2. [2019中考]铝元素与人类关系密切,铝可制成蒸锅,主要利用铝的延展性和 性。 3. [2019中考]土壤的酸碱度会影响植物的生长。下列植物在微酸性土壤中,不适宜种植的是 植物 A.花生 B.苹果 C.西瓜 D.沙枣 适宜的pH范围 5.0~6.0 5.0~6.5 6.0~7.0 8.0~8.7 1. 人体内几种体液或代谢产物的正常pH范围如下,其中酸性最强的是 A.胃液(0.8~1.5) B.尿液(5.0~7.0) C.血液(7.4~7.5) D.小肠液(7.8~8.0) 2. [2019中考]下列关于物质用途的描述不正确的是 A.氧气可用作燃料 B.二氧化碳可用作气体肥料 C.干冰可用于人工降雨 D.铜丝可用作导线 3. [2019中考]下列物质常用于改良酸性土壤的是 A.熟石灰 B.烧碱 C.食盐 D.大理石 4. [2019中考]能用于治疗胃酸过多症的物质是 A.蔗糖 B.食盐 C.小苏打 D.食醋 5. [2019中考]下列物质必须密封保存的是 A.木炭 B.浓盐酸 C.石灰石 D.氯化钠 6. [2019中考]碳酸氢钠的俗称是 。 7. [2019中考]她来到博物馆门口.同学们在地质学家李四光的大理石雕像前,了解他的生平事迹.大理石的主要成分是______________。 8. [2019中考]甲、乙是两种初中常见物质,由氢、碳、氧、钠、钙5种元素中的2~3种组成。 (1)甲俗称纯碱,其化学式为 。 (2)乙是一种氧化物,遇水放出大量的热,乙的名称是 。 9. [2019中考]A有强烈的腐蚀性,易潮解,无色酚酞溶液遇A的稀溶液变红,A的俗称是 。 10. [2019中考]超细碳酸钙可用于生产钙片、牙膏的产品。利用碳化法生产超细碳酸钙的主要流程示意如下: (1)石灰石主要成分的化学式为 。 (2)乳化池中,生石灰与水发生反应,其化学方程式为 。 练习二 1. [2019中考]下列物质在氧气中燃烧,产生大量白烟的是 A.木炭 B.甲烷 C.蜡烛 D.红磷 2. [2019中考]下列物质在氧气中燃烧,现象为火星四射,有黑色固体生成的是 A.红磷 B.木炭 C.铁丝 D.酒精 1. [2019中考]右图所示实验中,①、④为用紫色石蕊溶液润湿的棉球,②、③为用石蕊溶液染成紫色的干燥棉球.下列能说明CO2密度大于空气且能与水反应的现象是 A.①变红,③不变红 B.④变红,③不变红 C.①、④变红,②、③不变红 D.④比①先变红,②、③不变红 2. [2019中考]下列措施中,不能防止铁制品锈蚀的是 A.喷漆 B.镀一层耐腐蚀的金属 C.制成不锈钢 D.存放在潮湿的空气中 3. [2019中考]电解水实验如右图所示。 (1)试管1中生成的气体为 。 (2)该反应的化学方程式为 。 4. [2019中考]水是一种重要的资源。 (1)电解水实验揭示了水的组成。上图实验中得到氧气的试管是_____(填“1”或“2”) 。 (2)自来水厂净水过程中用到活性炭,其作用是 。 5. [2019中考]汉代海昏侯国遗址考古发掘出大量珍贵文物。 (1)下图是首都博物馆展出的3件文物,其中由金属材料制成的是 (填序号)。 A.金饼 B.“大刘记印”玉印 C.青铜雁鱼灯 (2)出土的铁质编磬锈蚀严重,金饼却依然金光灿灿,从物质性质的角度解释其原因 6. [2019中考]用硫酸铜配制的农药波尔多液,可以防止葡萄生长中的病害。溶解硫酸铜时不宜用铁制容器,用化学方程式表示其原因: 。 7. [2019中考]老师就金属冶炼和金属回收再利用提出了两个问题,请用化学方程式作答。 (1)工业上用一氧化碳和赤铁矿炼铁的原理是________________________。 (2)废旧钢铁表面的铁锈可用盐酸除去,其原理是____________________________。 8. [2019中考]向水中加入泡腾片(主要成分含柠檬酸、碳酸氢钠等),观察到水中产生大量气泡、蜡烛逐渐熄灭。产生上述现象的原因是 。 9. [2019中考]药品“氢氧化铝[Al(OH)3]”片剂能与胃酸(主要成分为盐酸)发生中和反应,治疗胃酸过多症,该反应的化学方程式为 。 10. [2019中考]亮亮做家务时接触到下列用品。 用品 脱氧剂 洁厕灵 炉灶清洁剂 有效成分 还原铁粉 盐酸 氢氧化钠 (1)清理垃圾时发现一袋脱氧剂,拆开后看到还原铁粉已生锈,铁生锈的原因是 。 (2)用洁厕灵清除水垢(主要成分是碳酸钙),用化学方程式表示其原理 。 (3)清洗炉灶时戴上橡胶手套,以防清洁剂与皮肤直接接触,其原因是 。 1. [2019中考]工业上用硫铁矿烧渣(主要成分是Fe3O4、Fe2O3等)、煤粉作原料制备FeCO3的主要流程如下: 酸浸槽中,FeO转化为FeSO4加入的物质X是 。 2. [2019中考]生物浸出技术在金属冶炼中应用广泛。嗜热细菌在65~80℃酸性水溶液及氧气存在下,能氧化黄铜矿(主要成分CuFeS2)产生硫酸盐,进而生产铜和绿矾,主要流程如下: (1)若试剂b为Fe粉,反应①的化学方程式为 。 (2)氢氧化铁与试剂a发生中和反应,反应②的化学方程式为 。 3. [2019中考]化学肥料对粮食增产起着重要作用,下列能作磷肥的是 A.NH4HCO3 B.CO(NH2)2 C.KNO3 D. Ca(H2PO4)2 4. [2019中考]葡萄的果肉和果皮都含有丰富的营养物质。为使葡萄果实饱满、提供含糖量,在葡萄生长的中后期可适当施加硫酸钾、过磷酸钙等肥料,其中硫酸钾属于化肥中的 肥。 5. [2019中考]尿素[CO(NH2)2]属于化学肥料中的 肥。 练习三 1. [2019中考]走进“化学村”。“化学村”的布局如下: (1)认识“居民”。 ①10户“居民”中,俗称熟石灰的是 ,属于氧化物的有 。 ②“居民”CO与Fe2O3反应的化学方程式为 。 ③盐酸有5户相邻的“居民”:Fe2O3、CO、Na2CO3、NaOH、CaCO3,其中不能与它发生反应的是 。 (2)认识“村中的路”。只有相邻且能相互反应的“居民”间是通路。例如,上图中涂成黑色实线的是一条从“Fe2O3家”到达出入口的路。请你在图中涂出一条从“CO2家”到达任一出入口的路。 2. [2019中考]下图为“领取奖杯游戏”的物质阶梯。当阶梯上相邻的物质之间能发生反应,方可向上攀登。例如,攀登阶梯甲能领取奖杯。 (1)认识阶梯甲 ①阶梯上的5 种物质中,属于氧化物的是,俗称纯碱的是 。 ②攀登过程中,H2SO4与Na2CO3发生反应化学方程式为 。 (2)搭建阶梯乙 请你从O2、Fe、Fe2O3、HCl、NaOH中选择4种物质,写在图中相应的台阶上,能领取奖杯。 (3)共享物质、重塑阶梯 阶梯乙搭建完成后,若在阶梯甲和阶梯乙中各选择一种物质进行互换,也均能领取奖杯,则这两种物质是 (任写一组即可)。 练习四 1. [2019中考]通过实验测定了空气的组成的科学家是 A.门捷列夫 B.达尔文 C.拉瓦锡 D.牛顿 2. [2019中考]空气成分中,体积分数最大的是 a b c A.氧气 B.氮气 C.二氧化碳 D.稀有气体 3. [2019中考]右图为空气成分示意图(按体积计算),其中“a”代表的是 A.氧气 B.氮气 C.二氧化碳 D.稀有气体 4. [2019中考]下列关于空气的说法正确的是 A.空气由空气分子构成 B.N2、O2等均匀地混合 C.N2、O2不再保持各自的化学性质 D.N2、O2的体积比约为5:1 5. [2019中考]载人航天器工作舱中的空气要与地球上的空气基本一致。 资料:在同温同压下,气体的体积之比等于分子个数之比。 用微观示意图表示工作舱中空气的主要成分,下图中最合理的是 (填序号)。 6. [2019中考]下列材料属于合金的是 A.玻璃 B.合成橡胶 C.生铁 D.陶瓷 1. [2019中考] 10%CaCl2溶液可作路面保湿剂。欲配制100 kg该路面保湿剂,需水的质量是 kg。 2. [2019中考]下列物质放入水中,能形成溶液的是 A.面粉 B.牛奶 C.食盐 D.植物油 3. [2019中考]下列饮品属于溶液的是 A.蔗糖水 B.牛奶 C.果粒橙 D.豆浆 4. [2019中考]烟道气中含有大量CO2,经“捕捉”可用于生产尿素、甲醇等产品。在高压时将烟道气中的CO2溶解于甲醇,得到CO2的甲醇溶液。所得溶液中溶质是 。 5. [2019中考]配制500g 溶质的质量分数为10%的葡萄糖溶液,需葡萄糖和水的质量分别为 ,主要步骤有称量、量取、 。 6. [2019中考]海水淡化可缓解淡水资源匮乏的问题。下图为太阳能海水淡化装置示意图。利用该装置将一定量的海水暴晒一段时间后,剩余海水中氯化钠的质量分数会 (填“变大”、“变小”或“不变”) 依据实验和溶解度曲线回答9~12题。 25℃时,向下列4只盛有100g水的烧杯中,分别加入不同质量的KCl固体,充分溶解。 1. [2019中考]①中溶液的质量为 A.10g B.90g C.100g D.110g 2. [2019中考]上述溶液为饱和溶液的是 A.②③④ B.②④ C.③④ D.④ 3. [2019中考]能将不饱和KCl溶液变为饱和KCl溶液的方法是 A.升高温度 B.加水 C.加KCl固体 D.倒出部分溶液 4. [2019中考]④中溶液的溶质质量分数约为 A.26% B.29% C.35% D.40% 5. [2019中考] a、b两种物质的溶解度曲线如右图所示.下列说法不正确的是 A.15℃时,a、b的溶解度均为20g B.加水或升温均可使b 的饱和溶液变为不饱和溶液 C.将30℃时a 的饱和溶液降温至15℃,溶质的质量分数不变 D.分别向100g水中加入20g a和b,升温至30℃,所得溶液均为饱和溶液 6. [2019中考] a,b两种物质的溶解度曲线如下图所示.下列说法不正确的是 A.将℃时b的饱和溶液加水可变为不饱和溶液 B.将℃时a的饱和溶液降温至℃,溶液质量不变 C.℃时,两种物质的饱和溶液中溶质质量分数ab D.将℃时a、b的饱和溶液分别降温至℃,两溶液的溶质质量分数相等 7. [2019中考]甲、乙的溶解度曲线如右图所示。下列说法不正确的是 A.t2℃时,甲的饱和溶液中溶质和溶剂的质量比为2:5 B.乙的饱和溶液从t2℃降温到t1℃,溶液仍饱和 C.t1℃时,甲、乙两种饱和溶液中溶质的质量相等 D.甲、乙的饱和溶液分别从t2℃降温到t1℃,两溶液中溶质质量分数相等查看更多