- 2021-02-26 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020_2021学年高中化学专题1化学家眼中的物质世界2_2蒸馏萃取和分液课时作业含解析苏教版必修1
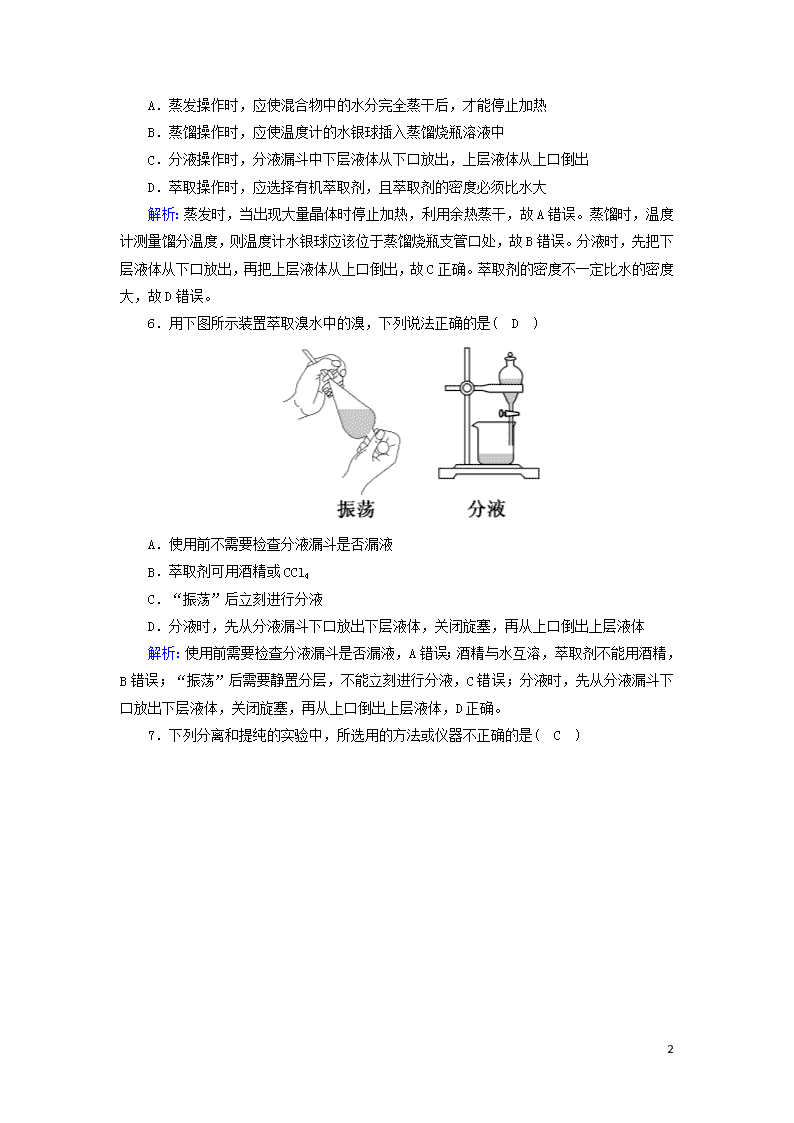
课时作业6 蒸馏、萃取和分液 时间:45分钟 满分:100分 一、选择题(每小题4分,共44分) 1.下列化学实验操作中,一般情况下不能相互接触的是( D ) A.过滤操作中,玻璃棒与三层滤纸处 B.过滤操作中,漏斗下端与烧杯内壁 C.分液操作中,分液漏斗下端与烧杯内壁 D.蒸馏操作中,温度计水银球与待蒸馏液体 解析:蒸馏操作中,温度计水银球应位于蒸馏烧瓶支管口处,不能与待蒸馏液体接触。 2.下列各项操作错误的是 ( A ) A.用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 B.进行分液时,分液漏斗中的下层液体从下端流出,上层液体则从上口倒出 C萃取、分液前需对分液漏斗检漏 D为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下(或使塞上的凹槽对准漏斗上的小孔) 解析:萃取的基本操作是本题考查的内容。 3.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( B ) A.蒸馏 B.升华 C.干馏 D.萃取 解析:“将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳”,描述的是固体物质直接转化为气体物质的过程,类似于碘的升华,因此涉及的操作方法是升华。 4.除去下列物质中的杂质,所用试剂和方法不正确的是( A ) 物质 杂质 除杂所用试剂和方法 A KCl溶液 I2 酒精,萃取 B KNO3 K2SO4 Ba(NO3)2溶液,过滤 C Cu CuO 盐酸,过滤 D CaCO3 CaO H2O,过滤 解析:酒精与水互溶,不能用作萃取剂,可以改为四氯化碳或苯等。 5.下列实验操作中正确的是( C ) 8 A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 B.蒸馏操作时,应使温度计的水银球插入蒸馏烧瓶溶液中 C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 解析:蒸发时,当出现大量晶体时停止加热,利用余热蒸干,故A错误。蒸馏时,温度计测量馏分温度,则温度计水银球应该位于蒸馏烧瓶支管口处,故B错误。分液时,先把下层液体从下口放出,再把上层液体从上口倒出,故C正确。萃取剂的密度不一定比水的密度大,故D错误。 6.用下图所示装置萃取溴水中的溴,下列说法正确的是( D ) A.使用前不需要检查分液漏斗是否漏液 B.萃取剂可用酒精或CCl4 C.“振荡”后立刻进行分液 D.分液时,先从分液漏斗下口放出下层液体,关闭旋塞,再从上口倒出上层液体 解析:使用前需要检查分液漏斗是否漏液,A错误;酒精与水互溶,萃取剂不能用酒精,B错误;“振荡”后需要静置分层,不能立刻进行分液,C错误;分液时,先从分液漏斗下口放出下层液体,关闭旋塞,再从上口倒出上层液体,D正确。 7.下列分离和提纯的实验中,所选用的方法或仪器不正确的是( C ) 8 解析:A项中的仪器为带有支管的蒸馏烧瓶,A项正确;水和植物油不能互溶,需采用分液的方法进行分离,故B项正确;蒸发食盐水得到氯化钠晶体所用仪器为蒸发皿,故D项正确。 8.从海带中提取碘的实验过程中,涉及下列操作,其中正确的是( D ) 解析:海带灼烧成灰应在坩埚中进行;过滤时应用玻璃棒引流;碘的苯溶液在分液漏斗中位于上层,应待下层液体放出后从上口倒出;分离碘并回收苯应用蒸馏的方法,用水浴加热能控制温度,温度太高碘易升华。 8 9.下列实验中,所采取的分离方法与对应原理都正确的是( B ) 解析:A项,KCl可溶,MnO2不溶,除去KCl中的MnO2应采用溶解、过滤、蒸发结晶的方法,故错误;C项,KNO3的溶解度随温度变化较大,NaCl的溶解度随温度变化不大,可以用降温结晶法除去KNO3中的少量杂质(控制条件使杂质处于不饱和状态);D项,食用油和汽油互溶,但沸点不同,应用蒸馏的方法分离,不能用分液法,故错误。 10.下列萃取与分液结合进行的操作(用CCl4为萃取剂,从碘水中萃取碘)中错误的是( D ) A.饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡 B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体) C.打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出 D.最后继续打开活塞,另用容器承接并保存上层液体 解析:分液漏斗中的上层液体须从上口倒出。 11.除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法均正确的一组是( B ) 8 解析:A项中CaO与水反应,C项中CuSO4与NaOH反应,D项中CO与O2反应,A、C、D错误;B项中CuO与稀盐酸反应,Cu不与稀盐酸反应,反应后经过滤、洗涤、干燥即得到Cu,B正确。 二、非选择题(共56分) 12.(12分)已知乙醇的沸点为78.3 ℃,与水以任意比互溶,且在78.15 ℃时与水可形成95.57%(体积分数,下同)的恒沸混合物(即水和酒精可同时挥发)。酒精中的水可加入生石灰除去,反应如下:CaO+H2O===Ca(OH)2,CaO和Ca(OH)2均不溶于酒精。 某化学活动小组要用35%的酒精制取无水酒精,设计了如下四种方案。 方案一:对35%的酒精直接蒸馏得无水酒精。 方案二:先对35%的酒精蒸馏得95.57%的酒精,再加入生石灰,然后进行蒸馏得无水酒精。 方案三:用CCl4对35%的酒精进行萃取,然后对酒精的CCl4溶液进行蒸馏得无水酒精。 方案四:向35%的酒精中直接加入生石灰,然后进行蒸馏得无水酒精。 请对四种方案进行评价,回答下列问题: (1)最好的方案是方案二,错误的方案是方案一和方案三,错误的原因是方案一,酒精与水可形成95.57%的恒沸混合物,直接蒸馏无法得无水酒精;方案三,酒精与水混溶,不能用CCl4萃取。 (2)其余方案的不足是方案四的酒精中水太多,要消耗大量的生石灰。 (3)用最好的方案进行实验时,所用到的玻璃仪器有蒸馏烧瓶、冷凝管、牛角管、锥形瓶、温度计和酒精灯。 (4)蒸馏操作中要注意的事项是温度计水银球要在烧瓶支管口处;冷凝水要下口进上口出;加热时要适当调整酒精灯的位置,以控制温度;先通冷凝水后加热(回答三项即可)(回答三项即可)。 解析:酒精与水可形成95.57%的恒沸混合物,直接蒸馏无法得无水酒精。CaO和Ca(OH)2 8 都是不溶于酒精、难挥发的固体,95.57%的酒精中加入生石灰再蒸馏可以制取无水酒精。若向35%的酒精中直接加入生石灰进行蒸馏,水太多,消耗生石灰太多。酒精与水混溶,不能用CCl4萃取。故四个方案中最好的是方案二,错误的是方案一和方案三。蒸馏时所用到的玻璃仪器有:蒸馏烧瓶、冷凝管、牛角管、锥形瓶、温度计和酒精灯。蒸馏操作中要注意:温度计水银球的位置,冷凝水的流向,加热时温度的控制,为保证蒸气的及时冷却,还应该先通冷凝水后加热。 13.(12分)如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: (1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是引流(或使烧杯内的液体沿玻璃棒流入漏斗中),装置B中玻璃棒的作用是搅拌,防止蒸发皿内溶液因局部过热而溅出。 (2)装置C中①的名称是蒸馏烧瓶,冷却水的方向是下进上出。装置D在分液时为使液体顺利滴下,应进行的具体操作是打开分液漏斗上端的玻璃塞或使凹槽对准小孔。 (3)从氯化钠溶液中得到氯化钠固体,选择装置B(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置C。检验自来水中Cl-是否除净的方法:取少量锥形瓶中的水于洁净试管中,滴加稀硝酸和硝酸银溶液,不产生白色沉淀表明Cl-已除净;从碘水中分离出I2,选择装置D,该分离方法的名称为萃取分液。 解析:(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是引流,便于烧杯内的液体沿玻璃棒流入漏斗中;装置B中玻璃棒的作用是搅拌,防止蒸发皿内溶液因局部过热而溅出。(2)装置C中仪器①为蒸馏烧瓶,冷却水的方向是下进上出。装置D在分液时为使液体顺利滴下,应进行的具体操作是打开分液漏斗上端的玻璃塞,或使凹槽对准小孔。(3)从氯化钠溶液中得到氯化钠固体,应该通过蒸发结晶的方法,选择装置B;除去自来水中的Cl-等杂质,应该通过蒸馏的方法,选择装置C,检验自来水中Cl-是否除净的方法:取少量锥形瓶中的水于洁净试管中,滴加稀硝酸和硝酸银溶液,不产生白色沉淀表明Cl-已除净;从碘水中分离出I2,可以利用苯或四氯化碳萃取碘,选择装置D,该分离方法的名称为萃取分液。 14.(12分)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子(I-)的形式存在。在含碘离子的溶液中通入适量氯气,可以生成单质碘:2KI+Cl2===2KCl+I2。某课外活动小组欲从海藻中提取碘,设计如下流程: 8 (1)指出提取碘的过程中有关的实验操作名称:①过滤、③萃取分液、④蒸馏。操作①中用到的玻璃仪器有漏斗、烧杯、玻璃棒 。 (2)提取碘的过程中,可选用的萃取剂是C(填序号)。 A.酒精 B.醋酸 C.四氯化碳 D.NaOH溶液 (3)下列海产品中,可用于工业上大量提取碘的是BD(填序号)。 A.贝壳 B.紫菜 C.鱼 D.海带 解析:海藻灰用水浸泡后,碘离子溶于水中,过滤后得到含碘离子的溶液;向含碘离子的溶液中通入适量的氯气后得到含单质碘的溶液;在含单质碘的溶液中加入有机溶剂萃取碘,然后分液,得到含碘的有机溶液;对含碘的有机溶液进行处理可得到固态碘。 15.(20分)某工厂排放的废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程图(提示:图中“……”是使Br-变为Br2的反应过程)。 试剂a须从以下试剂中选择:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、稀盐酸。请根据以上流程,回答下列问题: (1)操作①、②、③、④、⑤的名称依次是B(填字母) A.萃取、过滤、分液、过滤、蒸发结晶 B.萃取、分液、蒸馏、过滤、蒸发结晶 C.分液、萃取、过滤、过滤、蒸发结晶 D.萃取、分液、分液、过滤、蒸发结晶 (2)除去无色液体Ⅰ中的Ca2+、Mg2+、SO,选出a所代表的试剂,按滴加顺序依次是BaCl2溶液、饱和K2CO3溶液、KOH溶液(或KOH溶液、BaCl2溶液、饱和K2CO3溶液或BaCl2 8 溶液、KOH溶液、饱和K2CO3溶液)。 (3)“调至pH=7”的作用是中和过量的KOH及K2CO3,所用的试剂是稀盐酸(填名称)。 (4)操作⑤中用到的玻璃仪器除酒精灯外还有玻璃棒(填仪器名称)。 解析:(1)由流程图知,无色液体Ⅰ中含有K+、Cl-、Ca2+、Mg2+、SO,无色液体Ⅲ中只含有K+、Cl-,则试剂a的作用是除去Ca2+、Mg2+、SO。操作①是萃取,操作②是将互不相溶的两液体分开——分液,操作③是将沸点不同的两液体分开——蒸馏,操作④是将溶液与沉淀分离——过滤,操作⑤是将KCl从其水溶液中提取出来——结晶。(2)除杂时,除杂试剂应过量,且不能引入新杂质。除去Ca2+,用K2CO3溶液;除去Mg2+,用KOH溶液;除去SO,用BaCl2溶液。所以除去KCl溶液中的Ca2+、Mg2+、SO,只要满足加BaCl2溶液在加K2CO3溶液之前即可。(3)由以上分析知,溶液中还含有杂质CO和OH-,所以需用盐酸来中和过量的KOH及K2CO3。(4)由于操作⑤的实验步骤是蒸发结晶,蒸发时需要用到蒸发皿,蒸发皿需要放在铁圈上,需用酒精灯加热和玻璃棒搅拌。所以该操作用到的玻璃仪器还有玻璃棒。 8查看更多