- 2024-02-04 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年江苏省如皋中学高二上学期第二次月考化学试题 Word版
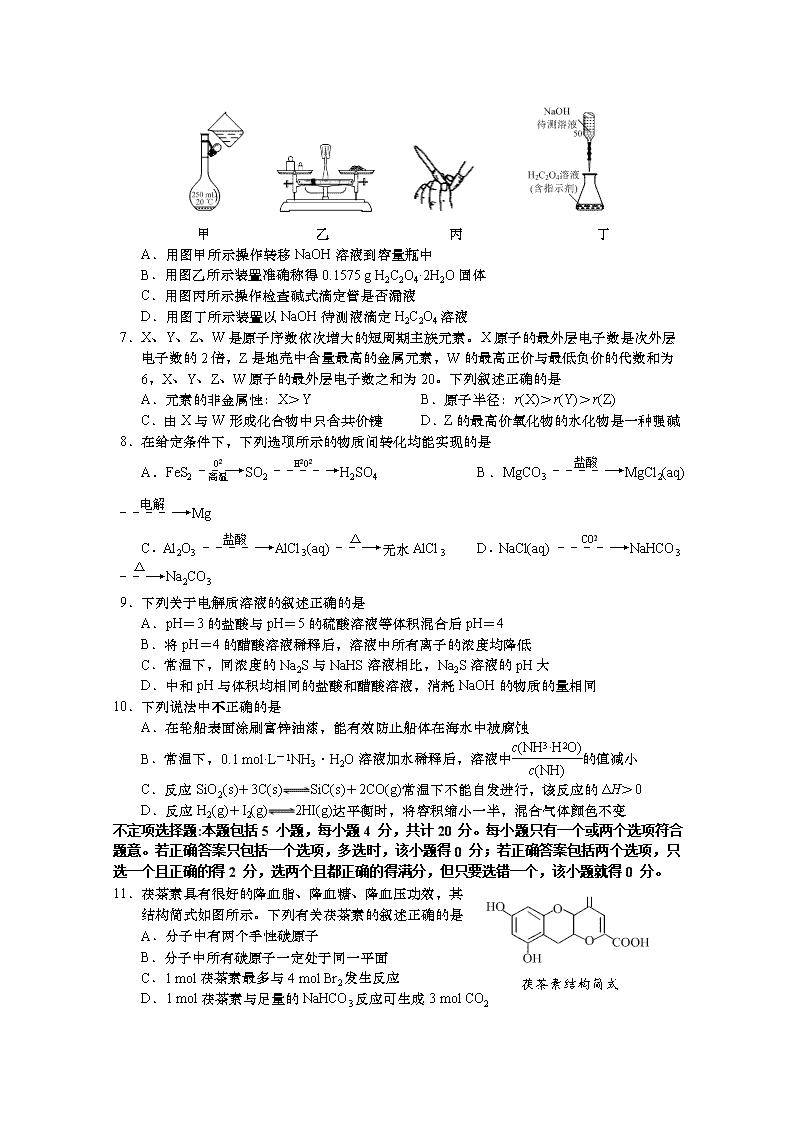
2018~2019学年度高二第一学期阶段第二次月考试卷 高二化学(选修) 学号____________________ 姓名____________________ 总分:120分,考试时间:100分钟。 可能用到的相对原子质量:H-1 C-12 O-16 Mg-24 Al-27 S-32 Cu-64 I-127 选择题(共40分) 单项选择题:本题包括10 小题,每小题2 分,共计20 分。每小题只有一个选项符合题意。 1.化学与生产、生活密切相关,下列有关说法正确的是 A.明矾可用于净水,也可用于淡化海水 B.沼气是可再生资源,电能是二次能源 C.水瓶胆内部的水垢可用饱和食盐水清洗 D.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放 2.下列有关化学用语表示正确的是 A.硫离子的结构示意图: B.次氯酸钠的电子式:Na+[:::]- C.磷酸的电离方程式:H3PO43H++PO D.硫氢化钠水解的离子方程式方程式:HS-+H2OS2-+H3O+ 3.下列有关物质性质与用途具有对应关系的是 A.SO2具有还原性,可用作纸浆的漂白剂 B.Al(OH)3具有两性,可用作塑料的阻燃剂 C.BaCO3能与盐酸反应,可用作胃酸的中和剂 D.ClO2具有强氧化性,可用作自来水的消毒剂 4.常温下,下列各组离子在指定溶液中一定能大量共存的是 A.pH=1的溶液中:Na+、Mg2+、AlO、NO B.甲基橙显黄色的溶液中:K+、NH、HCO、NO C.=1×1012 的溶液中:Ca2+、NH、Cl-、K+ D.由水电离产生的c(H+)=1×10-12mol·L-1的溶液中:K+、NH、Cl-、SO 5.下列指定反应的离子方程式正确的是 A.向AlCl3溶液中滴加氨水:Al3++3OH-===Al(OH)3↓ B.SO2通入FeCl3溶液中:SO2+Fe3++2H2O=== SO+Fe2++4H+ C.用惰性电极电解硫酸铜溶液:2Cu2++2H2O2Cu↓+O2↑+4H+ D.向Ca(ClO)2溶液中通入过量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO 6.NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质H2C2O4·2H2O的称量以及用NaOH溶液滴定等操作。下列有关说法正确的是 甲 乙 丙 丁 A.用图甲所示操作转移NaOH溶液到容量瓶中 B.用图乙所示装置准确称得0.1575 g H2C2O4·2H2O固体 C.用图丙所示操作检查碱式滴定管是否漏液 D.用图丁所示装置以NaOH待测液滴定H2C2O4溶液 7.X、Y、Z、W是原子序数依次增大的短周期主族元素。X原子的最外层电子数是次外层电子数的2倍,Z是地売中含量最高的金属元素,W的最高正价与最低负价的代数和为6,X、Y、Z、W原子的最外层电子数之和为20。下列叙述正确的是 A.元素的非金属性:X>Y B.原子半径:r(X)>r(Y)>r(Z) C.由X与W形成化合物中只含共价键 D.Z的最高价氧化物的水化物是一种强碱 8.在给定条件下,下列选项所示的物质间转化均能实现的是 A.FeS2SO2H2SO4 B.MgCO3MgCl2(aq)Mg C.Al2O3AlCl3(aq)无水AlCl3 D.NaCl(aq)NaHCO3Na2CO3 9.下列关于电解质溶液的叙述正确的是 A.pH=3的盐酸与pH=5的硫酸溶液等体积混合后pH=4 B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 C.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 D.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 10.下列说法中不正确的是 A.在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀 B.常温下,0.1 mol·L-1NH3·H2O溶液加水稀释后,溶液中的值减小 C.反应SiO2(s)+3C(s)SiC(s)+2CO(g)常温下不能自发进行,该反应的ΔH>0 D.反应H2(g)+I2(g)2HI(g)达平衡时,将容积缩小一半,混合气体颜色不变 不定项选择题:本题包括5 小题,每小题4 分,共计20 分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0 分;若正确答案包括两个选项,只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。 茯茶素结构简式 11.茯茶素具有很好的降血脂、降血糖、降血压功效,其 结构简式如图所示。下列有关茯茶素的叙述正确的是 A.分子中有两个手性碳原子 B.分子中所有碳原子一定处于同一平面 C.1 mol茯茶素最多与4 mol Br2发生反应 D.1 mol茯茶素与足量的NaHCO3反应可生成3 mol CO2 12.下列图示与对应的叙述相符的是 图甲 图乙 图丙 图丁 A.图甲表示向氨水中通入HCl气体,溶液的导电能力变化 B.图乙表示反应:X(g)+2Y(g)3Z(g),b曲线表示的一定是增大压强 C.图丙可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水 D.图丁可表示用0.1 mol·L-1醋酸滴定40.00 mL 0.1 mol·L-1 NaOH溶液得到的滴定曲线 13.根据下列实验操作和现象所得到的结论正确的是 选项 实验操作和现象 结论 A 向K2MnO4溶液(墨绿色)中加入醋酸,溶液逐渐变为紫色且有黑色沉淀 醋酸具有氧化性 B 向Fe(NO3)2溶液中滴入HI和淀粉混合溶液,溶液变蓝 氧化性:Fe2+>I2 C 向苯酚钠溶液中通入CO2,溶液变浑浊 结合H+的能力: C6H5O->CO>HCO D 常温下配制浓度均为0.1 mol·L-1 CH3COONa溶液和NaCN溶液,测得NaCN溶液的pH更大 酸性:CH3COOH >HCN 14.常温下,0.1 mol·L-1的H2C2O4溶液中H2C2O4、HC2O、 C2O三者所占物质的量分数(分布系数)随pH变化的关 系如图所示。下列表述正确的是 A.HC2OH++C2O K=1×10-4.3 B.将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得 溶液pH恰好为4.3 C.常温下HF的Ka=1×10-3.45,将少量H2C2O4溶液加入 到足量NaF溶液中,发生的反应为H2C2O4+F-===HF+HC2O D.在0.1 mol·L-1NaHC2O4溶液中存在:c(OH-)=c(H+)+c(HC2O)+2c(H2C2O4) 15.H2S与CO2反应可制得COS:H2S(g)+CO2(g)COS(g)+H2O(g) ΔH。一定温度下, 在三个 2 L的恒容密闭容器中投入反应物,容器Ⅰ中反应至5 min时达到平衡,有关数据如下: 容器 温度 /℃ 起始时物质的量/mol 平衡时 物质的量/mol 平衡 压强 平衡 常数 H2S CO2 COS H2O COS Ⅰ 500 0.200 0.200 0 0 0.020 P1 K1 Ⅱ 700 0.200 0.200 0 0 n2 P2 K2= Ⅲ 700 0.400 0.400 0 0 n3 P3 K3 下列判断正确的是 A.ΔH<0,反应达到平衡后的压强:P1<P2<P3 B.容器Ⅰ中前5 min内的平均反应速率v(H2S)=0.002 mol·L-1·min-1 C.容器Ⅰ中达到平衡后,再充入CO2(g)和H2O(g)各0.020 ml,平衡将逆向移动 D.容器Ⅲ中再充入COS(g)和H2O(g)各0.2 mol,达到新平衡时CO2的体积分数增大 非选择题(共80分) 16.(12分)请按要求写出相应反应的方程式。 ⑴以富锰渣(主要成分为MnCO3,杂质为Al2O3、SiO2等)为原料制备MnO2的流程如下: ①酸浸时Al2O3发生反应的离子方程式为 。 ②调pH时,若NaOH溶液不足会生成碱式硫酸铝Al4(SO4)3(OH)6。该反应的化学方程式为 。 ③“滤液”中含硫微粒为SO,“氧化”时的离子方程式为 。 ⑵以废镍(主要成分为NiO,含少量Ni、Fe等)为原料制取Ni2O3的工艺流程如图所示。 ① “沉镍”所得滤液用右图所示装置电解可得到NaClO,写出“电解”时该 装置内所发生总反应的离子方程式: 。 ② “沉镍”所得滤渣Ni(OH)2经“氧化Ⅱ”后可得到Ni2O3,写出“氧化Ⅱ” 反应的离子方程式: 。 ③Ni2O3溶于浓盐酸时会有黄绿色气体生成,写出该反应的化学方程式: 。 17.(15分)瑞替加滨是一种新型抗癫痫药物,为神经元钾通道开放剂。某合成瑞替加滨的部分路线如下: ⑴化合物A中含氮官能团的名称为___________________________。 ⑵CD的反应类型为_____________________。设计步骤CD和EF的目的是 ____________________________________________________________________。 ⑶B的分子式为C9H10O4N2,则B的结构简式为__________________________________。 ⑷C的一种同分异构体同时满足下列条件,该同分异构体的结构简式为______________。 Ⅰ.能发生银镜反应;Ⅱ.能发生水解反应,产物之一能与FeCl3溶液发生显色反应; Ⅲ.分子中有5种不同化学环境的氢。 ⑸已知:RCOOHRCOCl。请写出以草酸()和苯胺()为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。 18.(12分)工业上用CO和H2合成甲醇的反应方程式为CO(g)+2H2(g)CH3OH (g) ΔH, 在T1时,体积为2 L的恒容容器中充入物质的量之和为3 mol的H2和CO,达到平衡时CH3OH的体积分数(V %)与n(H2)∶n(CO)的关系如图甲所示。 图甲 图乙 ⑴当起始n(H2)∶n(CO)=2,经过5 min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5 min内平均反应速率v(H2)=______________________________。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH(g),达新平衡时H2的转化率将_______________ (填“增大”、“减小”或“不变”)。 ⑵当起始n(H2)∶n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图像中的 ________点(填“D”、“E”或“F”)。 ⑶由图乙可知该反应的ΔH_________0(填“>”“<”或“=”,下同),压强p1___________p2;当压强为p2时,在y点:v(正)__________v(逆)。 19.(12分)常温下,向100 mL 0.01 mol·L−1的HA溶液中 逐滴加入0.02 mol·L−1的MOH溶液,图中所示曲线 表示混合溶液的pH变化情况(体积变化忽略不计)。 ⑴由图中信息可知HA为 (填“强”或“弱”)酸, 理由是 。 ⑵常温下一定浓度的MA稀溶液的pH=a,则a (填“>”“<”或“=”)7,用离子方程式表示其原因: ,此时,溶液中由水电离出的c(OH−)= 。 ⑶请写出K点所对应的溶液中离子浓度的大小关系: 。 ⑷K点对应的溶液中,c(M+)+c(MOH) (填“>”、“<”或“=”)2c(A−);若此时溶液的pH=10,则c(MOH)+c(OH−)= mol·L−1。 20.(15分)研究氮及其化合物的性质在人类进步过程中具有极为重要的意义。 ⑴肼(N2H4)与N2O4分别是火箭发射中最常用的燃料与氧化剂。已知2N2H4(l)+N2O4(l) ===3N2(g)+4H2O(l) ΔH=-1 225 kJ·mol-1。几种化学键的键能数据如下: 化学键 N-H N-N N≡N O-H 键能/(kJ·mol-1) 390 190 946 460 则1 mol N2O4(l)完全分解成相应的原子时需要吸收的能量是____________________。 ⑵N2O4与NO2转化的热化学方程式为N2O4(g)2NO2(g) ΔH=+24.4 kJ·mol-1。 ①将一定量的N2O4投入固定容积的真空容器中,下各项能表明反应达到平衡的是 ________(填字母)。 a.v正(N2O4)=2v逆(NO2) b.体系颜色不变 c.气体平均相对分子质量不变 d.气体密度不变 ②在一密闭容器中发生该反应,达到平衡后,保持体积不变升高温度,再次达到平衡时,则混合气体的颜色________(填“变深”“变浅”或“不变”)。 ③平衡常数K可用反应体系中气体物质平衡分压表示,即K表达式中平衡浓度可用平衡分压代替,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数K的表达式____________________(用p总、各气体物质的量分数x表示)。 ⑶氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示: t/min 0 5 10 15 20 25 30 n(H2)/mol 6.00 4.50 3.60 3.30 3.03 3.00 3.00 n(NH3)/mol 0 1.00 1.60 1.80 1.98 2.00 2.00 ①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3 mol·L-1,则此时v正__________v逆(填“大于”、“小于”或“等于”)。 ②由表中的实验数据可得到“c-t”的关系,如图Ⅰ所示,表示c(N2)—t的曲线是_____。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为________。 图Ⅰ 图Ⅱ ⑷有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图Ⅱ所示。电池正极的电极反应式是 ________________________________________,A是________________(填名称)。 21.(14分)某化学兴趣小组欲测定某工厂工业废水中游离态氯的含量。 ⑴测定原理:Cl2+2KI===2KCl+I2;I2+2Na2S2O3===2NaI+Na2S4O6 ⑵①仪器和用品(自选,略) ②试剂:指示剂_____________________(填名称),KI溶液,浓度为0.01 000 mol·L-1的标准Na2S2O3溶液,蒸馏水等。 ⑶①取水样10.00 mL于锥形瓶中,再加10.00 mL KI溶液(足量),滴入2~3滴指示剂。 ②取____________(填“碱式”或“酸式”)滴定管,经检查不漏水后依次用自来水、蒸馏水洗净,然后装入0.010 00 mol·L-1Na2S2O3溶液待用。 ③将锥形瓶置于滴定管下方进行滴定,眼睛注视_________________________________直至滴定终点,滴定终点的现象是__________________________________________。 ④数据记录与处理: 滴定 次数 待测溶液 体积/mL 标准Na2S2O3溶液体积/mL 滴定前刻度 滴定后刻度 实际体积/mL 1 10.00 0.00 20.00 20.00 2 10.00 0.10 20.00 19.90 3 10.00 0.10 20.20 20.10 则废水中Cl2的物质的量浓度为______________________________,从实验过程分析,此浓度比实际浓度_____________(填“偏大”、“偏小”或“相等”)。 ⑷若某同学所测定的游离态氯的含量比废水中Cl2的含量明显偏小。经过思考,该同学提出了下列可能造成结果偏小的原因,其中你认为正确的是__________(填编号)。 a.滴定前,滴定管尖嘴处有气泡,滴定后气泡消失 b.滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外 c.滴定前平视Na2S2O3液面,滴定后俯视Na2S2O3液面 d.滴定管没有用Na2S2O3标准溶液润洗 2018~2019学年度第一学期高二年级 第二次阶段测试化学选修试题参考答案 单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。 1.B 2.B 3.D 4.C 5.C 6.D 7.C 8.A 9.C 10.D 不定项选择题:本题包括5小题,每小题4分,共计20分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。 11.AC 12.C 13.D 14.AC 15.BC 16.⑴①Al2O3+6H+=== 2Al3++3H2O ②2Al2(SO4)3+6NaOH=== Al4(SO4)3(OH)6+3Na2SO4 ③S2O+Mn2++2H2O=== MnO2+2SO+4H+ ⑵①Cl-+H2OClO-+H2↑ ②2Ni(OH)2+ClO-=Ni2O3+Cl-+2H2O ③Ni2O3+6HCl(浓)=2NiCl2+3H2O+Cl2↑ (每空2分,共12分) 17.⑴氨基、硝基 (2分) ⑵取代反应 (2分) 保护氨基防止其浓硝酸被氧化(2分) ⑶ (2分) ⑷或 (其它合理答案均可)(2分) ⑸ (5分,每步得1分,见错终止) 18.⑴0.09 mol·L-1·min-1 增大 ⑵F ⑶> > > (每空2分,共12分) 19.⑴强(1分) 0.01 mol·L−1的HA溶液中c(H+)=0.01 mol·L−1 ⑵<(1分) M++H2OMOH+H+ 1×10−a mol·L−1(1分) ⑶c(M+)>c(A−)>c(OH−)>c(H+) ⑷=(1分) 0.005 (除标注外,其余每空2分,共12分) 20.⑴1793 kJ ⑵①bc ②变深 ③K=p总·x2(NO2)/x(N2O4)(其他合理答案亦可) ⑶①大于(1分) ②乙(1分) B(1分) ⑷N2+8H++6e-===2NH 氯化铵 (除标注外,其余每空2分,共15分) 21.⑵②淀粉溶液 ⑶②碱式 ③锥形瓶内溶液颜色的变化 溶液由蓝色变为无色且半分钟内颜色不恢复 ④0.010 00 mol·L-1 偏大 ⑷bc (每空2分,共14分)查看更多