化学卷·2019届福建省闽侯第六中学高二上学期期末考试(2018
福建省闽侯第六中学 2017-2018 学年高二上学期期末化学 考试试题
可能用到的相对原子质量:H: 1 C: 12 N:14 O :16 Na:23 Cu:64
一、选择题(每小题只有一个选项符合题意,每小题 2 分,共 40 分) 1.下列有关氟氯烃的说法中,不正确的是( )
A.氟氯烃是一种含氟和氯的卤代烃
B.氟氯烃的化学性质稳定,有毒
C.氟氯烃大多无色、无臭、无毒
D.在平流层中,氟氯烃在紫外线照射下,分解产生的氯原子可引发损耗臭氧层的循环反应 2.下列热化学方程式中,ΔH 能正确表示物质的燃烧热的是
2 2
A.CO(g)+1/2O (g)===CO (g) ΔH=-283.0 kJ·mol-1
B.C(s)+1/2O (g)===CO(g) ΔH=-110.5 kJ·mol-1
2 2 2
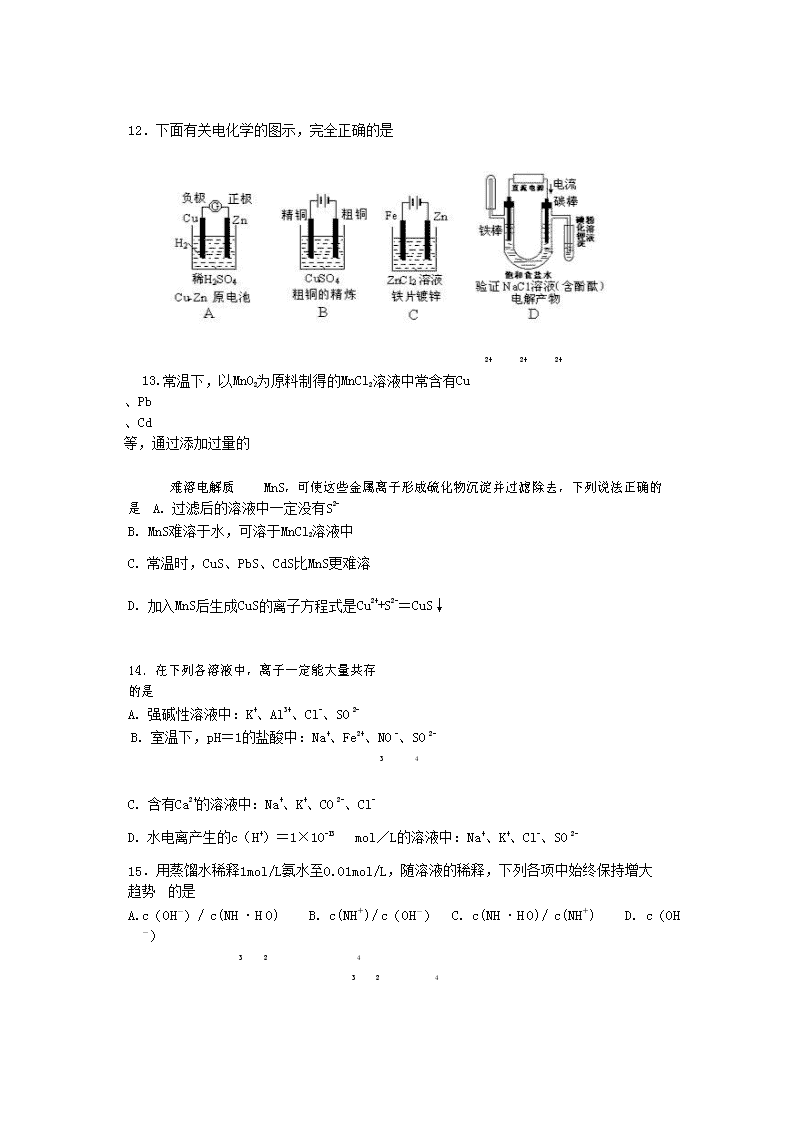
8 18 2 2 2
C.H (g)+1/2O (g)===H O(g) ΔH=-241.8 kJ·mol-1 D.2C H (l)+25O (g)===16CO (g)+18H O(l) ΔH=-11 036 kJ·mol-1
3.将有机物完全燃烧,生成 CO2 和 H2O。将 12 g 该有机物的完全燃烧产物通过浓 H2SO4,浓 H2SO4
增重 14.4 g,再通过碱石灰,碱石灰增重 26.4 g。则该有机物的分子式为( ) A.C4H10 B.C2H6O
C.C3H8O D.C3H8
4.下列各反应达到化学平衡,加压或降温都能使化学平衡向逆反应方向移动的是
A. 2NO2N2O4(正反应为放热反应) B. C(s)+CO22CO(正反应为吸热反应) C. N2+3H22NH3(正反应为放热反应) D. H2SH2+S(s)(正反应为吸热反应)
5.反应 A(g)+B(g) 2C(g)+3D(g)在四种不同情况下的反应速率如下,其中表示 反应速率最快的是
A.v(A)=0.20mol·L-1·min-1 B.v(B)=0.30 mol·L-1·min-1 C.v(C)=0.40 mol·L-1·min-1 D.v(D)=0.50 mol·L-1·min-1
6.下列说法可以证明反应 N2(g)+3H2(g)2NH3(g)已达到平衡状态的是
A.1 个 N≡N 键断裂的同时,有 3 个 H—H 键形成 B.1 个 N≡N 键断裂的同时,有 3 个 H—H 键断裂
- 1 -
C.N2、H2、NH3 的分子数之比为 1∶3∶2 D.1 个 N≡N 键断裂的同时,有 6 个 H—N 键形成 7.可逆反应 mA(g)+nB(g) pC(g)+qD(g),如右图所示是 A 的转化率同压强、
温度的关系,分析图像结论正确是
A.正反应吸热,m+n>p+q B.正反应吸热,m+n
p+q D.正反应放热,m+n < p+q
8.在密闭容器中充入 A(g)和 B(g),它们的初始浓度均为 2 mol·L-1,在一定条件下发生反
应:A(g)+B(g) 2C(g),该温度下,此反应的平衡常数为 4,则 A 的转化率为 A.30% B.40% C.50% D.60%
9.下列各反应中属于水解反应的是
-﹣ + 2-
﹣- -
A. HCO3
+H2O H3O +CO3
B. HCO3
+H2O H2CO3+OH
-﹣ -﹣ 2- - +
C. HCO3
+OH
=H2O+CO3
D. HCO3 +H3O =2H2O+CO2↑
10.有 8 种物质:①甲烷;②苯;③聚乙烯;④聚异戊二烯;⑤2-丁炔;⑥环己烷;⑦邻二 甲苯;⑧环己烯。既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是
A.③④⑤⑧ B.④⑤⑧ C.④⑤⑦⑧ D.③④⑤⑦⑧ 11.对下列各溶液中,微粒的物质的量浓度关系表述正确的是
2- + + -
A.0.1 mol/L 的(NH4)2SO4 溶液中:c(SO4 )>c(NH4 )>c(H
)>c(OH )
+ - 2-
B.0.1 mol/L 的 NaHCO3 溶液中:c(Na
)=c(HCO3 )+c(H2CO3)+2c(CO3 )
C.将 0.2 mol/L NaA 溶液和 0.1 mol/L 盐酸等体积混合所得碱性溶液中: c(Na+)+c(H+)=c(A-)+c(Cl-)
- +
D.在 25℃0.1 mol/L 的 NH4Cl 溶液中:c(Cl
)=c(NH4 )+c(NH3·H2O)
12.下面有关电化学的图示,完全正确的是
2+ 2+ 2+
13.常温下,以 MnO2 为原料制得的 MnCl2 溶液中常含有 Cu
、Pb
、Cd
等,通过添加过量的
难溶电解质 MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是 A. 过滤后的溶液中一定没有 S2-
B. MnS 难溶于水,可溶于 MnCl2 溶液中
C. 常温时,CuS、PbS、CdS 比 MnS 更难溶
D. 加入 MnS 后生成 CuS 的离子方程式是 Cu2++S2-=CuS↓
14.在下列各溶液中,离子一定能大量共存的是
A. 强碱性溶液中:K+、Al3+、Cl-、SO 2-
B. 室温下,pH=1 的盐酸中:Na+、Fe2+、NO -、SO 2-
3 4
C. 含有 Ca2+的溶液中:Na+、K+、CO 2-、Cl-
D. 水电离产生的 c(H+)=1×10-13 mol/L 的溶液中:Na+、K+、Cl-、SO 2-
15.用蒸馏水稀释 1mol/L 氨水至 0.01mol/L,随溶液的稀释,下列各项中始终保持增大趋势 的是
A. c(OH-)/ c(NH ·H O) B. c(NH+)/ c(OH-) C. c(NH ·H O)/ c(NH+) D. c(OH-)
3 2 4
3 2 4
16.在 373 K 时,把 0.5 mol N2O4 通入体积为 5 L 的恒容真空密闭容器中,立即出现红棕色 气体。反应进行到 2 s 时,NO2 的浓度为 0.02 mol·L-1。在 60 s 时,体系达到平衡状态, 此时容器内的压强为开始时的 1.6 倍。下列说法错误的是()
A.前 2 s 以 N2O4 的浓度变化表示的平均反应速率为 0.005 mol·L-1·s-1 B.在 2 s 时体系内的压强为开始时的 1.1 倍
C.平衡时体系内含 N2O4 0.2 mol
D.平衡时,N2O4 的转化率为 40%
17.用铂电极电解下列溶液时,阴极和阳极上的主要产物分别为 H2 和 O2 的是
A. 稀 Na2SO4 溶液 B. 稀 HCl 溶液 C. CuCl2 溶液 D. AgNO3 溶液 18.下列有关说法正确的是
A. CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2(g)+3H2(g) 2NH3(g) ΔH<0,其他条件不变时升高温度,反应速率 v(H2)和 H2 的平 衡转化率均增大
D.水的离子积常数 KW 随着温度的升高而增大,说明水的电离是放热反应 19. 下列叙述中错误的是
A. 电解池的阳极上发生氧化反应,阴极上发生还原反应
B. 原电池跟电解池连接后,电子从电池负极流向电解池阳极 C. 电镀时,电镀池里的阳极材料发生氧化反应
D. 电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气
20.关于下列装置说法正确的是
A.装置①中,盐桥中的 Cl-移向 CuSO 溶液
B.装置②工作一段时间后,a 极表面生成了较多的 O2 C.用装置③精炼铜时,c 极为粗铜
D.装置④中电子由 Zn 流向 Fe,Zn 极发生氧化反应
二、非选择题(共 60 分) 21.(6 分)用化学知识填空:
(1) 丙烷通过脱氢反应可得丙烯。已知:①C3H8(g)===CH4(g)+C2H2(g)+H2(g) ΔH1=+156.6 kJ·mol-1
-1
②C3H6(g)===CH4(g)+C2H2(g) ΔH2=+32.4 kJ·mol
则相同条件下,反应 C3H8(g)===C3H6(g)+H2(g)的ΔH= kJ·mol
-1。
(2)写出 NaHCO3 水解的离子方程式: 。
(3)请写出 NH4Cl 溶液中各离子浓度的大小关系式:
(4)常温下,Na2CO3 溶液呈碱性,原因是 (用离子方程式表示)。
(5)①醋酸在水溶液中的电离方程式为 。
②下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是 (填字母序号)。 a. 滴加少量浓盐酸 b. 微热溶液 c. 加水稀释 d. 加入少量醋酸钠晶体
22.(5 分)(1)25℃时,0.05mol/LH2SO4 溶液的 pH= ,0.01mol/LNaOH 溶液的 pH= 。
(2)某温度下纯水的 c(H+)=4.0×10-7mol/L,则此溶液中的 c(OH-)= ;若温度不变,滴 入稀盐酸,使 c(H+)=2.0×10-4mol/L,则此溶液中由水电离产生的 c(H+)= 。
2+ -
(3)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) Cu
(aq)+2OH
(aq),
2+ 2 -
-20
2+ -1
常温下其 Ksp=c(Cu
�)·c (OH
)=2×10
。某硫酸铜溶液里 c(Cu
)=0.02 mol·L
,如要生
成 Cu(OH)2 沉淀,应调整溶液使之 pH>
23.(12 分)常温下,用 0.1000 mol/ L NaOH 溶液分别滴定
20.00 mL 0.1000 mol/L HCl 溶液和 20.00 mL 0.1000 mol/LCH3COOH 溶液,得到
2 条滴定曲线,如下图所示:
(1)由 A、C 点判断,滴定 HCl 溶液的曲线是 (填“图 1”或“图 2”); (2 )a= mL;
(3)c(Na+ )=c(CH COO-)的点是 ;
(4)E 点对应离子浓度由大到小的顺序为 。
3 3
(5)当 NaOH 溶液滴定 CH3COOH 溶液过程中,NaOH 溶液消耗了 10.00 mL 时,则此时混 合液中 c(CH COOH) c (CH COO-)(“>”或“<”或“=” )。
(6)在 25% 时,将 c mol/L 的醋酸溶液与 0.2mol/LNaOH 溶液等体积混合后溶液恰好星 中性,用含 c 的代数式表示 CH3COOH 的电离常数
Ka= 。
24.(7 分)在容积为 1.00L 的容器中,通入一定量的 N2O4,发生反 应 N2O4(g) 2NO2(g),随着温度升高,混合气体的颜色变深。 回答下列问题:
(1)反应的ΔH 0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化
如上图所示。在 0~60s 时段,反应速率 v(N2O4)= mol·L
�
-1·s
-1;反应的平衡常数
K= mol·L-1。
(2)100℃时达平衡后,改变反应温度为 T,c(N2O4)以 0.0020 mol·L
-1·s-1
的平均速率降低,
经 10s 又达到平衡。T 100℃(填“大于”或“小于”),判断理由是
。
(3)温度 T 时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或 “逆反应”)方向移动,判断理由是 。
- 5 -
25.(12 分)CH4﹣O2 燃料电池具有放电稳定,无污染等优点,如
图用甲烷氧气燃料电池电解饱和氯化钠溶液的模型图,其中氯化
钠溶液滴有酚酞试液。已知甲烷氧气燃料电池的总反应式为:CH4+2O2+2KOH K2CO3+3H2O 请 认真读图,回答以下问题:
(1)请写出通入甲烷气体的一极所发生的电极反应式: ,其附近的 pH 值 (填“不变”或“变大”或“变小”) 通入 O2 气体的一极所发生的电极反应式:
,其附近的 pH 值 (填“不变”或“变大”或“变小”)。
(2)a 为 极,电极反应式为 ;b 为 极,电极反应式为
,现象是 ;总方程式为 。
(3)如果通入 1mol 的甲烷完全参与电极反应,则电路中转移 mol 的电子,a 电 极产生的气体在标准状况下的体积为 L。
26.(10 分)用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量 10.0 g 含有少量易溶杂质的样品(杂质不与盐酸反应),配成 500mL 待测溶液。 称量时,样品可放在 (填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用 0.2000 mol/L 的盐酸来滴定待测溶液,不.可选用 (填编号字母)作指 示剂。
A.甲基橙 B.石蕊 C.酚酞
待测溶液
标准酸体积
滴定次数
体积(mL)
滴定前的刻度(mL)
滴定后的刻度(mL)
第一次
10.00
0.40
20.50
第二次
10.00
4.10
24.00
(3)滴定过程中,眼睛应注视 ;在铁架 台上垫一张白纸,其目的是 。 (4)根据下表中数据,计算被测烧碱溶液的物质的量浓度是 mol/L,烧碱样品的纯度 是 。
(5) 在中和滴定操作过程中,有以下各项因操作不当引起的实验误差,用“偏高”、“偏低” 或“无影响”等填空:
①滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果 。
②锥形瓶未用待装溶液润洗,使滴定结果 。
③装标准溶液的滴定管在滴定前尖嘴处有气泡,滴定终了无气泡,使滴定结果 。
④滴定前平视凹液面,滴定终了俯视凹液面,使滴定结果 。
27.(8 分)如图所示 3 套实验装置,分别回答下列问题。
(1)装置 1 为铁的吸氧腐蚀实验,一段时间后,玻璃筒内的石墨电极上的电极反应式为
。
(2)装置 2 中的石墨是 极,该电极反应式为 。
(3)装置 3 中甲烧杯盛放 100mL0.2mol/L 的 NaCl 溶液,乙烧杯盛放 100mL0.5mol/L 的 CuSO4 溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变 红。
①电源的 M 端为 极;甲烧杯中铁电极的电极反应为 。
②乙烧杯中电解的总方程式为 。
③停止电解,取出 Cu 电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准 状况下体积为 mL。
高二化学参考答案
1
2
3
4
5
6
7
8
9
10
B
A
C
B
B
A
A
C
B
B
11
12
13
14
15
16
17
18
19
20
D
D
C
D
A
D
A
B
B
D
21. (1) 124.2 kJ·mol-1
- -
(2) HCO3
+H2O H2CO3+OH
+ + -
(3) c(Cl-)>c(NH4 )>c(H
)>c(OH )
﹣2- - -
(4) CO3
+H2O HCO3 +OH
(5))CH COOHCH COO-+H+ bc
3 3
22.(1) 1 12 (2)4.0×10-7mol/L 8.0×10-10 mol/ l (3)5
23(1)图 1 (2)20.00 (3)D (各 2 分)
(4)c(Na+)>c(CH3COO-)>c(OH-)>c(H+) (5)< (各 2 分)
2 ×10-9
(6) (c- 0.02) (其他合理答案也给分) (2 分)
24.(1)A BC
(2)负极 Zn-2e- == Zn2+ 正极 Cu2++2e- == Cu Zn + Cu2+ == Zn2+ +Cu
电解
(3) CuCl2=== Cu + Cl2↑
(4)阴极 Cu2++2e- == Cu 阳极 Cu-2e- == Cu2+
﹣ ﹣ 2﹣
25 .(1)(1). CH4﹣8e
+10OH
═CO3
+7H2O 变小
2 2
O +2H O+4e-
=4OH- 变大
(2)阳极 2Cl--2e- = Cl2↑ 阴极 2H++ 2e- = H2
↑ b 电极附近变红
电解 2NaCl+2H2O==2NaOH+ H2↑ + Cl2↑ (3). 8mol . 89.6L
25 .(1)A (2) B
(3)锥形瓶中溶液颜色的变化 对比,便于观察溶液颜色的变化
(4)0.4020 mol/L 0.804
(5)偏高、 无影响 偏高 偏低
2 2
27.(1)O +2H O+4e-
=4OH-
(2)正 2Fe3++Cu=2Fe2++Cu2+
(3)正 Fe-2e-=Fe2+
. 2Cu2++2H O2Cu+O ↑+4H+ 224ml(2 分)
2 2