- 2023-12-17 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年黑龙江省齐齐哈尔市第八中学校高二下学期6月月考化学试题(Word版)
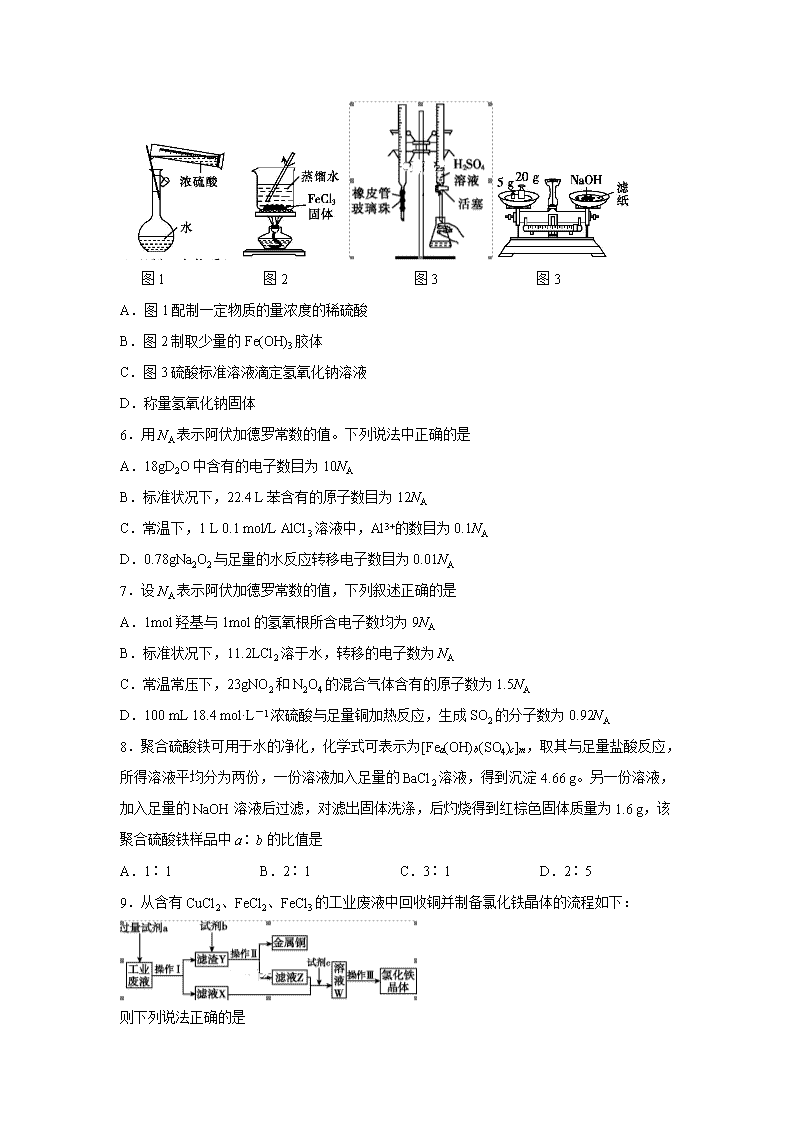
黑龙江省齐齐哈尔市第八中学2018—2019学年度下学期六月月考 高二化学试题 试卷说明: 1.本试卷考试时间为90分钟,满分为100分。 2.本试卷共8页,分为Ⅰ卷选择题和Ⅱ卷非选择题,请务必将答案写在答题卡上,否则视为无效答题。 3.可能用到的相对原子质量: H 1 C 12 O 16 S 32 K 39 Fe 56 Ba 137 Mn 55 Ⅰ卷(选择题42分) 一、选择题(每小题只有一个选项符合题意,每小题3分,共42分) 1.化学实验操作中必须十分重视安全问题。下列处理方法错误的是 A. 不慎打翻燃着的酒精灯,立即用湿抹布盖灭 B. 金属钠着火时,立即用泡沫灭火器进行灭火 C. 给盛有液体的试管加热时,要不断移动试管或加入碎瓷片 D. 浓碱液滴在皮肤上,立即用大量水冲洗,然后涂上3%~ 5%的硼酸溶液 2.实验室中,下列试剂的保存方法不正确的是 A.液溴需加水密封保存 B.浓硝酸保存在棕色细口瓶中 C.金属钠保存在煤油中 D.碳酸钠溶液保存在配有磨口玻璃塞的试剂瓶中 3.下列物质的分离(或提纯)方法正确的是 A.分离汽油和水-分液 B.除去氯化钠溶液中的泥沙-蒸馏 C.分离乙酸与乙酸乙酯-萃取 D.用四氯化碳提取溴水中的溴单质-过滤 4.下列情境中,对分离或提纯原理的说法错误的是 A.沙里淘金,利用了沙子和金子的密度不同 B.海水晒盐,利用了水和NaCl的沸点不同 C.海带提碘,利用了碘粒子的直径小于滤纸空隙的直径 D.油萃取维生素,利用了维生素在水和油中溶解度不同 5.下列仪器的使用或操作正确的是 图1 图2 图3 图3 A.图1配制一定物质的量浓度的稀硫酸 B.图2制取少量的Fe(OH)3胶体 C.图3硫酸标准溶液滴定氢氧化钠溶液 D.称量氢氧化钠固体 6.用NA表示阿伏加德罗常数的值。下列说法中正确的是 A.18gD2O中含有的电子数目为10NA B.标准状况下,22.4 L苯含有的原子数目为12NA C.常温下,1 L 0.1 mol/L AlCl3溶液中,Al3+的数目为0.1NA D.0.78gNa2O2与足量的水反应转移电子数目为0.01NA 7.设NA表示阿伏加德罗常数的值,下列叙述正确的是 A.1mol羟基与1mol的氢氧根所含电子数均为9NA B.标准状况下,11.2LCl2溶于水,转移的电子数为NA C.常温常压下,23gNO2和N2O4的混合气体含有的原子数为1.5NA D.100 mL 18.4 mol·L-1浓硫酸与足量铜加热反应,生成SO2的分子数为0.92NA 8.聚合硫酸铁可用于水的净化,化学式可表示为[Fea(OH)b(SO4)c]m,取其与足量盐酸反应,所得溶液平均分为两份,一份溶液加入足量的BaCl2溶液,得到沉淀4.66 g。另一份溶液,加入足量的NaOH溶液后过滤,对滤出固体洗涤,后灼烧得到红棕色固体质量为1.6 g,该聚合硫酸铁样品中a∶b的比值是 A.1∶1 B.2∶1 C.3∶1 D.2∶5 9.从含有CuCl2、FeCl2、FeCl3的工业废液中回收铜并制备氯化铁晶体的流程如下: 则下列说法正确的是 A.试剂a是铁,试剂b是稀硫酸 B.操作Ⅰ、操作Ⅱ、操作Ⅲ所用的仪器完全相同 C.试剂c是氯气,反应的离子方程式为2Fe2++Cl22Fe3++2Cl- D.用KSCN溶液可检验溶液W中是否有Fe2+ 10.下列实验过程可以达到实验目的的是 编号 实验目的 实验过程 A 配制0.4000 mol·L-1的NaOH溶液 称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250 mL容量瓶中定容 B 探究维生素C的还原性 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 C 制取并纯化氢气 向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液 D 探究浓度对反应速率的影响 向2支盛有5 mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5% H2O2溶液,观察实验现象 11.需要配制500 mL 0.5 mol/L 氢氧化钠溶液,经测定试剂氢氧化钠溶液的浓度为0.45 mol/L 。可能原因是 A. 定容时溶液没有冷却至室温 B. 容量瓶没有烘干 C. 称量氢氧化钠固体时砝码放反了 D. 定容时仰视读数 12.在一定条件下,某化合物X受热分解:2XA↑+2B↑+4C↑,测得反应后生成的混合气体对H2的相对密度为11.43,相同条件下,X的相对分子质量是 A. 11.43 B. 22.85 C. 80.01 D. 160.02 13.某地酸雨经检验除含H+外[c(OH-)可忽视]还有Na+、Cl-、NH4+、SO42-其浓度依次为:c(Na+)=2.3×10-5 mol/L,c(Cl-)=3.5×10-5 mol/L,c(NH4+)=2.3×10-5 mol/L,c(SO42-)=1.05×10-5 mol/L,则该地酸雨的pH为 A.3 B.4 C.5 D.6 14.16mL由NO与NH3组成的混合气体在催化剂作用下于400℃左右可发生反应:6NO+4NH35N2+6H2O(g),达到平衡时在相同条件下气体体积变为17.5mL,则原混合气体中NO与NH3的物质的量之比有四种情况:①5∶3 ②3∶2 ③4∶3 ④9∶7。其中正确的是 A.②③ B.③④ C.①② D.①④ Ⅱ卷(非选择题58分) 二、填空题(本大题共4个小题,共58分) 15.(14分)Ⅰ.某同学帮助水质检测站配制480mL0.5mol·L-1NaOH溶液以备使用。 (1)其操作步骤如乙图所示,则甲图操作应在乙图中的______(填选项字母)之间。 A.②与③ B.①与② C.③与④ (2)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在在下图中选出能正确表示游码位置的选项________(填字母)。 Ⅱ.现有下列A、B、C三种常用化学仪器: 请回答下列有关问题: (1)三种化学仪器中标有“0”刻度的为________(填名称)。 (2)三种化学仪器在使用时首先需要检验是否漏液的为________(填字母代号)。 (3)用三种化学仪器中的一种对液体体积进行计量,正确的读数为n mL,仰视读数为x mL,俯视读数为y mL,若y>n>x,则所用量器是________(填名称)。 Ⅲ.化学课外活动小组设计了如下图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性。 (1)实验前要检验装置Ⅰ的气密性,写出操作方法 。 (2)利用装置Ⅱ可直接收集CO2,进气口为_____________。 (3)以上三个装置可组成实验室制取NH3,利用装置Ⅲ吸收NH3时会发生倒吸,可向水中再加入一种液体可防止倒吸的发生,该液体为 (填化学式)。 16.(14分)Ⅰ.(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为________。 (2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为______________。 (3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为________。 Ⅱ.在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρ g·cm-3,计算该溶液的浓度(用以上字母表示)。 (1)该溶液的物质的量浓度 (2)该溶液的质量分数 Ⅲ.有两份溶液,其中所含溶质相同,设其摩尔质量为M g·mol-1。根据下表信息,回答有关问题: 溶质的质量分数 溶液的密度(g·cm-3) 第一份溶液 w1 ρ1 第二份溶液 w2 ρ2 (1)取等质量两份溶液混合,则所得混合液中溶质的质量分数w3=________。(用以上字母表示) (2)若有w1>w2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为w4,若ρ1>ρ2,则w3 w4;若ρ1<ρ2,w3 w4(填“>”“<”或“=”)。 17.(15分)Ⅰ.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图: (1)实验室灼烧海藻,需要下列仪器中的 (填字母)。 a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯 (2)指出提取碘的过程中有关的实验操作名称: ① ,③ 。 (3)提取碘的过程中,可选择的有机试剂是 。 A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油 (4)小组用CCl4萃取碘水中的碘,在分液漏斗中进行,下层液体呈 色;他们打开分液漏斗活塞,却未见液体流下,原因可能是 。 (5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处: ① ; ② ; ③ 。 (6)进行上述蒸馏操作时,使用水浴加热的原因是 ,最后晶态碘在 里聚集。 Ⅱ.海水开发利用可以提取NaCl和Mg(OH)2.。 (1)海水中提取的NaCl中若混有少量的KClO3固体(KClO3溶解度随温度变化大),可通过溶解、 、 等操作净化。 (2)生成Mg(OH)2用的沉淀剂一般是生石灰或熟石灰,所以Mg(OH)2沉淀中会混有Ca(OH)2,可通过反复洗涤去除Ca(OH)2,检验沉淀是否洗净的操作方法 。 18.[化学—选修3:物质结构与性质](15分)Ⅰ.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题: (1)写出基态As原子的核外电子排布式________________________。 (2)根据元素周期律,原子半径Ga______As,第一电离能Ga________As。(填“大于”或“小于”) (3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。 (4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是____________。 (5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1 和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。 Ⅱ.醋酸铜可合成复合材料石墨烯,其制备原料为、 和醋酸等。 (1)写出一种与 互为等电子体的分子 。 (2)二聚醋酸铜的结构示意图如图1所示,的配位数为 。 (3)石墨烯可转化为富勒烯, 和 K 能形成新型化合物,其晶胞如图2所示,晶胞参数为 a 该化合物中 K 原子和 分 子的个数比为______,该晶体的密度 ______ g/cm3(列出计算式) 高二化学答案 一、选择题(每小题只有一个选项符合题意,每小题3分,共42分) 题号 1 2 3 4 5 6 7 答案 B D A C C D C 题号 8 9 10 11 12 13 14 答案 A C B D C C A 15.(14分)Ⅰ (1) C (2)10.0 C Ⅱ(1)酸式滴定管 (2)BC (3)量筒 Ⅲ(1)先关闭活塞a,再由分液漏斗内向b中滴水,一段时间后若水不能滴下,证明装置气密性好。(2)d (3)CCl4 16.(14分) Ⅰ. (1)64 (2)30 g·mol-1 (3)44 g·mol-1 Ⅱ.(1)c==;(2)w=×100%=×100%; Ⅲ. (1) (2)(w1+w2)/2 (2) < > 17.(15分)Ⅰ. (1)cdef (2)过滤 萃取分液 (3)B (4)紫红 分液漏斗上口活塞凹槽未对准分液漏斗上口小孔 (5)①缺石棉网 ②温度计插到了液体中 ③冷凝管进出水的方向颠倒 (6)使蒸馏烧瓶受热均匀,控制加热温度不至过高 蒸馏烧瓶 Ⅱ.(1)蒸发结晶、趁热过滤、 (2)取最后的洗液,滴加Na2CO3溶液,若不出现白色沉淀则没有洗净。 18.(15分) Ⅰ.(1)1s22s22p63s23p63d104s24p3;(2) 大于,小于; (3)三角锥形,sp3;(4)GaF3是离子晶体,GaCl3是分子晶体,离子晶体GaF3的熔沸点高;(5)原子晶体;共价键;。Ⅱ.(1) (2) 5 (3) 3:1 或其它查看更多