- 2023-11-16 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
氮肥的生产和使用教学案
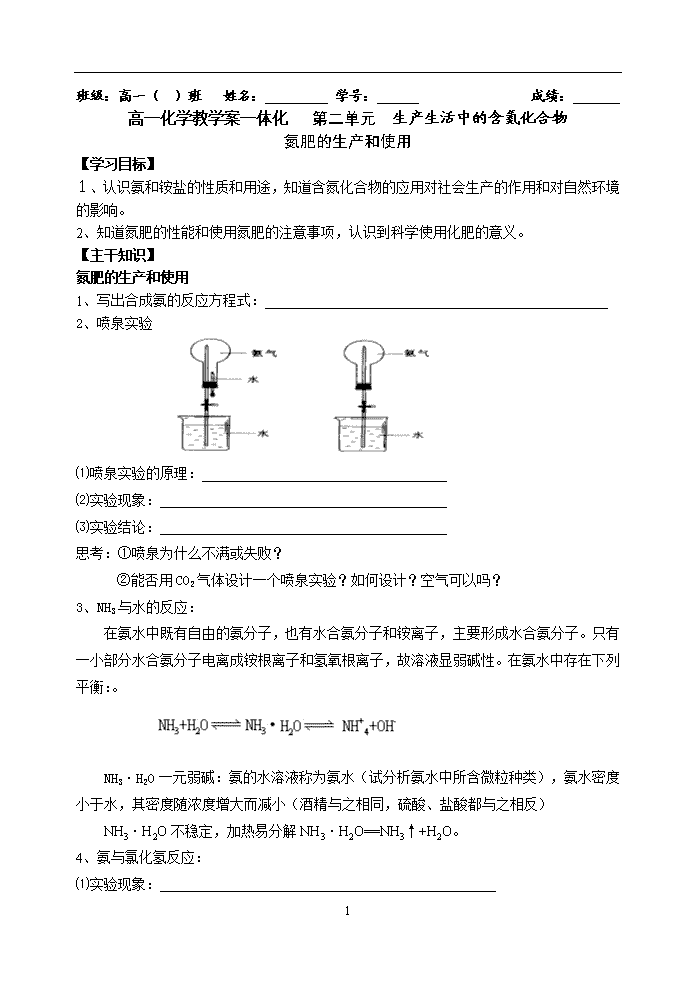
班级:高一( )班 姓名: 学号: 成绩: 高一化学教学案一体化 第二单元 生产生活中的含氮化合物 氮肥的生产和使用 【学习目标】 1、认识氨和铵盐的性质和用途,知道含氮化合物的应用对社会生产的作用和对自然环境的影响。 2、知道氮肥的性能和使用氮肥的注意事项,认识到科学使用化肥的意义。 【主干知识】 氮肥的生产和使用 1、写出合成氨的反应方程式:_________________________________________________ 2、喷泉实验 ⑴喷泉实验的原理: ⑵实验现象: ⑶实验结论: 思考:①喷泉为什么不满或失败? ②能否用CO2气体设计一个喷泉实验?如何设计?空气可以吗? 3、NH3与水的反应: 在氨水中既有自由的氨分子,也有水合氨分子和铵离子,主要形成水合氨分子。只有一小部分水合氨分子电离成铵根离子和氢氧根离子,故溶液显弱碱性。在氨水中存在下列平衡:。 NH3·H2O一元弱碱:氨的水溶液称为氨水(试分析氨水中所含微粒种类),氨水密度小于水,其密度随浓度增大而减小(酒精与之相同,硫酸、盐酸都与之相反) NH3·H2O不稳定,加热易分解NH3·H2O==NH3↑+H2O。 4、氨与氯化氢反应: ⑴实验现象: 4 ⑵实验结论: ⑶化学反应方程式: ⑷氨与酸反应的实质是: ⑸氨气的检验方法: 铵盐的性质 1、铵盐的热解:(一般规律) (1)若为非氧化性酸形成的铵盐,受热分解成NH3和对应的酸。(酸不稳定继续分解);(2)若为氧化性酸形成的铵盐,受热分解发生氧化—还原反应,产物复杂一般不要求同学们掌握。 2、铵盐的碱解 实质:与碱反应:NH4+ + OH-△ NH3↑+ H2O 注意:①该反应要生成NH3,必须要有加热条件,否则只能写成NH3·H2O ②该反应有何重要应用?一是实验室利用该反应来制取NH3,二是利用该反应检验或鉴定NH4+,请你说出鉴定NH4+方法? 【精彩例题】 例1下列反应起了氮的固定作用的是 A.氮气和氢气在一定条件下反应生成氨气 B.一氧化氮与氧气反应生成二氧化氮 C.氨气被氧化为一氧化氮 D.由氨气制碳酸氢铵、硫酸铵和尿素 E.闪电时大气中氮的氧化物的生成 F.豆科植物的根瘤菌把大气中的氮转化成氨 例2密度为0.9g/cm-3的氨水,质量分数为25%,设氨水用等质量的水稀释后,所得溶液的溶质的质量分数为 ( ) A、等于12.5% B、大于12.5% C、小于12.5% D、无法确定 例3标准状况下,将X L NH3溶于1LH2O中,制得密度为0.90 g·cm-3浓度为12mol·L-1的氨水,求:X=? 【达标提高】 1、“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质是 A.氯化钠 B.固体硝酸铵 C.固体氢氧化钠 D.生石灰 2、在1L1mol/L氨水中 A.含1molNH3氨分子 B.含NH3和NH4+之和为1mol 4 C.含1molNH3·H2O D.NH3、NH3·H2O、NH4+之和为1mol 3、下列各组气体在常温下,极易发生非氧化还原反应而不能共存的是 A.硫化氢和二氧化硫 B.一氧化氮和氧气 C.氨气和氯化氢 D.氯气和硫化氢 4、下列物质中, 既能和盐酸反应, 又能和NaOH溶液反应的是 ①NaHCO3 ②Al2O3 ③Al(OH)3 ④Ca(HCO3)2 ⑤(NH4)2S A.有②③④⑤ B.有④和⑤ C.有①②③ D.全部 5、喷泉实验时烧瓶中充入a气体,滴管中盛放b溶液,烧杯中盛放b溶液,当把滴管中a溶液挤入烧瓶中,不能形成喷泉实验的是 A.a:氨气 b:水 B.a:二氧化硫 b:氢氧化钠水溶液 C.a:二氧化氮 b:水 D.a:氯气 b:氯化钠水溶液 6、某温度下,在体积一定的密闭容器中适量的NH3(气)和Cl2(气)恰好完全反应若反应产物只有N2(气)和NH4Cl(固),则反应前后容器中压强比应接近于 A.1:11 B.11:1 C.7:11 D.11:7 7、固体混和物,可能有氯化钙、碳酸铵、烧碱、硫酸铵,将它溶解于水得到无色澄清溶液,无其它明显现象,向溶液中加入硝酸钡溶液,产生白色沉淀,再加入硝酸,沉淀部分消失,原混和物中肯定有 A.CaCl2 和(NH4)2SO4 B.(NH4)2SO4 和(NH4)2CO3 C.NaOH和CaCl2 D.NaOH和(NH4)2SO4 8、气体X可能由NH3、Cl2、H2S、HBr、CO2中的一种或几种组成。已知:X通入AgNO3溶液时产生淡黄色沉淀,该沉淀不溶于稀硝酸;若将X通入澄清石灰水,却不见沉淀产生。则有关X的成分,下列说法正确的是 ① 一定有HBr,可能有CO2 ②一定不含CO2 ③一定不含NH3、Cl2、H2S ④ 可能含CO2、Cl2 A.只有① B.只有③ C.①和③ D.②和③ 9、标准状况下, VL氨气被1L水吸收后, 测得所得氨水的密度为d g/cm3, 则氨水的物质 的量浓度可表示为______________mol/L; 氨水中溶质的质量分数可表示为_________%.(本题中氨的式量以 17.0计,水的密度以1.00g·cm-3计) 10、某气体可能含有CO、CO2、NH3、HCl、H2和H2O(g)中的一种或几种,当依次通过澄清石灰水(无浑浊现象)、Ba(OH)2 4 (有浑浊现象)、浓硫酸、灼热的CuO(变红)和无水CuSO4(变蓝)时,则可断定该混合物中一定有__________,可能有_________,一定没有_________ 11、有下列实验装置: 盐酸 还原铁粉 a D 锌粒 干燥剂 E酚酞试液 A B C 示意图中A是简易的氢气发生器,B是大小适宜的园底烧瓶,C是装有干燥剂的U形管, a是旋转活塞,D是装有还原铁粉的反应管,E是装有酚酞试液的试管。实验前先检查实 验装置的气密性。实验开始时,先关闭活塞a,并取下烧瓶B,向A中加入一定量浓度适 当的盐酸,发生氢气,经必要的“操作”[见问题(2)]后,在导管的出口处点燃氢气,然 后如图所示套上烧瓶B,塞紧瓶塞,氢气在烧瓶中继续燃烧。用酒精灯加热反应管D中的 还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入试管E中,使 酚酞试液呈红色。请回答下列问题: (1)实验前如何检查实验装置的气密性? 答: (2)点燃氢气前必须进行 操作,进行该操作的方法是 。 (3)写出B、D中分别发生的化学方程式: B中: D中: (4)C中所盛干燥剂的名称是 ,该干燥剂的作用是 ____ 4查看更多