- 2021-06-25 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学命题热点提分攻略专题09化学反应速率和化学平衡最新试题
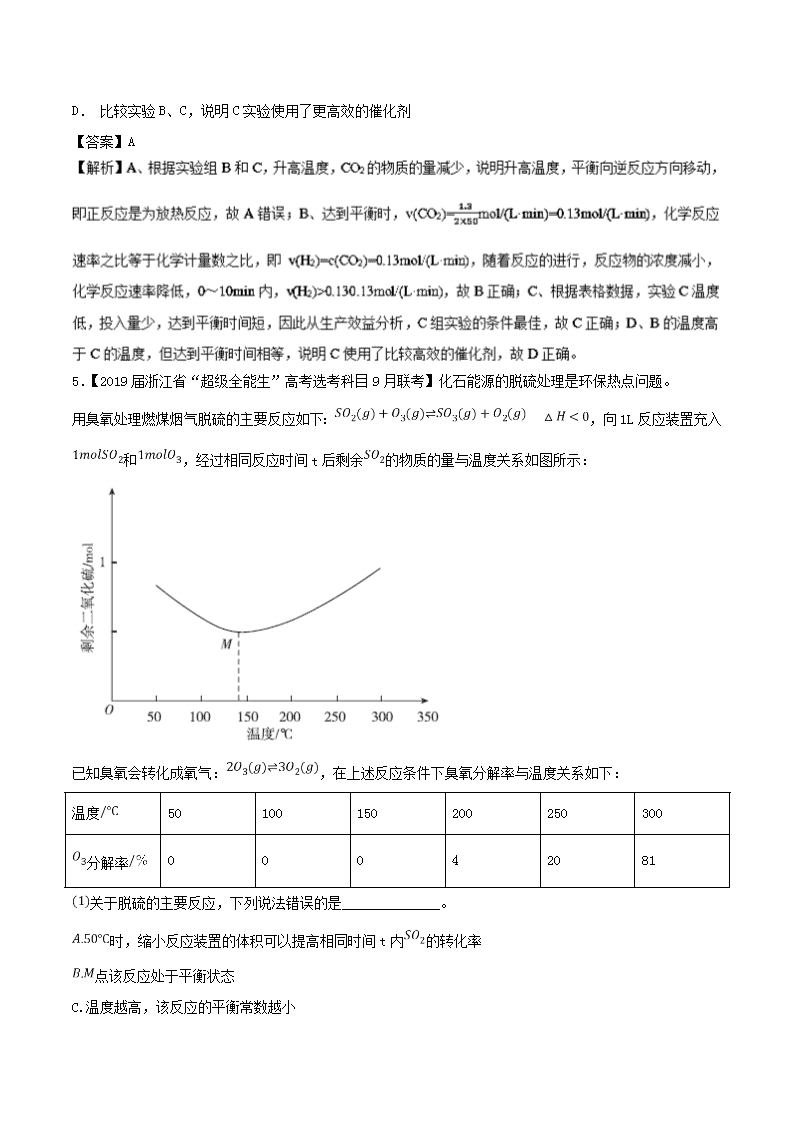
专题9 化学反应速率和化学平衡 1.【2019届浙江省“超级全能生”高考选考科目9月联考】在恒温恒容容器中发生反应 ,下列说法不正确的是( ) A. 容器内压强不再变化,说明反应达到平衡状态 B. 当::2且保持不变,不能表明反应达到平衡状态 C. 加入合适的催化剂可显著增大反应速率 D. 达到平衡状态时,相同时间内,每消耗的同时生成 【答案】B 【点睛】本题考查的是化学反应速率和平衡的影响因素及平衡的判断,有一定的难度。 2.【2019届河北省武邑中学高三上学期第二次调研考试】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)C(g)+D(g)己达到平衡状态的是( ) ①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1 : 1 A. ①③④⑤ B. ①③④⑤⑧⑨ C. ①②③④⑤⑦ D. ①②③④⑤⑥⑦⑧ 【答案】A 【解析】①该反应为气体体积缩小的反应,压强为变量,当混合气体的压强不变时,说明各组分的浓度不再变化,该反应达到平衡状态,故①正确;②该反应前后都是气体,混合气体总质量不变,容器容积不变,则密度为定值,不能根据混合气体的密度判断平衡状态,故②错误;③B的物质的量浓度不变时,说明正逆反应速率相等,该反应达到平衡状态,故③正确;④该反应为气体体积缩小的反应,混合气体的物质的量为变量,当混合气体的总物质的量不变时,说明各组分的浓度不再变化,该反应达到平衡状态,故④正确;⑤混合气体的总质量不变,总物质的量为变量,则混合气体的平均相对分子质量为变量,当混合气体的平均相对分子质量不变时,说明各组分的浓度不再变化,达到平衡状态,故⑤正确;⑥v(C)与v(D)的比值始终不变,不能说明各组分的浓度不再变化,则无法判断平衡状态,故⑥错误;⑦ 反应前后都是气体,混合气体的总质量始终不变,不能根据混合气体的总质量判断平衡状态,故⑦错误;⑧容器容积不变,则混合气体的总体积为定值,不能根据混合气体总体积判断平衡状态,故⑧错误;⑨C、D的分子数之比为1:1,无法判断各组分的浓度是否发生变化,则无法判断平衡状态,故⑨错误;故选A。 【点睛】本题考查化学平衡状态的判断,,明确化学平衡状态的特征为解答关键。本题的易错点为⑥和⑨,要注意判断的物理量是否为变量,即随时间的变化而变化。 3.【2019届湖南湖北八市十二校高三第一次调研联考】氟利昂是饱和碳氢化台物的卤族衍生物的总称,其破坏臭氧层的化学反应机理如下(以F-12 (二氯二氟甲烷)为例): CF2Cl2CF2Cl+Cl Cl+O3→ClO+O2 ClO+ClO→ClOOCl(过氧化氯) ClOOCl2Cl+O2 下列说法中不正确的是 A. 紫外线可以增大CF2Cl2的分解速率 B. ClO +ClOClOOC1的反应中有非极性键的形成 C. CF2Cl2是臭氧破坏反应的催化剂 D. 臭氧屡破坏的关键因素有:氟利昂,太阳光 【答案】C 4.【2019届浙江省嘉兴市高三上学期9月份考试】CO(g)和H2O(g)以1 : 2体积比分别通入到体积为2 L的恒容密闭容器中进行反应:CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据: 下列说法不正确的是 A. 从实验数据分析,该反应的正反应是吸热反应 B. 实验A中,在0~10min内,以v(H2)表示的反应速率大于0.013mol(L·min)-1 C. 从生产效益分析,C组实验的条件最佳 D. 比较实验B、C,说明C实验使用了更高效的催化剂 【答案】A 5.【2019届浙江省“超级全能生”高考选考科目9月联考】化石能源的脱硫处理是环保热点问题。 用臭氧处理燃煤烟气脱硫的主要反应如下: ,向1L反应装置充入和,经过相同反应时间t后剩余的物质的量与温度关系如图所示: 已知臭氧会转化成氧气:,在上述反应条件下臭氧分解率与温度关系如下: 温度 50 100 150 200 250 300 分解率 0 0 0 4 20 81 关于脱硫的主要反应,下列说法错误的是______________。 时,缩小反应装置的体积可以提高相同时间t内的转化率 点该反应处于平衡状态 C.温度越高,该反应的平衡常数越小 随温度的升高,正反应速率变大,逆反应速率减小 以后随着温度升高,的物质的量增多的原因可能是______________________。 已知时的平衡常数,求该温度下反应的平衡常数__________。 其他条件不变,经过相同反应时间,在图中画出剩余的物质的量在点温度范围内的关系趋势图____________。 烟气脱硫后续还需用碱液吸收形成,溶液pH为之间时在电解池阴极上被还原成连二硫酸根,写出该电极反应式:___________________________。 【答案】D反应放热,到达平衡状态后,温度升高平衡逆向移动,增多;高于时,分解成,反应物浓度减小,平衡逆向移动,增多。0.55 大,故D错误。故选D。 反应放热,到达平衡状态后,温度升高平衡逆向移动,增多;高于时,分解成,反应物浓度减小,平衡逆向移动,增多; 已知时分解率为,由可知,反应之初,分解,剩余,生成。设转化浓度为,则: 初始浓度 1 0 转化浓度 x x x x 平衡浓度 x 该反应平衡常数,解得 所以平衡时 ,。则的平衡常数; 由题意可知,其他条件不变,经过相同反应时间,剩余的物质的量在点温度范围内可能继续减少,然后达到平衡后随温度升高反应逆向移动,剩余的物质的量再增加,如曲线;经过相同反应时间,剩余的物质的量在点温度范围内也可能在达到平衡后继续增加,如曲线。 由题意可知,电解质溶液为酸性,在阴极得电子被还原为,电极反应式为。 【点睛】本题主要考查可逆反应的化学平衡问题,内容涉及影响化学平衡移动的因素、影响化学反应速率的因素、反应物转化率、化学平衡常数的计算和电极反应式的书写等。解答本题需要熟练掌握和应用化学平衡移动基本原理、化学平衡常数表达式和计算方法以及电化学中电极反应式的书写方法。 6.汽车尾气脱硝脱碳主要原理为2NO(g)+2CO(g) N2(g)+2CO2(g) +Q(Q>0)。一定条件下密闭容器 中,用传感器测得该反应在不同时间 NO 和 CO 浓度如下表: 时间/s 0 1 2 3 4 c(NO)/mol∙L-1 9.50×10-3 4.50×10-3 2.50×10-3 1.50×10-3 1.50×10-3 c(CO)/mol∙L-1 9.00×10-3 4.00×10-3 2.00×10-3 1.00×10-3 1.00×10-3 完成下列填空: (1) 写出该反应的平衡常数表达式:_________。 温度升高,二氧化碳气体的浓度将______(填“变大”、“变小”或“不变”)。 (2)前 2s 内的氮气的平均反应速率是:v(N2)=______mol/(L∙s);达到平衡时,CO 的转化率为:_____。 (3)工业上常采用“ 低温臭氧氧化脱硫脱硝” 技术来同时吸收 SO2 和氮的氧化物气体(NOx ),以获得(NH4)2SO4 的稀溶液。在此溶液中,水的电离程度是受到了_____(填“促进”、“抑制”或“没有影响”); 若往(NH4)2SO4溶液中再加入少量稀盐酸,则值将_____(填“变大”、“变小”或“不变”)。 (4)如果向 BaCl2 溶液中通入足量 SO2 气体,没有沉淀生成,继续滴加一定量的氨水后,则会生成白色沉淀。用平衡移动原理解释上述现象:___________________________。 (5)向另一种可溶性钡盐溶液中通入少量 SO2 气体,会立即看到白色沉淀。该沉淀的化学式为_____; 原可溶性钡盐可能是_____。 【答案】变小1.75×10-30.89促进变大饱和SO 2溶液中电离产生的SO32 -很少 ,因此没有沉淀;加入氨水后,促进H2SO3的电离,SO32 -离子浓度增大,有沉淀产生 。BaSO4Ba(NO3)2 (2)前 2s 内c(NO)的变化量为9.50×10-3-2.50×10-3=7.0×10-3mol∙L-1,v(NO)= 7.0×10-3/2=3.5×10-3 mol/(L∙s),根据速率之比和系数成正比规律可知,v(N2)=1/2 v(NO)= 1/2×3.5×10-3 mol/(L∙s)= 1.75×10-3 mol/(L∙s);根据图表信息可知,反应进行到3s后达到平衡状态,c(NO)的变化量为9.00×10-3-1.00×10-3=8.00×10-3 mol∙L-1,CO 的转化率为:8.00×10-3/9.00×10-3=0.89;正确答案:1.75×10-3;0.89 。 (3)(NH4)2SO4属于强酸弱碱盐,NH4+的水解促进了水的电离;溶液中加入稀盐酸后,H+浓度增大,NH4+的水解受到抑制,溶液中的NH4+浓度增大,所以值变大;正确答案:促进;变大。 (4)饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀;加入氨水后,溶液中的H+与氨水中的OH-结合,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生;正确答案:饱和SO 2溶液中电离产生的SO32 -很少 ,因此没有沉淀;加入氨水后,促进H2SO3的电离,SO32 -离子浓度增大,有沉淀产生 。 (5)BaSO3的溶解度大于BaSO4 溶解度,所以向溶液中通入少量的SO2就立即产生的白色沉淀是BaSO4;硫元素化合价由正4价升变为正6价,化合价升高,说明硫元素被溶液中含有的具有氧化性的离子氧化,所以原可溶性钡盐可能是Ba(NO3)2;正确答案:BaSO4;Ba(NO3)2。 【点睛】二氧化硫与氯化钡溶液不反应,因为亚硫酸的酸性弱于盐酸;二氧化硫与硝酸钡溶液反应,因为在酸性条件下,硝酸根离子具有强氧化性,能够把二氧化硫氧化为硫酸根离子,其与钡离子结合为硫酸钡白色沉淀,所以笼统地说可溶性钡盐与二氧化硫不反应是错误的。 7.【2019届江西省红色七校高三第一次联考】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。 (1)目前工业上有一种方法是用CO和H2在230℃,催化剂条件下转化生成甲醇蒸汽和水蒸气。图一表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图。写出该反应的热化学方程式__________________________________________。 (2)“亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图二所示。 请写出a点时n(HSO3-):n(H2SO3)=_____,b点时溶液pH=7,则n(NH4+):n(HSO3-)=_____。 (3)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示: ① 请写出N2的电子式________。 ② 曲线c对应NH3与NO的物质的量之比是______。 ③ 曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____mg/(m3·s)。 (4)间接电化学法可除NO。其原理如图四所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性,加入HSO3-,出来S2O42-):________________________________ ____。 【答案】CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49kJ/mol 1:13:1 1:3 1.5×10-4 2HSO3-+2e-+2H+=S2O42-+2H2O b点时溶液的pH=7,根据电荷守恒可知n(NH4+ )= n(HSO3-)+2n(SO32-),又根据图象曲线可知: n(SO32-)= n(HSO3-),则n(NH4+ )=3n(HSO3-),所以n(NH4+ ):n(HSO3-)=3:1; 因此,本题正确答案是:1:1 ;3:1; (3)① N2的电子式:; ②n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,NO的含量越来越大,去除率越来越低,曲线c对应NH3与NO的物质的量之比是1:3,其NO的去除率最低; ③曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为=1.5×10-4mg/(m3·s)。 因此,本题正确答案是:;1:3 ;1.5×10-4; (4)电解池阴极发生还原反应,硫元素化合价降低,由于阴极室溶液呈酸性,所以电极反应式为: 2HSO3-+2e-+2H+=S2O42-+2H2O。 因此,本题正确答案是:2HSO3-+2e-+2H+=S2O42-+2H2O。 【点睛】本题考查较为综合,涉及氧化还原反应,热化学方程式、反应速率、电化学等知识,对图像的正确分析和理解是解题的关键,注意把握图象中各条曲线的含义以及溶液中电荷守恒的应用。 8.(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________。 (2)25℃时,利用pH试纸测得0.1mol•L-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。 (3)电化学法是合成氨的一种新方法,其原理如图所示,阴极的电极反应式是_____。 (4)废水中含氮化合物的处理方法有多种。 ① NaClO溶液可将废水中的NH4+转化为N2。若处理过程中产生N2 0.672 L(标准状况),则需要消耗0.3 mol·L-1的NaClO溶液______________L。 ②在微生物的作用下,NH4+经过两步反应会转化为NO3-,两步反应的能量变化如图所示。则1 mol NH4+(aq)全部被氧化成NO3-(aq)时放出的热量是______________kJ。 ③ 用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH______(填“升高”、“降低”或“不变”)。 (5)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。若某次捕捉后得到pH=10 的溶液,则溶液c(CO32-)∶c(HCO3-)=_______。 [常温下K1(H2CO3)=4.4×10-7、 K2(H2CO3)=5×10-11]。 【答案】1:10 10-5mol·L-1 减小 N2+6H++6e- = 2NH3 0.3346 升高 1:2或0.5 (2)25℃时,利用pH试纸测得0.1mol•L-1醋酸溶液的pH约为3,弱电解质存在电离平衡,CH3COOH⇌CH3COO-+H+,常数Ka=,醋酸溶液的pH约为3,氢离子和醋酸根离子浓度为10-3mol/L,溶液中醋酸溶质浓度近似为0.1mol/L,则可以估算出醋酸的电离常数约为 =10-5mol/L,向10mL此溶液中加入少量冰醋酸,溶解后醋酸溶液浓度增大,醋酸电离程度减小,比值减小; (3) 根据氢离子移动方向可知,通入氢气端为阳极,通入氮气端为阴极,阴极上氮气得到电子生成氨气,电极反应式为N2+6H++6e- = 2NH3; (4)①N失去电子,Cl得到电子,设消耗0.3mol•L-1的NaClO溶液为xL,由电子守恒可知,0.3mol×xL×2=×2×3,解得x=0.3; ②由图可知,第一步热化学反应为NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-273 kJ•mol-1①,第二步热化学反应为NO2- (aq)+0.5O2(g)=NO3- (aq)△H=-73kJ•mol-1②,由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式为NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ•mol-1,即放出346kJ的热量; ③H2催化还原饮用水中NO3-,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3-N2+4H2O+2OH-,氢氧根离子浓度增大,则pH升高; (5)若某次捕捉后得到pH=10 的溶液,则溶液酸碱性主要决定CO32-+ H2O HCO3-+ OH-,K=,c(CO32-)∶c(HCO3-)=。 9.工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。通过对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。 (1)反应2NO2(g) N2(g)+2O2(g),设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。 则A点时,NO2的转化率为_______________,B点时,设容器的总压为a Pa,则平衡常数Kp为____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。 (2)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下,下列反应能自发进行:CO2 (g)+3H2(g)CH3OH(g) +H2O(g)。 ①该反应ΔH_______0(填“>”、“<”或“=”) ②下列叙述能说明此反应达到平衡状态的是____________。(填字母) a.混合气体的平均相对分子质量保持不变 b.1 mol CO2生成的同时有3 mol H—H键断裂 c.CO2的转化率和H2的转化率相等 d.混合气体的密度保持不变 ③ 反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表: 反应时间 CO2/mol H2/mol CH3OH/mol H2O/mol 反应Ⅰ:恒温恒容 0 min 2 6 0 0 10 min 4.5 20 min 1 30 min 1 反应Ⅱ:绝热恒容 0 min 0 0 2 2 反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______________________________。达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)____________K(II)(填“>”、“<”或“=”);平衡时CH3OH的浓度c(I)____________c(II)(填“>”、“<”或“=”)。 【答案】50% a Pa < ab 0.025 mol·L-1 ·min-1 > > 应能自发进行,所以∆H-T∆S<0,则∆H<0;② a、混合气体的平均相对分子质量=气体总质量÷物质的量,该反应的反应物和生成物都是气体,物质的量变化,根据质量守恒定律,所以混合气体的平均相对分子质量变化,则当混合气体的平均相对分子质量保持不变时,达到了平衡状态,故a正确;b、1molCO2生成同时有3molH-H键断裂,即消耗3molH2,根据化学反应方程式,能说明正逆反应速率相等,则达到了平衡状态,故b正确;c、开始充入2molCO2和6molH2,投料比等于化学方程式系数比,CO2和H2的转化率始终相等,不能说明正逆反应速率相等,不一定达到平衡状态,故c错误;d、混合气体的密度等于气体质量和体积的比值,反应前后质量守恒,体积不变,所以密度始终不变,密度保持不变时不一定是平衡状态,故d错误。答案选ab;③由表中数据可知,反应Ⅰ前10min内反应的H2为:(6-4.5)mol=1.5mol,根据化学方程式可得,生成CH3OH为:=0.5mol,前10min内的平均反应速率v(CH3OH)==0.025 mol•L-1•min-1;前面已知该反应∆H<0,为放热反应,又因为反应Ⅰ为恒温恒容条件,反应Ⅱ为绝热恒容条件,所以反应Ⅱ相当于升温,化学平衡常数减小,故K(I)>K(II);反应Ⅱ中若把CH3OH和H2O(g)的初始物质的量全部转化为CO2和H2,与反应Ⅰ初始物质的量对应相等,但反应Ⅱ温度高于反应Ⅰ,所以反应Ⅱ相当于在和反应Ⅰ等效的基础上又升高温度,平衡逆向移动,故平衡时CH3OH的浓度c(I)>c(II)。 【点睛】本题是一道有关化学平衡的综合题,主要考查了热化学方程式书写、化学平衡影响因素的分析判断、化学平衡状态的判断、化学平衡有关计算等。注意①根据盖斯定律书写热化学方程式、计算ΔH;②明确用平衡分压代替平衡浓度表示化学平衡常数(Kp)的方法;③注意恒温恒容和恒容绝热容器的分析判断,对放热反应,绝热恒容条件,温度升高则化学平衡常数减小、正反应程度减小。查看更多