- 2021-06-25 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年宁夏银川一中高一上学期期末考试化学试卷
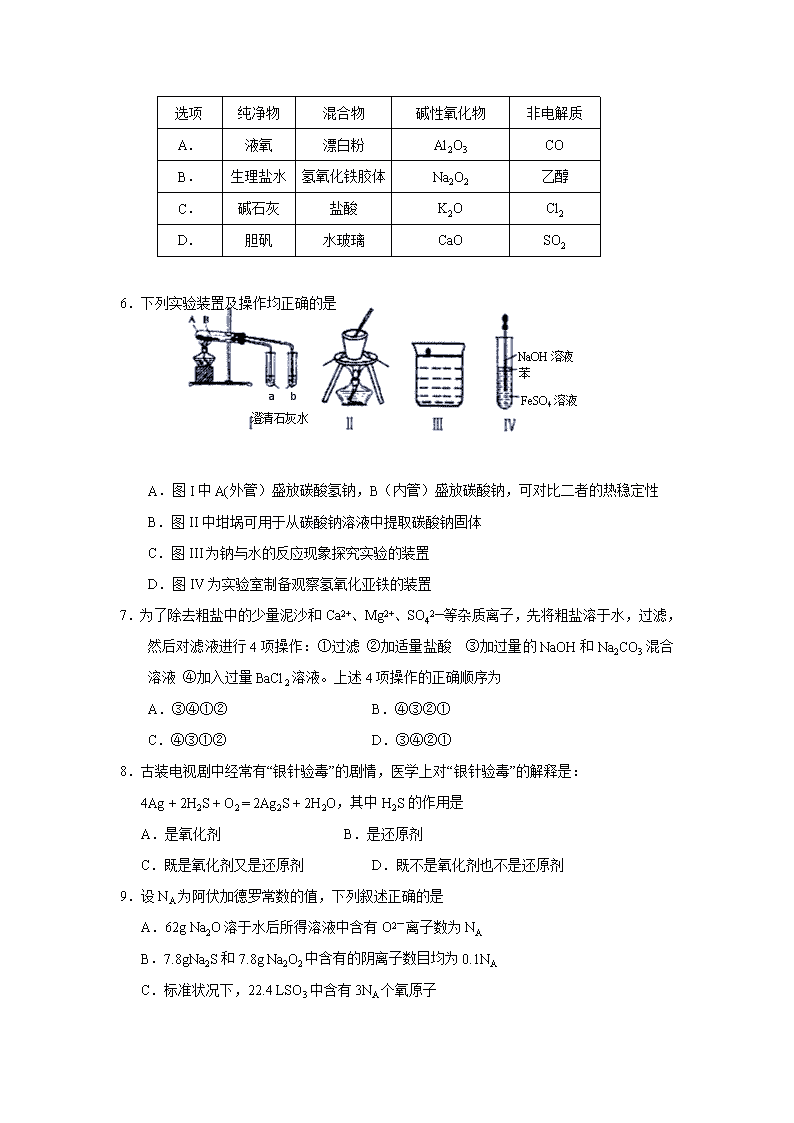
银川一中2019/2020学年度(上)高一期末考试 化 学 试 卷 可能用到的相对原子质量:H-1 C-12 O-8 Na-23 Mg-24 Al-27 Cl-35.5 Ca-40 一、单项选择题(每小题2分,共50分) 1.我国古代文献中有许多化学知识记载,如《梦溪笔谈》中的“信州铅山县有苦泉,…挹其水熬之,则成胆矾,熬胆矾铁釜,久之亦化为铜”等,上述描述中没有涉及的变化是 A.复分解反应 B.蒸发结晶 C.离子反应 D.氧化还原反应 2.下列说法正确是 ①正常雨水的pH为7.0,酸雨的pH小于7.0; ②严格执行机动车尾气排放标准有利于防止大气污染; ③Fe2O3常用作红色油漆和涂料; ④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害; ⑤SiO2可用于制太阳能电池。 A.①②③ B.①④⑤ C.②③④ D.③④⑤ 3.化学在生活中应用广泛,下列物质性质与对应用途错误的是 A.明矾易水解生成胶体,可用作净水剂 B.晶体硅熔点高硬度大,可用作芯片 C.NaClO具有强氧化性,可作织物漂白剂 D.硅胶具有优良的吸附性,且无毒,可作袋装食品和瓶装药品的干燥剂 4.“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质 ①是溶液 ②是胶体 ③ 能透过滤纸 ④不能透过滤纸 ⑤能产生丁达尔效应 ⑥静置后,会析出黑色沉淀 A.①④⑥ B.②③④ C.②③⑤ D.①③④⑥ 5.下表中对于相关物质的分类全部正确的是 选项 纯净物 混合物 碱性氧化物 非电解质 A. 液氧 漂白粉 Al2O3 CO B. 生理盐水 氢氧化铁胶体 Na2O2 乙醇 C. 碱石灰 盐酸 K2O Cl2 D. 胆矾 水玻璃 CaO SO2 a b 澄清石灰水 NaOH溶液 苯 FeSO4溶液 6.下列实验装置及操作均正确的是 A.图I中A(外管)盛放碳酸氢钠,B(内管)盛放碳酸钠,可对比二者的热稳定性 B.图II中坩埚可用于从碳酸钠溶液中提取碳酸钠固体 C.图III为钠与水的反应现象探究实验的装置 D.图IV为实验室制备观察氢氧化亚铁的装置 7.为了除去粗盐中的少量泥沙和Ca2+、Mg2+、SO42—等杂质离子,先将粗盐溶于水,过滤,然后对滤液进行4项操作:①过滤 ②加适量盐酸 ③加过量的NaOH和Na2CO3混合溶液 ④加入过量BaCl2溶液。上述4项操作的正确顺序为 A.③④①② B.④③②① C.④③①② D.③④②① 8.古装电视剧中经常有“银针验毒”的剧情,医学上对“银针验毒”的解释是: 4Ag + 2H2S + O2 = 2Ag2S + 2H2O,其中H2S的作用是 A.是氧化剂 B.是还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂也不是还原剂 9.设NA为阿伏加德罗常数的值,下列叙述正确的是 A.62g Na2O溶于水后所得溶液中含有O2-离子数为NA B.7.8gNa2S和7.8g Na2O2中含有的阴离子数目均为0.1NA C.标准状况下,22.4 LSO3中含有3NA个氧原子 D.合成氨反应中1mol氮气与3mol氢气反应,转移电子数为6NA 10.下列体系中,离子能大量共存的是 A.无色透明的酸性溶液:MnO4-、K+、C1-、SO42- B.使酚酞变红的溶液:K+、Na+、NO3-、Cl- C.滴加KSCN显红色的溶液:NH4+、K+、Cl-、OH- D.0.1 mol·L-1 NaHCO3溶液: Na+、Ba2+、NO3-、OH- 11.下列反应的离子方程式正确的是 △ A.钠与水的反应: Na+2H2O =Na++2OH-+H2↑ B.氯化铵固体与熟石灰共热制氨气:NH4++OH- = NH3↑+H2O C.氯气通入石灰乳中制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O D.食醋除水垢:CaCO3+ 2CH3COOH = Ca2+ + 2CH3COO- + CO2↑+H2O 12.下列说法正确的是 A.实验室保存FeSO4溶液常在溶液中加入少量铁粉 B.可用澄清石灰水鉴别Na2CO3和NaHCO3溶液 C.可以用饱和Na2CO3除去CO2中少量SO2 D.Na2SiO3溶液常常保存在带玻璃塞的细口瓶中 13.2019年12月17日,我国第一艘国产航空母舰“山东舰”在海南三亚某军港交付海军,它宣告了中国海军的国产航母时代正式来临。据报道,该舰艇的“超级甲板”采用了大量新型铝锂合金和铝镁合金等航天材料,真正实现了“浴千度火仍无恙”。下列关于两种合金的说法正确的是 A.铝锂合金是铝与锂形成的新型化合物 B.铝锂合金的硬度比铝大,熔沸点比铝高 C.铝镁合金不能全部溶解于稀盐酸中 D.铝镁合金焊接前用NaOH溶液处理氧化铝膜 Cl2 点燃 NaOH溶液 O2 点燃 H2O 高温 SiO2 高温 H2O NaOH溶液 14.在给定条件下,下列选项所示的物质间转化均能实现的是 A.Fe FeCl2 Fe(OH)2 B.S SO3 H2SO4 C.CaCO3 CaO CaSiO3 D.SiO2 H2SiO3 Na2SiO3 15.现有盐酸、氯化钠溶液、氢氧化钡溶液和新制的氯水四种溶液,可以一次把它们区别开的一种试剂是 A.CuSO4溶液 B.AgNO3溶液 C.紫色石蕊试液 D.FeCl2溶液 16.在一定条件下,将充满NO2和O2的试管倒立于水槽中,充分反应后,剩余O2的体积为原混合气体体积的1/8,则原混合气体中NO2和O2的体积比为 A. 8:1 B.7:3 C.7:1 D.4:1 17.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是 A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HclO 18.如图:烧瓶中充满a气体,滴管和烧杯中盛放足量b溶液,将滴管中溶液挤入烧瓶,打开止水夹f,能形成喷泉的是 A. a是Cl2,b是饱和NaCl溶液 B. a是NO,b是H2O C. a 是NH3,b是盐酸溶液 D. a是CO2,b是饱和NaHCO3溶液 19.用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 选项 ①中物质 ②中物质 预测②中的现象 A 稀盐酸 碳酸钠与氢氧化钠的混合溶液 立即产生气泡 B 浓硝酸 用砂纸打磨过的铝条 产生红棕色气体 C 新制氯水 淀粉碘化钾溶液 溶液变蓝色 D 浓盐酸 MnO2 产生黄绿色气体 20.将一定量的Mg、Al混合物投入200mL某浓度的盐酸 中,金属完全溶解后,再逐滴加入2 mol·L-1的NaOH 溶液至过量,所生成的沉淀与所加NaOH的关系如图 所示。则盐酸的浓度是 A.2.5mol L-1 B.3mol L-1 C.3.5mol L-1 D.4mol L-1 21.下列离子的检验方法正确的是 A. 某溶液产生白色沉淀,说明原溶液中有Cl- B. 某溶液产生白色沉淀,说明原溶液中有SO42- C. 某溶液 生成无色气体,说明原溶液中有CO32- D. 某溶液产生蓝色沉淀,说明原溶液中有Cu2+ 22.下列实验现象描述正确的是 A.将足量SO2气体通入石蕊试液中,石蕊试液先变红后褪色 B.红热的铜丝在氯气中燃烧,产生了棕黄色的烟 C.碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色 D.将过氧化钠加入足量的水中振荡,再滴入酚酞,震荡,溶液呈红色 23.如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是 选项 试剂 现象 结论 A 酸性KMnO4溶液 溶液褪色 SO2有氧化性 B 品红溶液 溶液褪色 SO2有漂白性 C 滴有酚酞的NaOH溶液 溶液褪色 SO2有漂白性 D 硫化氢水溶液 溶液变浑浊 SO2有还原性 24.固体粉末X中可能含有Na2O、CaO、CuO、Fe2O3和SiO2中的若干种,为确定其成分,现取X进行如下实验(所加试剂均过量),下列说法正确的是 A.该混合物一定含有CuO、SiO2 B.该混合物可能含有Na2O和Fe2O3 C.该混合物一定不含CaO和Na2O D.无法确定是否含有CaO和Fe2O3 25.将200g质量分数为7.3%的盐酸,加入14.4g由Na2O2、Na2CO3、NaOH组成的化合物中,充分反应后,继续加入一定质量的氢氧化钠,反应至溶液恰好呈中性,蒸发结晶,最终得到的固体质量为 A.8g B.15.5g C.23.4g D.无法计算 二、 填空题(10分) 26.除去Na2CO3溶液中混有的NaHCO3应加入 (填化学式)溶液。 27.中国的瓷器驰名世界,制备陶瓷是以黏土[主要成分Al2Si2O5(OH)4]为原料,经高温烧结而成。若以氧化物形式表示黏土的组成,应写为:________________。 28.________是制造光导纤维重要原料。 29.漂白粉或漂粉精的有效成分是 _(填化学式)。 30.NO2是______色有毒气体,NO2与水反应的方程式为 ,标准状况下67.2LNO2与水反应转移电子为 mol。 31. 蔗糖与浓硫酸发生反应,形成“黑面包”,体现了浓硫酸的 性。 三、无机推断题(每空2分,共12分) 下列框图所示的转化关系中,、均为常见的金属单质;A、在冷的的浓溶液中均会发生钝化;为淡黄色的非金属单质。为红棕色固体氧化物,为常见无色液体。焰色为黄色,且能使酚酞变红(部分反应条件、反应过程中生成的水及其他产物略去)。 (1) 的化学式为 。 (2)与反应的化学方程式为 。 (3)与氯气反应的离子方程式为 。 (4)与氨水反应的化学方程式为 。 (5)与反应的离子方程式为 。 (6)检验“黄色溶液”中阳离子的方案: 。 四、(共20分)按要求完成下列实验 实验一: (10分)某学生利用以下装置探究氯气与氨之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨反应的装置。 请回答下列问题: (1)装置F中发生反应的化学方程式为 . (2)装置B中仪器的名称是 ;装置E 的作用是 . (3)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。 写出反应的化学方程式 . (4)装置C内当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数常数为 mol-1 (用含a、b的代数式表示)。 (5)将用F、E、D装置制得的氯气通人含74gCa(OH)2的石灰乳中,最多可制得漂白粉 g. 实验二:(10分)已知浓硫酸和木炭粉在加热条件下可发生化学反应。 (1)上述反应的化学方程式为 ; (2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。 这些装置的连接顺序(按产物气流从左至右的方向)是(填装置中导管口的编号): 接 , 接 , 接 。 (3)实验时可观察到装置①中A瓶中的溶液褪色,C瓶中的溶液不褪色。B瓶中的溶液的作用是 ;C瓶中所加试剂是 。 (4)装置②中所加固体药品是无水硫酸铜,装置③中所加试剂是 ;装置④中带活塞的仪器名称为 。 五、(8分)计算题(请写出相关方程式及计算过程) 把10.2 g镁铝合金的粉末放入过量的烧碱溶液中,在标准状况下生成6.72 L氢气。试计算: (1)该合金中铝的质量分数是多少? (2)该合金中镁与铝的物质的量之比是多少。 (3)该合金溶于足量的盐酸溶液中,标准状况下产生氢气的体积是多少? 高一期末化学试卷参考答案 1 2 3 4 5 6 7 8 9 10 A C B C D D C D B B 11 12 13 14 15 16 17 18 19 20 D A D C C B D C C B 21 22 23 24 25 D B B A C 二、填空题 1. NaOH 2. Al2O3·2SiO2·2H2O 3. SiO2(或二氧化硅) 4. Ca(ClO)2 5. 红棕 3NO2+H2O=2HNO3+NO 2 6. 脱水性、氧化性 三、无机推断题 (1)SO2 (2)2Al+Fe2O3 === Al2O3 +2Fe (3)2Fe2++ Cl2 ===2Fe3++ 2Cl- (4) Al2(SO4)3 + 6NH3▪H2O === 2Al(OH)3↓+ 3(NH4)2SO4 (5) Al2O3 + 2OH- === 2AlO2- + H2O (6)取样,滴加KSCN溶液,溶液呈血红色,则黄色溶液中阳离子为Fe3+; 四、实验题: 实验一:(除第(2)每空一分,其余空每空2分,共10分) (1) MnO2+4HCl(浓)===MnCl2+Cl2↑+2H2O(无条件、“浓”字等扣一分) (2) 干燥管(1分) 除去氯气中的氯化氢(1分) (3) 3Cl2 + 8NH3 === N2 + 6NH4Cl (4) b/2a (5) 127 实验二( 10分) (1)2H2SO4(浓) + C 2H2O + CO2↑+ 2SO2↑;----2分 (2)gc(或d)d(或c)abf(2分);----2分(有错不给分) (3)除去SO2气体,避免对CO2的检验产生干扰; ----2分 品红溶液 ----1分 (4) 澄清石灰水----2分; 分液漏斗 ----1分 五、计算题(8分) (1)52.9% (3分) (2)1:1 (2分) (3)11.2 L (3分) 解析:(1)把镁铝合金的粉末放入过量的烧碱溶液中,镁不反应,只有铝能与氢氧化钠溶液反应。设铝的物质的量为n(Al),则: 2Al+2NaOH+2H2O===2NaAlO2+3H2? 2 mol 3×22.4 L n(Al) 6.72 L 解得:n(Al)=0.2 mol, m(Al)=0.2 mol×27 g·mol-1=5.4 g, 铝的质量分数为×100%˜52.9%。 (2)m(Mg)=10.2 g-5.4 g=4.8 g, n(Mg)==0.2 mol, 则n(Al):n(Mg)=1:1。 (3)设由铝生成的氢气为V1(H2),由镁生成的氢气为V2(H2),由铝和镁与盐酸的反应可知: 2Al+6HCl===2AlCl3+3H2? 2 mol 3×22.4 L 0.2 mol V1(H2) 解得:V1(H2)=6.72 L, Mg+2HCl===MgCl2+H2? 1 mol 22.4 L 0.2 mol V2(H2) 解得:V2(H2)=4.48 L, V总(H2)=V1(H2)+V2(H2)=6.72 L+4.48 L=11.2 L。查看更多