- 2021-06-25 发布 |
- 37.5 KB |
- 3页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020九年级化学下册 第十单元 酸和碱 实验活动6 酸、碱的化学性质同步测试
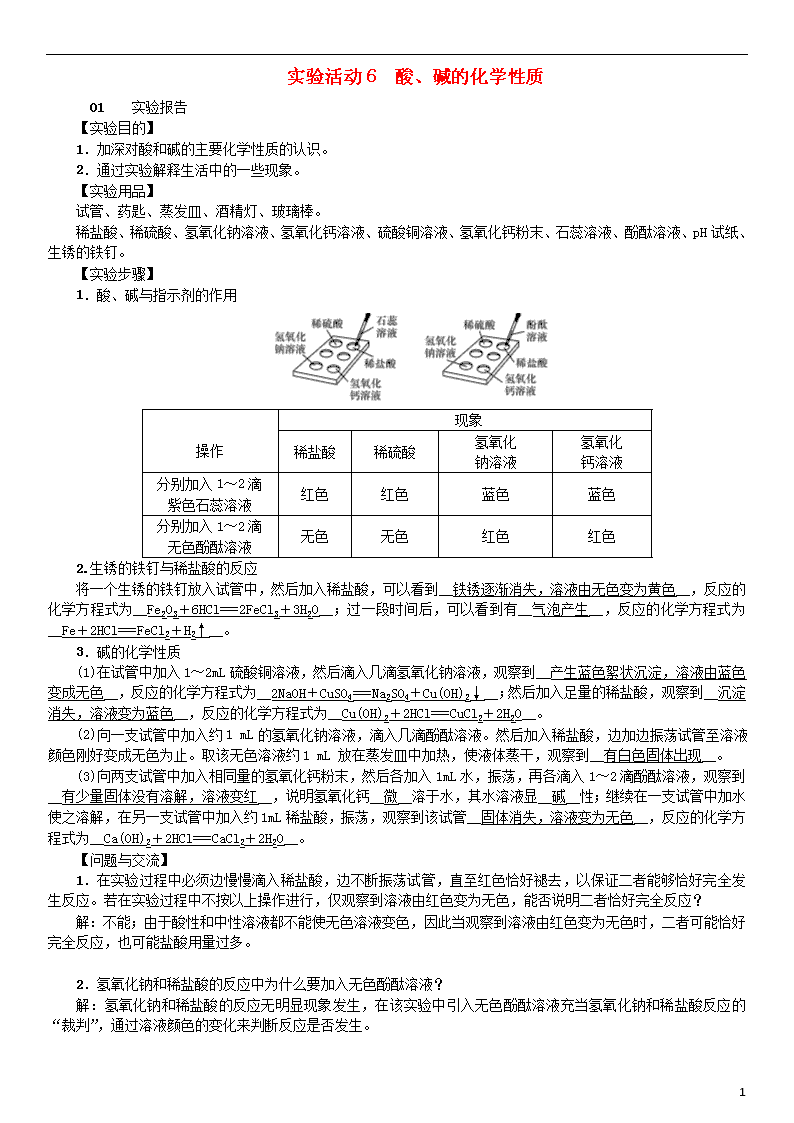
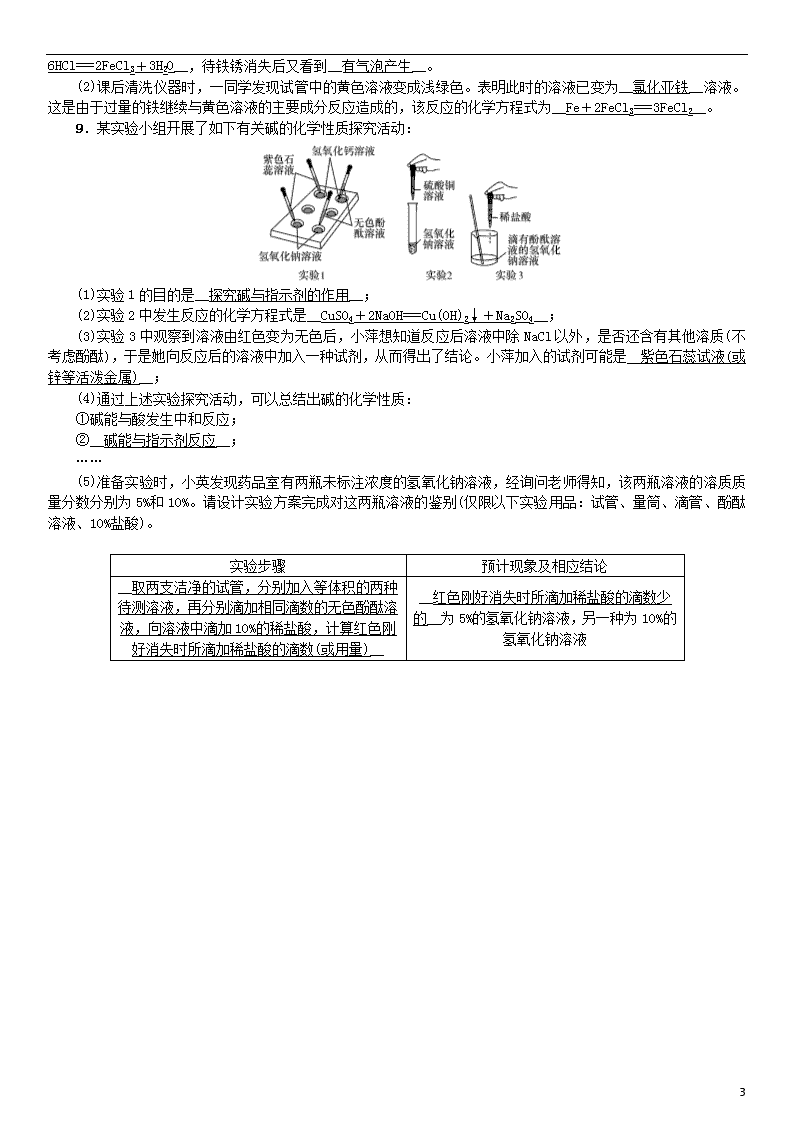
实验活动6 酸、碱的化学性质 01 实验报告 【实验目的】 1.加深对酸和碱的主要化学性质的认识。 2.通过实验解释生活中的一些现象。 【实验用品】 试管、药匙、蒸发皿、酒精灯、玻璃棒。 稀盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液、硫酸铜溶液、氢氧化钙粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉。 【实验步骤】 1.酸、碱与指示剂的作用 操作 现象 稀盐酸 稀硫酸 氢氧化 钠溶液 氢氧化 钙溶液 分别加入1~2滴 紫色石蕊溶液 红色 红色 蓝色 蓝色 分别加入1~2滴 无色酚酞溶液 无色 无色 红色 红色 2.生锈的铁钉与稀盐酸的反应 将一个生锈的铁钉放入试管中,然后加入稀盐酸,可以看到__铁锈逐渐消失,溶液由无色变为黄色__,反应的化学方程式为__Fe2O3+6HCl===2FeCl3+3H2O__;过一段时间后,可以看到有__气泡产生__,反应的化学方程式为__Fe+2HCl===FeCl2+H2↑__。 3.碱的化学性质 (1)在试管中加入1~2 mL硫酸铜溶液,然后滴入几滴氢氧化钠溶液,观察到__产生蓝色絮状沉淀,溶液由蓝色变成无色__,反应的化学方程式为__2NaOH+CuSO4===Na2SO4+Cu(OH)2↓__;然后加入足量的稀盐酸,观察到__沉淀消失,溶液变为蓝色__,反应的化学方程式为__Cu(OH)2+2HCl===CuCl2+2H2O__。 (2)向一支试管中加入约1 mL的氢氧化钠溶液,滴入几滴酚酞溶液。然后加入稀盐酸,边加边振荡试管至溶液颜色刚好变成无色为止。取该无色溶液约1 mL 放在蒸发皿中加热,使液体蒸干,观察到__有白色固体出现__。 (3)向两支试管中加入相同量的氢氧化钙粉末,然后各加入1 mL水,振荡,再各滴入1~2滴酚酞溶液,观察到__有少量固体没有溶解,溶液变红__,说明氢氧化钙__微__溶于水,其水溶液显__碱__性;继续在一支试管中加水使之溶解,在另一支试管中加入约1 mL稀盐酸,振荡,观察到该试管__固体消失,溶液变为无色__,反应的化学方程式为__Ca(OH)2+2HCl===CaCl2+2H2O__。 【问题与交流】 1.在实验过程中必须边慢慢滴入稀盐酸,边不断振荡试管,直至红色恰好褪去,以保证二者能够恰好完全发生反应。若在实验过程中不按以上操作进行,仅观察到溶液由红色变为无色,能否说明二者恰好完全反应? 解:不能;由于酸性和中性溶液都不能使无色溶液变色,因此当观察到溶液由红色变为无色时,二者可能恰好完全反应,也可能盐酸用量过多。 2.氢氧化钠和稀盐酸的反应中为什么要加入无色酚酞溶液? 解:氢氧化钠和稀盐酸的反应无明显现象发生,在该实验中引入无色酚酞溶液充当氢氧化钠和稀盐酸反应的“裁判”,通过溶液颜色的变化来判断反应是否发生。 3 【反思、拓展与评价】 1.做氢氧化钙溶于水及与盐酸反应的实验可得到氢氧化钙和氯化钙的哪些性质? 解:氢氧化钙微溶于水,显碱性,能与稀盐酸发生化学反应;氯化钙溶于水,显中性。 2.教师或小组长评价:________________________________________________________________________。 02 实验习题 1.化学课上,化学老师为同学们表演了小魔术,他将一张白纸展示给大家,然后用喷壶向纸上喷了一些无色液体,“化学真奇妙”的红色大字立刻显现于纸上。他所用的试剂可能是下列哪一组(A) A.酚酞——石灰水 B.酚酞——盐酸 C.石蕊——石灰水 D.石蕊——盐酸 2.(2018·广州)下列有关氢氧化钾的说法正确的是(A) A.氢氧化钾固体露置在空气中易变质 B.氢氧化钾溶液能使石蕊溶液变红 C.氢氧化钾溶液与氧化铜反应生成蓝色沉淀 D.2 mL氢氧化钾溶液与1 mL硫酸溶液恰好完全反应 3.(2018·重庆A卷)食醋里通常含有3%~5%的醋酸(CH3COOH),食醋与鸡蛋壳反应产生能使澄清石灰水变浑浊的气体。下列说法不正确的是(B) A.产生的气体是二氧化碳 B.加水稀释食醋,溶液pH变小 C.醋酸在水溶液里能解离出H+ D.不宜用铝制容器盛装食醋 4.(2017·邵阳)下列试剂能将稀硫酸、氯化钠溶液、澄清石灰水三种溶液一步鉴别出来的是(D) A.稀盐酸 B.二氧化碳 C.碳酸钙 D.石蕊溶液 5.下面是某同学进行碱的化学性质实验时记录的实验现象,其中与事实不相符的是(B) A.在Ca(OH)2溶液中加入稀盐酸,无明显变化 B.在NaOH溶液中通入CO2气体,有白色沉淀生成 C.在Ca(OH)2溶液中加入几滴石蕊溶液,溶液呈蓝色 D.在NaOH溶液中加入CuSO4溶液,有蓝色沉淀生成 6.下列变化中,不能表明盐酸与氢氧化钠发生了反应的是(B) A.向氢氧化钠溶液中加入盐酸后,混合溶液的温度升高 B.向氢氧化钠溶液中加入盐酸后,混合溶液的质量增大 C.向滴有酚酞的氢氧化钠溶液中加入盐酸后,红色褪去 D.向氢氧化钠溶液中加入盐酸后,混合溶液的pH<7 7.(2018·梧州)某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法错误的是(B) A.图中b点所示溶液中,溶质是NaCl B.向图中c点所示溶液中滴加无色酚酞,溶液不变色 C.该实验是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中 D.由a点到b点的pH变化过程证明酸和碱发生了中和反应 8.某实验小组探究酸的化学性质,在做盐酸除铁锈的实验时发现: (1)将带锈的铁钉放入试管后加入稀盐酸,看到铁锈消失,溶液呈黄色,反应的化学方程式为__Fe2O3 3 +6HCl===2FeCl3+3H2O__,待铁锈消失后又看到__有气泡产生__。 (2)课后清洗仪器时,一同学发现试管中的黄色溶液变成浅绿色。表明此时的溶液已变为__氯化亚铁__溶液。这是由于过量的铁继续与黄色溶液的主要成分反应造成的,该反应的化学方程式为__Fe+2FeCl3===3FeCl2__。 9.某实验小组开展了如下有关碱的化学性质探究活动: (1)实验1的目的是__探究碱与指示剂的作用__; (2)实验2中发生反应的化学方程式是__CuSO4+2NaOH===Cu(OH)2↓+Na2SO4__; (3)实验3中观察到溶液由红色变为无色后,小萍想知道反应后溶液中除NaCl以外,是否还含有其他溶质(不考虑酚酞),于是她向反应后的溶液中加入一种试剂,从而得出了结论。小萍加入的试剂可能是__紫色石蕊试液(或锌等活泼金属)__; (4)通过上述实验探究活动,可以总结出碱的化学性质: ①碱能与酸发生中和反应; ②__碱能与指示剂反应__; …… (5)准备实验时,小英发现药品室有两瓶未标注浓度的氢氧化钠溶液,经询问老师得知,该两瓶溶液的溶质质量分数分别为5%和10%。请设计实验方案完成对这两瓶溶液的鉴别(仅限以下实验用品:试管、量筒、滴管、酚酞溶液、10%盐酸)。 实验步骤 预计现象及相应结论 __取两支洁净的试管,分别加入等体积的两种待测溶液,再分别滴加相同滴数的无色酚酞溶液,向溶液中滴加10%的稀盐酸,计算红色刚好消失时所滴加稀盐酸的滴数(或用量)__ __红色刚好消失时所滴加稀盐酸的滴数少的__为5%的氢氧化钠溶液,另一种为10%的氢氧化钠溶液 3查看更多