- 2021-06-08 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020(通用版)中考化学重难点易错点复习讲练揭秘生活中常见的盐(含解析)
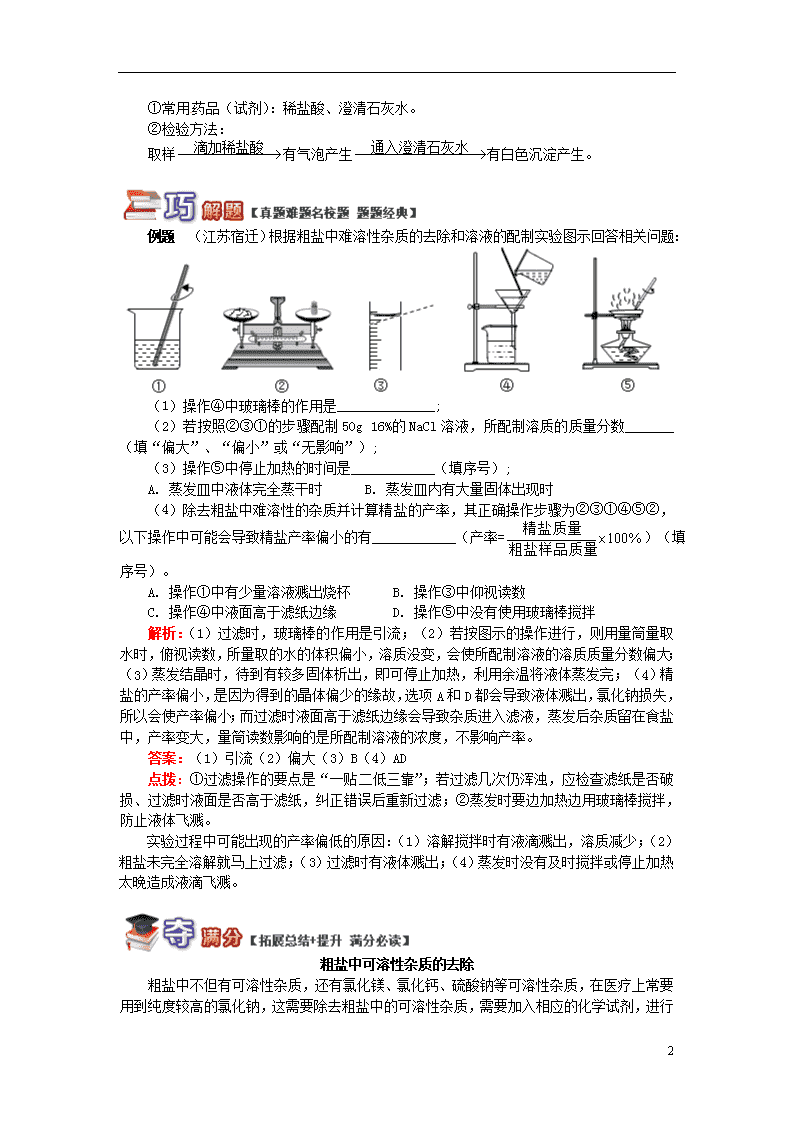
揭秘生活中常见的盐 一、常见盐的物理性质和用途 常见的盐 氯化钠 碳酸钠 碳酸氢钠 碳酸钙 俗称 食盐 纯碱、苏打 小苏打 化学式 NaCl Na2CO3 NaHCO3 CaCO3 色、态及溶解性 都是白色固体,都易溶于水 白色固体,难溶于水 用途 调味、配生理盐水、农业选种等 用于玻璃、造纸、纺织和洗涤剂的生产等 发酵粉、治疗胃酸过多症等 建筑材料、补钙剂等 组成特点 都是由金属离子和酸根离子构成的,都属于盐类 二、粗盐提纯 粗盐中常含有泥沙等不溶性杂质,还含有氯化镁、氯化钙、硫酸钠等可溶性物质。 除去粗盐中的不溶性杂质时。其提纯步骤为: 1. 称量:注意“左物右码”。 2. 溶解 3. 过滤:操作的要点是一贴、二低、三靠。 一贴:滤纸要紧贴在漏斗内壁上,中间不要留有气泡; 二低:液面要低于滤纸边缘,滤纸边缘低于漏斗边缘; 三靠:玻璃棒要紧靠过滤器中三层滤纸处,盛混合液的烧杯口要紧靠在玻璃棒上,漏斗的末端要紧靠在承接滤液的烧杯内壁上。 4. 蒸发:搅拌时玻璃棒向一个方向搅动;当出现大量固体时,停止加热,利用余热把食盐烘干。 5. 计算产率: 注意:各步骤中玻璃棒的作用: 实验步骤 作用 溶解 搅拌,加快粗盐溶解 过滤 起引流作用,防止液体洒落 蒸发 搅拌液体,为了防止液体局部温度过高,造成液滴飞溅 三、碳酸钠、碳酸氢钠和碳酸钙 1. 与盐酸反应,都会有二氧化碳产生,反应方程式分别为: Na2CO3+2HCl===2NaCl+H2O+CO2↑ NaHCO3+HCl===NaCl+H2O+CO2↑ CaCO3+2HCl===CaCl2+H2O+CO2↑ 2. 碳酸钠与氢氧化钙反应 反应的化学方程式为:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH, 工业上用该反应制取烧碱。 3. CO和HCO的检验 8 ①常用药品(试剂):稀盐酸、澄清石灰水。 ②检验方法: 取样有气泡产生有白色沉淀产生。 例题 (江苏宿迁)根据粗盐中难溶性杂质的去除和溶液的配制实验图示回答相关问题: (1)操作④中玻璃棒的作用是______________; (2)若按照②③①的步骤配制50g 16%的NaCl溶液,所配制溶质的质量分数_______(填“偏大”、“偏小”或“无影响”); (3)操作⑤中停止加热的时间是____________(填序号); A. 蒸发皿中液体完全蒸干时 B. 蒸发皿内有大量固体出现时 (4)除去粗盐中难溶性的杂质并计算精盐的产率,其正确操作步骤为②③①④⑤②,以下操作中可能会导致精盐产率偏小的有 (产率=)(填序号)。 A. 操作①中有少量溶液溅出烧杯 B. 操作③中仰视读数 C. 操作④中液面高于滤纸边缘 D. 操作⑤中没有使用玻璃棒搅拌 解析:(1)过滤时,玻璃棒的作用是引流;(2)若按图示的操作进行,则用量筒量取水时,俯视读数,所量取的水的体积偏小,溶质没变,会使所配制溶液的溶质质量分数偏大;(3)蒸发结晶时,待到有较多固体析出,即可停止加热,利用余温将液体蒸发完;(4)精盐的产率偏小,是因为得到的晶体偏少的缘故,选项A和D都会导致液体溅出,氯化钠损失,所以会使产率偏小;而过滤时液面高于滤纸边缘会导致杂质进入滤液,蒸发后杂质留在食盐中,产率变大,量筒读数影响的是所配制溶液的浓度,不影响产率。 答案:(1)引流(2)偏大(3)B(4)AD 点拨:①过滤操作的要点是“一贴二低三靠”;若过滤几次仍浑浊,应检查滤纸是否破损、过滤时液面是否高于滤纸,纠正错误后重新过滤;②蒸发时要边加热边用玻璃棒搅拌,防止液体飞溅。 实验过程中可能出现的产率偏低的原因:(1)溶解搅拌时有液滴溅出,溶质减少;(2)粗盐未完全溶解就马上过滤;(3)过滤时有液体溅出;(4)蒸发时没有及时搅拌或停止加热太晚造成液滴飞溅。 粗盐中可溶性杂质的去除 8 粗盐中不但有可溶性杂质,还有氯化镁、氯化钙、硫酸钠等可溶性杂质,在医疗上常要用到纯度较高的氯化钠,这需要除去粗盐中的可溶性杂质,需要加入相应的化学试剂,进行一系列实验操作。 例题:某校化学活动小组查阅资料发现,粗盐中除NaCl外,还含有MgCl2、CaCl2、MgSO4以及泥沙等杂质,他们要除去杂质得到精盐,设计了下列实验方案(序号①~⑧表示实验操作,用于沉淀的试剂稍过量): 根据上述方案,回答下列问题: (1)操作①中玻璃棒的作用是 。 (2)第⑤步操作的名称是 。 (3)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、 、 。 (4)实验中加入“Na2CO3溶液”的目的是 。 (5)利用提供的沉淀试剂,再写出一种添加试剂的操作顺序(填序号): 。 解析:(1)溶解过程中玻璃棒的作用是加速粗盐的溶解;过滤操作中玻璃棒的作用是引流。(2)把沉淀和液体分离的方法是过滤。(3)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、酒精灯、蒸发皿。(4)加入“Na2CO3溶液”的作用是沉淀出钡离子和钙离子。(5)②③④三种试剂的加入可以除去相应的杂质离子,加过量氯化钡可除尽硫酸根离子,加过量氢氧化钠可除尽镁离子,加过量碳酸钠可除尽钙离子,过量的氢氧化钠与碳酸钠可加适量的盐酸除去,但过量的氯化钡无法用盐酸除去,可将碳酸钠的添加放在加氯化钡之后,这样既可除去钙离子,又能除去过量的氯化钡。 答案:(1)加速粗盐的溶解(2)过滤(3)酒精灯、蒸发皿(4)除去CaCl2和过量的BaCl2 (5)③②④或②④③ 【方法提炼】 温馨提示:①操作中加入过量药品的目的是将杂质除净。 ②过量的碳酸钠溶液既可除去粗盐中的钙离子,也可除去过量的钡离子,因此,加入药品时,碳酸钠溶液须在氯化钡溶液之后添加。 ③试剂加完后,过滤,滤液中加稀盐酸至溶液pH为7即可。 (答题时间:30分钟) 1. (四川泸州)掌握物质的分类是学好化学的基础,下列物质属于盐类的是( ) A. NaCl B. KOH C. MgO D. Cu 2. (广东)下列物质的名称和俗名对应正确的是( ) 8 A. 碳酸钙——纯碱 B. 氯化钠——食盐 C. 碳酸钠——小苏打 D. 氧化钙——熟石灰 3. (北京)碳酸钠可用于制造玻璃,其俗称是( ) A. 小苏打 B. 熟石灰 C. 生石灰 D. 纯碱 4. (遵义)粗盐初步提纯的操作步骤如图所示,相关说法错误的是( ) A. 溶解时玻璃棒用于搅拌 B. 过滤时玻璃棒用于引流 C. 蒸发至滤液被蒸干后再移去酒精灯 D. 图中“操作1”是称量 5. 某同学在自己家厨房中找到一种白色粉末,到学校实验室进行实验,实验过程与现象如下: 对此粉末的成分判断正确的是( ) A. 该粉末一定是碳酸钠 B. 该粉末一定是碳酸氢钠 C. 该粉末一定是氯化钠 D. 该粉末可能是碳酸钠或碳酸氢钠 6.通过海水晒盐的方法得到的仅仅是粗盐,其中还含有少量的硫酸钠、氯化镁、氯化钙等杂质,它们在溶液中主要以SO42-、Ca2+、Mg2+的形式存在。为将这些杂质除净,可向食盐溶液中分别加入过量的氢氧化钠、碳酸钠、氯化钡溶液,然后加入盐酸调至溶液pH=7,最后经过滤、蒸发得到精盐。下列操作及加入溶液的顺序错误的是( ) 一些物质的溶解性表(室温) OH- Cl- SO42- CO32- Na+ 溶 溶 溶 溶 Ca2+ 微 溶 微 不 Mg2+ 不 溶 溶 微 Ba2+ 溶 溶 不 不 A. Na2CO3、BaCl2、NaOH、过滤、HCl B. NaOH、BaCl2、Na2CO3、过滤、HCl C. BaCl2、Na2CO3、NaOH、过滤、HCl D. BaCl2、NaOH、Na2CO3、过滤、HCl 7. (山东滨州)氨碱法制纯碱的工业流程如下: (1)最终所得纯碱主要成分的化学式是 ,它属于 (酸、碱或盐),该产品易溶于水,溶液显 性。 (2)由步骤③所得的碳酸氢钠在生产和生活中有许多重要用途,在医疗上,它是治疗 过多的药剂之一。 (3)试写出步骤④中发生反应的化学方程式 。 8. (河北)某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50g 5%的氯化钠溶液。 8 实验一:下图是同学们做粗盐提纯实验的操作示意图。 请回答下列问题: (1)操作③结束后能否马上过滤? 。 (2)操作⑥中的错误是 。 (3)粗盐提纯实验的操作顺序为(填操作序号)________________、称量精盐并计算产率。 (4)操作④中,当观察到 时,停止加热。 实验二:用提纯得到的精盐配制了 50g 5%的氯化钠溶液。经检测,溶质质量分数偏小, 其原因可能有 (填序号)。 ①氯化钠固体仍然不纯 ②称量时砝码端忘垫质量相同的纸片 ③量取水时,仰视读数 ④装瓶时,有少量溶液洒出 9. 发酵粉是一种制作风味糕点的常见膨松剂。某兴趣小组拟对其化学成分进行如下探究。 【查阅资料】①发酵粉一般含有NH4HCO3、NaHCO3、明矾[KAl(SO4)2·12H2O]中的2种。②已知反应:2NaHCO3Na2CO3+H2O+CO2↑③Na2CO3 +Ca(OH)2=CaCO3↓+2NaOH 【提出假设】假设1:有NH4HCO3和NaHCO3; 假设2:有NaHCO3和明矾; 假设3:有________和明矾。 【方案与流程】 【问题与讨论】 (1)步骤①的操作是在研钵中把发酵粉和熟石灰混合、研磨。 (2)气体A为________。若生成A,证明假设________或假设________可能成立;若不生成A,证明假设________成立。 (3)如果生成A,经过步骤②和步骤③后,生成气体B,则B是(填化学式)____________,证明假设__________成立,写出步骤②的化学方程式:____________________。 10. 以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制。以粗盐为原料的“氯碱工业”流程如下: 8 回答下列问题: (1)氯气、氢氧化钠在工业上有广泛的用途。下列关于氢氧化钠的描述中,错误的是________。 A. 能去除油污,可作厨房清洁剂 B. 易溶于水,溶解时放出大量的热 C. 水溶液能使石蕊溶液变红 D. 可用作某些气体的干燥剂 (2)操作②的名称是________,操作④的名称是________________________________。 (3)操作①②间除杂质时所加的三种试剂是NaOH溶液、Na2CO3溶液、BaCl2溶液(均过量),其顺序要求是:Na2CO3溶液必须在BaCl2溶液之________(填“前”或“后”)加入。有同学提出用________溶液代替BaCl2溶液可达到同样的目的。 (4)电解饱和NaCl溶液的化学方程式是____________________________________。 (5)该流程中可以循环利用的物质是_______________________________________。 8 1. A 解析:盐是金属离子(或铵根离子)和酸根离子构成的化合物,氯化钠属于盐,氢氧化钾属于碱,氧化镁属于氧化物,铜属于单质。 2. B 解析:碳酸钙是石灰石或大理石的主要成分,纯碱是碳酸钠的俗称,A错误;食盐指的就是氯化钠,B正确;碳酸钠俗称纯碱、苏打,小苏打是碳酸氢钠,C错误;氧化钙是生石灰,熟石灰是氢氧化钙,D错误。 3. D 解析:碳酸钠俗称纯碱或苏打。 4. C 解析:溶解时玻璃棒用于搅拌,过滤时玻璃棒具有引流作用,蒸发时待蒸发皿中出现较多固体时,移去酒精灯停止加热,利用余热蒸干;粗盐提纯时应先称量,再溶解、过滤、蒸发等。 5. D 解析:加稀盐酸,产生无色无味的气体,将气体通入澄清石灰水,石灰水变浑浊,通过这一现象可以确定该物质是碳酸盐或者碳酸氢盐(因为在厨房内,这两种物质较常见),但是不能确定是碳酸盐还是碳酸氢盐。若需要进一步确定,可取少量该物质溶于水,滴加氯化钙溶液,变浑浊的是碳酸盐,无明显现象的是碳酸氢盐。 6. A 解析:应先通过加入过量的氢氧化钠或过量的氯化钡除去溶液中的硫酸根离子或镁离子,然后通过加入过量的碳酸钠除去钙离子和前面过量的钡离子,过滤后再加入适量的稀盐酸得到氯化钠溶液,一定不能先除钙离子,因为先加碳酸钠的话,除硫酸根离子时加入的过量氯化钡就无法除去。 7. (1)Na2CO3 盐 碱(2)胃酸(3)2NaHCO3Na2CO3+CO2↑+H2O 解析:(1)纯碱是碳酸钠,化学式为Na2CO3,属于盐类物质,其水溶液显碱性;(2)碳酸氢钠是盐,医疗上常用来治疗胃酸过多;(3)碳酸氢钠受热分解产生碳酸钠、水、二氧化碳。 8. 实验一:(1)不能 (2)未用玻璃棒引流(3)①⑤②③⑥④ (4)出现较多固体 实验二:①②③ 解析:(1)粗盐中有泥沙,搅拌后液体可能很浑浊,此时马上过滤泥沙容易堵塞滤纸上的孔,使过滤时间过长,应该静置澄清后再过滤; (2)过滤时应该用玻璃棒引流,不引流液体容易溅出; (3)要计算产率,在溶解之前就要先称量粗盐的质量,然后溶解、过滤、蒸发,再称量精盐的质量; (4)由于提纯后还有可溶性杂质,仍然不纯,氯化钠质量偏少;砝码端忘垫纸,则称得的精盐与精盐端纸的质量等于砝码的质量,所取氯化钠质量也偏少;仰视量筒读数,读数偏小,假设读数为47.5mL,实际会多于47.5mL,量水量多了;以上三种情况都会使溶质质量分数偏小。但装瓶时,溶液已经配好,洒出的与剩下的浓度一样,对溶质质量分数没有影响。 9. 【提出假设】假设3:NH4HCO3 【问题与讨论】(2)氨气(或NH3或刺激性气味的气体) 1(本答案与下一空格答案顺序调换同样可以) 3 2 (3)CO2 1 NH4HCO3NH3↑+H2O+CO2↑、2NaHCO3Na2CO3+H2O+CO2↑ 解析:因假设中有三种物质,两两组合,不难发现假设3应为NH4HCO3和明矾;因铵盐与碱石灰混合研磨会放出氨气,若有氨气放出则假设1和3成立,若无氨气放出则假设2成立。若有氨气生成,将充分加热后的固体加入盐酸中又生成气体,该气体为CO2,则假设1成立。 8 10. (1)C (2)过滤 蒸发 (3)后 Ba(OH)2 (4)2NaCl+2H2O通电2NaOH+H2↑+Cl2↑ (5)NaCl 解析:(1)氢氧化钠溶液能使石蕊溶液变蓝; (2)把悬浊液中的沉淀、滤液分开的操作是过滤。可通过蒸发使NaCl溶液变为饱和NaCl溶液; (3)把粗盐中的MgCl2、CaCl2、Na2SO4等杂质除去,Na2CO3溶液必须在BaCl2溶液之后加入,目的是除去多余的BaCl2;Ba(OH)2与Na2SO4反应生成BaSO4沉淀和NaOH,故用Ba(OH)2溶液来代替BaCl2溶液可达到同样的目的; (4)NaCl和H2O通电生成NaOH、H2和Cl2; (5)由流程可知,NaCl可循环利用。 8查看更多