- 2021-05-28 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
初中化学九年级上册单元清检测内容:第五单元化学方程式 新人教版
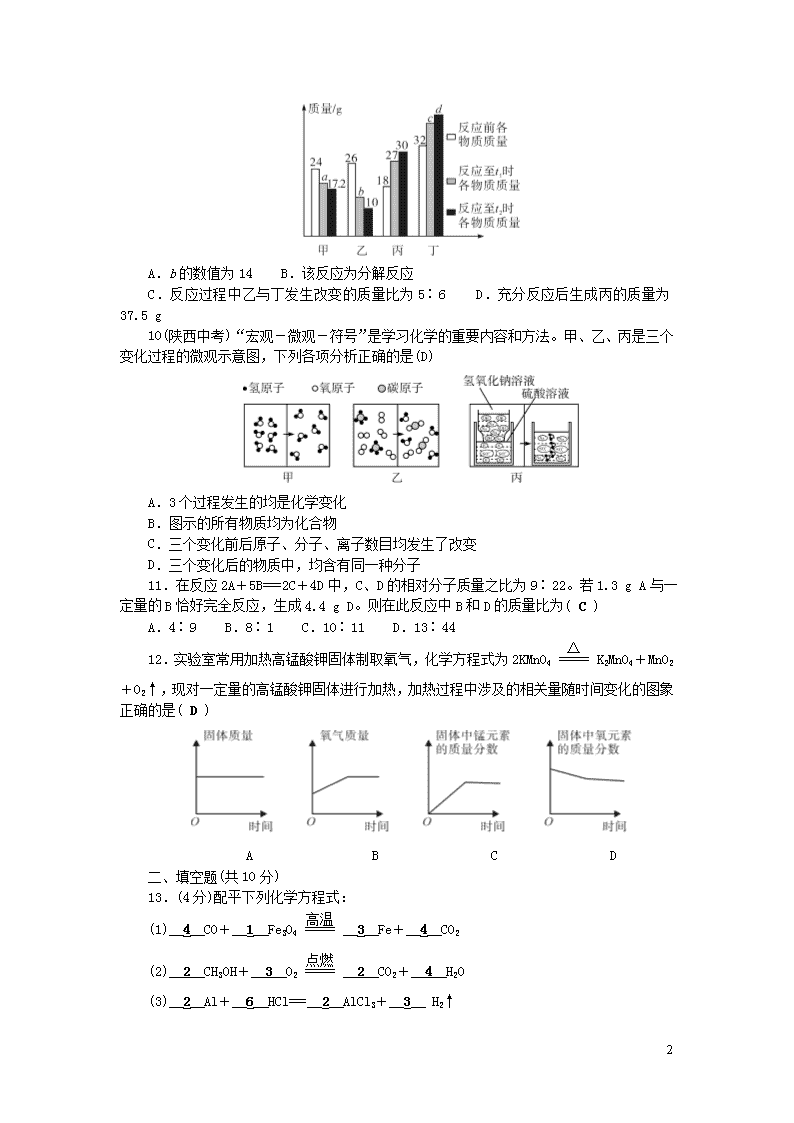
1 检测内容:第五单元 化学方程式 得分________ 评价________ 可能用到的相对原子质量:H—1 C—12 N—14 O—16 Cl—35.5 K—39 一、选择题(每小题 3 分,共 36 分) 1.(黔东南州中考)化学反应前后肯定没有发生变化的是(B) ①原子数目;②分子数目;③元素种类;④物质种类;⑤原子种类;⑥物质的总质量。 A.①④⑥ B.①③⑤⑥ C.①②⑥ D.②③⑤ 2.我们日常食用的蔗糖,如果置于密闭的容器中加热会生成炭黑和水。这说明( B ) A.蔗糖是由炭黑和水组成的 B.蔗糖是由 C、H、O 元素组成的纯净物 C.蔗糖是由 C、H、O 元素组成的混合物 D.蔗糖中含有炭黑和水 3.下列现象能用质量守恒定律解释的是( B ) A.m g 水受热形成 m g 水蒸气 B.煤燃烧留下的煤灰比原煤的质量少 C.10 g 食盐溶于 70 g 水中得到 80 g 食盐水 D.湿衣服晾干后,质量变小 4.(齐齐哈尔中考)火箭推进器中盛有 N2H4 和 H2O2,发生反应的化学方程式为 N2H4+ 2H2O2===R+4H2O,其中 R 的化学式为(D) A.NO2 B.N2O4 C.NH3 D.N2 5.根据化学方程式 2AgBr=====光照 2Ag+Br2↑,无法获取的信息是( D ) A.反应条件及反应物、生成物的质量之比 B.反应物的某种化学性质 C.反应物和生成物的微粒个数比 D.反应物和生成物的体积比 6.(丰润期中)将 m g 磷放在 n g 氧气中充分燃烧,生成五氧化二磷的质量为(C) A.一定等于(m+n) g B.一定小于(m+n) g C.可能小于或等于(m+n) g D.以上答案均不对 7.在 2A+B===2C 反应中,已知 A 的相对分子质量是 28,C 的相对分子质量是 44,则 B 的相对分子质量是(D) A.16 g B.16 C.32 g D.32 8.(天水中考)把一定质量的 a、b、c、d 四种物质分别放入一个密闭容器中,在一定条 件下反应一段时间后测得反应后各物质的质量如下,下列说法中正确的是(D) 物质 a b c d 反应前的质量(g) 6.4 3.2 4.0 2.8 反应后的质量(g) 5.2 x 7.2 2.8 A.x 等于 2 B.d 是催化剂,能加快反应速率 C.c 不是化合物 D.反应前后原子的数目不变 9.(潍坊中考)在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反 应前及反应过程中两个时刻各物质的质量如图所示,图中 a、b、c、d 分别表示相应物质的 质量。下列说法正确的是(A) 2 A.b 的数值为 14 B.该反应为分解反应 C.反应过程中乙与丁发生改变的质量比为 5∶6 D.充分反应后生成丙的质量为 37.5 g 10(陕西中考)“宏观-微观-符号”是学习化学的重要内容和方法。甲、乙、丙是三个 变化过程的微观示意图,下列各项分析正确的是(D) A.3 个过程发生的均是化学变化 B.图示的所有物质均为化合物 C.三个变化前后原子、分子、离子数目均发生了改变 D.三个变化后的物质中,均含有同一种分子 11.在反应 2A+5B===2C+4D 中,C、D 的相对分子质量之比为 9∶22。若 1.3 g A 与一 定量的 B 恰好完全反应,生成 4.4 g D。则在此反应中 B 和 D 的质量比为( C ) A.4∶9 B.8∶1 C.10∶11 D.13∶44 12.实验室常用加热高锰酸钾固体制取氧气,化学方程式为 2KMnO4=====△ K2MnO4+MnO2 +O2↑,现对一定量的高锰酸钾固体进行加热,加热过程中涉及的相关量随时间变化的图象 正确的是( D ) A B C D 二、填空题(共 10 分) 13.(4 分)配平下列化学方程式: (1)__4__CO+__1__Fe3O4=====高温 __3__Fe+__4__CO2 (2)__2__CH3OH+__3__O2=====点燃 __2__CO2+__4__H2O (3)__2__Al+__6__HCl===__2__AlCl3+__3__ H2↑ 3 (4) __1__C+__2__CuO=====高温 __2__Cu+ __1__CO2↑ 14.(6 分)(常州中考)化学变化是反应物的原子重新组合转变成生成物的过程。如图是 某化学变化过程的微观示意图: (1)图示反应的化学方程式为 3O2 =====一定条件 2O3。 (2)下列关于图示反应的说法正确的是 B。 A.该反应属于化合反应 B.反应前后原子的种类不变 C.反应前后分子的个数 不变 (3)图示反应前后物质的质量之比为 1∶1。 三、简答题(共 18 分) 15.(8 分)火柴是生活必需品,火柴头上深色物质的主要成分是氯酸钾(KClO3)、二氧化 锰(MnO2)、硫磺和硫化锑(Sb2S3),火柴盒侧面涂有一层红褐色物质(红磷和玻璃粉),划火柴 时,发生氧化反应,引燃木条。写出其中的四个主要化学方程式: (1)一种含氧物质在催化剂作用下,借助摩擦,产生热量,放出氧气:2KClO3=====MnO2 △ 2KCl +3O2↑。 (2)Sb2S3 燃烧生成 Sb2O3 和 SO2:2Sb2S3+9O2=====点燃 2Sb2O3+6SO2。 (3)硫和氧气反应:S+O2=====点燃 SO2。 (4)红褐色物质和氧气反应,并产生白烟:4P+5O2=====点燃 2P2O5。 16.(10 分)质量守恒定律的发现对化学的发展做出了重要贡献。 (1)通过称量下列各组试剂在密闭容器内混合前后的总质量,能验证质量守恒定律的是 __C__(填字母)。 A.蔗糖和水 B.酒精和水 C.铁和氯化铜溶液 (2)在氧气中点燃红磷的实验过程,固体变化如图 1 所示。 ①该反应的基本反应类型为化合反应。 ②参加反应的氧气质量为__8.0__g。 图 1 图 2 (3)某反应的微观示意图如图 2 所示: ①该反应的化学方程式为__2F2+2H2O===4HF+O2__。 ②参加反应的甲物质和生成的丙物质分子数目比为__1∶2__。 4 四、实验题(共 26 分) 17.(14 分)(吉林期中)甲、乙、丙三组同学从不同的角度研究质量守恒定律。 (1)甲组研究反应:2H2+O2=====点燃 2H2O,他们从该反应中获取的信息有: ①该反应的反应物是氢气和氧气; ②该化学反应的条件是点燃; ③在化学反应前后元素种类和原子个数不变; ④反应的生成物是水; ⑤2 个氢气分子和 1 个氧气分子化合生成 2 个水分子。 (2)乙、丙两组同学分别设计了如图实验,图中试剂混合前后物质的总质量分别表示为 m(前)、m(后)。请根据图示回答: ①乙组实验中,m(前)>m(后),原因是二氧化碳气体逸出,若所用试剂不变,改进的方 法是将烧杯改成密闭容器。 ②丙组实验中的反应是否符合质量守恒定律?符合(填“符合”或“不符合”)。 ③丙组实验中有时会出现:红磷燃烧后,瓶塞突然“冲出”瓶口,请你分析此现象的可 能原因,并对实验装置进行改进,以避免这种现象发生。 可能原因:红磷燃烧放出热量,装置内的气压增大。 改进实验装置:把玻璃棒改成玻璃管,在玻璃管上装一个气球。 18.(12 分)金属钴(Co)在国防工业中有重要应用。某矿石中含有钴的氧化物(CoO、 Co2O3),研究人员在实验室用硫酸酸浸的方法提取钴元素,并探究最佳提取条件。 (1)写出下列化合物中 Co 元素的化合价:CoO__+2__,Co2O3___+3___。 (2)酸浸时钴的氧化物发生如下反应: 反应Ⅰ CoO+H2SO4===CoSO4+H2O 反应Ⅱ 2Co2O3+4H2SO4===4CoSO4+O2↑+4H2O 反应Ⅲ Co2O3+2H2SO4+Na2SO3===2CoSO4+2H2O+Na2SO4 反应后溶液中含钴元素的微粒是__Co2+__ (填化学符号)。 (3)为探究最佳提取条件,将矿石在一定条件下酸浸 4 小时,测量钴元素的浸出率部分 数据如下: 编号 矿石用 量(g) 硫酸用 量(g) Na2SO3 用量(g) 温度 (℃) 钴元素浸 出率(%) 1 85.71 12.62 0 85 56.39 2 85.71 6.31 0 85 49.98 3 85.71 6.31 0 65 43.33 4 85.71 6.31 0.43 65 73.95 5 85.71 6.31 0.86 65 74.77 ①实验研究了哪些因素对钴元素浸出率的影响:__硫酸用量、亚硫酸钠用量、温度__。 ②根据上表数据,其他条件不变,温度升高,钴元素的浸出率__增大__。 ③工业生产中采用实验__5__ (填编号)的提取条件更合理。 五、计算题(共 10 分) 5 19.(10 分)某校兴趣小组在实验室做制取氧气的实验。他们取氯酸钾和二氧化锰的混 合物 6.0 g 放入试管中进行加热,并在不同时刻测定试管内剩余固体的质量,结果记录如下 表。分析表中数据,完成下列问题: 反应时间/min 1.0 1.5 2.0 2.5 3.0 3.5 剩余固体质量/g 5.1 4.5 4.3 4.08 4.08 4.08 (1)氯酸钾中钾、氯、氧三种元素的质量比为 78∶71∶96(填最简整数比)。 (2)生成氧气的质量为 1.92 g。 (3)原混合物中二氧化锰的质量是多少? 解:设原混合物中氯酸钾的质量为 x。 2KClO3=====MnO2 △ 2KCl+3O2↑ 245 96 x 1.92 g 245 x = 96 1.92 g x=4.9 g 原混合物中二氧化锰的质量为 6.0 g-4.9 g=1.1 g。 答:原混合物中二氧化锰的质量为 1.1 g。查看更多