- 2021-05-28 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2016年第30届中国化学奥林匹克(初赛)试题及答案(WORD版)
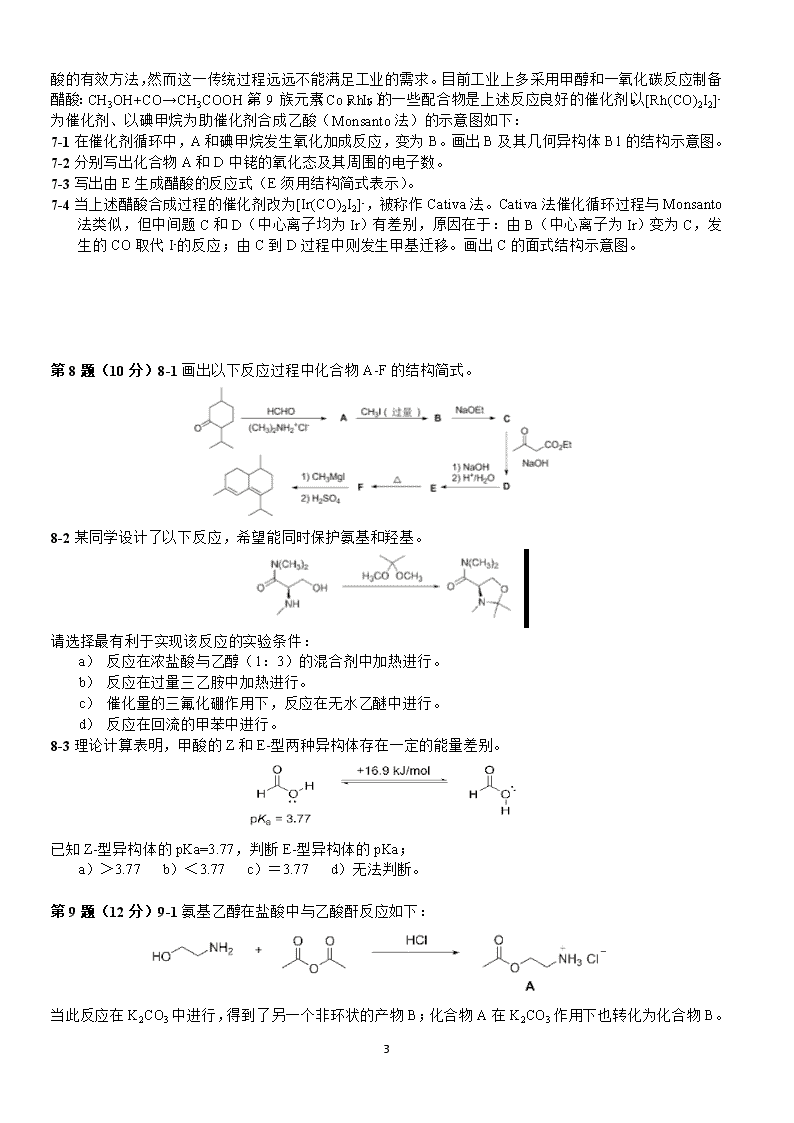
1 第 30 届中国化学奥林匹克(初赛)试题 第 1 题(8 分)1-1 离子化合物 A2B 由四种元素组成,一种为氢,另三种为第二周期元素。正、负离子皆 由两种原子构成且均呈正四面体构型。写出这种化合物的化学式。 1-2 对碱金属 Li、Na、K、Rb 和 Cs,随着原子序数增加以下哪种性质的递变不是单调的?简述原因。 (a)熔沸点 (b)原子半径 (c)晶体密度 (d)第一电离能 1-3 保险粉(Na2S2O4.2H2O)是重要的化工产品,用途广泛,可用来除去废水(pH~8)中的 Cr(Ⅵ),所得含硫 产物中硫以 S(Ⅳ)存在。写出反应的离子方程式。 1-4 化学合成的成果常需要一定的时间才得以应用于日常生活。例如,化合物 A 合成于 1929 年,至 1969 年才被用作牙膏的添加剂和补牙填充剂成分。A 是离子晶体,由 NaF 和 NaPO3 在熔融状态下反应得到。 它是易溶于水,阴离子水解产生氟离子和对人体无毒的另一种离子。 1-4-1 写出合成 A 的反应方程式。 1-4-2 写出 A 中阴离子水解反应的离子方程式。 第 2 题(9 分) 鉴定 NO3—离子的方法之一是利用“棕色环”现象:将含有 NO3—的溶液放入试管,加入 FeSO4,混匀,然后顺着管壁加入浓硫酸,在溶液的界面上出现“棕色环”。分离出棕色物质,研究发现其 化学式为[Fe(NO)(H2O)5]SO4。该物质显顺磁性,磁矩为 3.8μB(玻尔磁子),未成对电子分布在中心离子周 围。 2-1 写出形成“棕色环”的反应方程式。 2-2 推出中心离子的价电子组态、自旋态(高或低)和氧化态。 2-3 棕色物质中的 NO 的键长与自由 NO 分子中 N-O 键长相比,变长还是变短?简述理由。 第 3 题(13 分)3-1 好奇心是科学发展的内在动力之一。P2O3 和 P2O5 是两种经典的化合物,其分子结构已 经确定。自然而然会有如下问题:是否存在磷氧原子比介于二者之间的化合物? 由此出发,化学家合成并证实了这些中间化合物的存在。 3-1-1 写出这些中间化合物的分子式。 3-1-2 画出其中具有 2 重旋转轴的分子的结构图。根据键长不同,将 P-O 键 分组并用阿拉伯数字标出(键长相同的用同一个数字标识)。比较键角∠ O-P(Ⅴ)-O 和∠O-P(Ⅲ)-O 的大 小。 3-2 NH3 分子在独立存在时 H-N-H 键角为 106.7°。右图上[Zn(NH3)6]2+离子的部分结构以及 H-N-H 键角的 测量值。解释配合物中 H-N-H 键角变为 109.5°的原因。 3-3 量子化学计算预测未知化合物是现代化学发展的途径之一。2016 年 2 月 有人通过计算预言铁也存在四氧化物,其分子构型是四面体,但该分子中铁 的氧化态是+6 而不是+8。 3-3-1 写出该分子中铁的价电子组态。 3-3-2 画出该分子结构的示意图(用元素符号表示原子,用短线表示原 子间的化学键)。 2 第 4 题(10 分)固体电解质以其在电池、传感器等装置中的广泛应用而备受关注。现有一种由正离子 An+、 Bm+和负离子 X—组成的无机固体电解质,该物质 50.7℃上形成无序结构(高温相),50.7℃以下变为有序 结构(低温相),二者结构示意见右图。图中浅色球为负离子;高温相中的深色球为正离子或空位;低温 相中的大深色球为 An+离子,小深色球为 Bm+离子。 4-1 推出这种电解质的化学式,写出 n 和 m 的值。 4-2 温度变化会导致 晶体在立方晶系和四方晶系之间转换,上述哪种晶相属于立方晶系? 4-3 写出负离子的堆积方式及形成的空隙类型。指出正离子占据的空隙类型及占有率。 4-4 高温相具有良好的离子导电性,这源于哪种离子的迁移?简述导电性与结构的关系。 第 5 题(8 分)化学式为 MOxCly 的物质有氧化性,M 为过渡金属元素,x 和 y 均为正整数。将 2.905g 样 品溶于水,定容至 100mL。移取 20.00mL 溶液,加入稀硝酸和足量的 AgNO3,分离得到白色沉淀 1.436g。 移取溶液 20.00mL,加入适量硫酸,以 N-苯基邻氨基苯甲酸作指示剂,用标准硫酸亚铁溶液滴定至终点, 消耗 3.350mmol。已知其中阳离子以 MOxy+存在,推出该物质的化学式,指出 M 是哪种元素。写出硫酸 亚铁铵溶液滴定 MOxy+的离子反应方程式。 第 6 题(14 分)N2O4 和 NO2 的相互转化 N2O4(g)=2NO2(g)是讨论化学平衡问题的常用体系。已知该 反应在 295K 和 315K 温度下平衡常数 Kp 分别为 0.100 和 0.400。将一定量的其他充入一个带活塞的特制 容器,通过活塞移动使体系总压恒为 1bar(1bar=100kPa)。 6-1 计算 295K 下体系达平衡时 N2O4 和 NO2 的分压。 6-2 将上述体系温度升至 315K,计算达平衡时 N2O4 和 NO2 的分压。 6-3 计算恒压下体系分别在 315K 和 295K 达平衡时的体积比及物质的量之比。 6-4 保持恒压条件下,不断升高温度,体系中 NO2 分压最大值的理论趋近值是多少(不考虑其他反应)? 根据平衡关系式给出证明。 6-5 上述体系在保持恒外压的条件下,温度从 295K 升至 315K,下列说法正确的是: (a)平衡向左移动 (b)平衡不移动(c)平衡向右移动 (d)三者均有可能 6-6 与体系在恒容条件下温度从 295K 升至 315K 的变化相比,恒压下体系温度升高,下列说法正确的是 (简述理由,不要求计算): (a)平衡移动程度更大 (b)平衡移动程度更小 (c)平衡移动程度不变 (d)三者均有可能 3 第 7 题(8 分)乙醇在醋酸菌作用下被空气氧化是制造醋 酸的有效方法,然而这一传统过程远远不能满足工业的需 求。目前工业上多采用甲醇和一氧化碳反应制备醋酸: CH3OH+CO→CH3COOH。第 9 族元素(Co,Rh,Ir)的 一些配合物是上述反应良好的催化剂。以[Rh(CO)2I2]-为催 化剂、以碘甲烷为助催化剂合成乙酸(Monsanto 法)的示 意图如下: 7-1 在催化剂循环中,A 和碘甲烷发生氧化加成反应,变 为 B。画出 B 及其几何异构体 B1 的结构示意图。 7-2 分别写出化合物 A 和 D 中铑的氧化态及其周围的电子数。 7-3 写出由 E 生成醋酸的反应式(E 须用结构简式表示)。 7-4 当上述醋酸合成过程的催化剂改为[Ir(CO)2I2]-,被称作 Cativa 法。Cativa 法催化循环过程与 Monsanto 法类似,但中间题 C 和 D(中心离子均为 Ir)有差别,原因在于:由 B(中心离子为 Ir)变为 C,发 生的 CO 取代 I-的反应;由 C 到 D 过程中则发生甲基迁移。画出 C 的面式结构示意图。 第 8 题(10 分)8-1 画出以下反应过程中化合物 A-F 的结构简式。 8-2 某同学设计了以下反应,希望能同时保护氨基和羟基。 请选择最有利于实现该反应的实验条件: a) 反应在浓盐酸与乙醇(1:3)的混合剂中加热进行。 b) 反应在过量三乙胺中加热进行。 c) 催化量的三氟化硼作用下,反应在无水乙醚中进行。 d) 反应在回流的甲苯中进行。 8-3 理论计算表明,甲酸的 Z 和 E-型两种异构体存在一定的能量差别。 已知 Z-型异构体的 pKa=3.77,判断 E-型异构体的 pKa; a)>3.77 b)<3.77 c)=3.77 d)无法判断。 第 9 题(12 分)9-1 氨基乙醇在盐酸中与乙酸酐反应如下: 4 当此反应在 K2CO3 中进行,得到了另一个非环状的产物 B;化合物 A 在 K2CO3 作用下也转化为化合物 B。 9-1-1 画出化合物 B 的结构简式; 9-1-2 为什么在 HCl 作用下,氨基乙醇与乙酸酐生成化合物 A;而在 K2CO3 作用下,却生成化合物 B? 9-1-3 为什么化合物 A 在 K2CO3 作用下转化为化合物 B? 9-2 某同学设计如下反应条件,欲制备化合物 C。但反应后实际得到其同分异构体 E。 9-2-1 画出重要反应中间体 D 及产物 E 的结构简式。 在下面的反应中,化合物 F 与二氯亚砜在吡啶-乙醚溶液中发生反应时未能得到氯代产物,而是得到 了两种含有碳碳双键的同分异构体 G 和 H;没有得到另一个同分异构体 J。 9-2-2 画出 G、H 以及 J 的结构简式。 9-2-3 解释上述反应中得不到产物 J 的原因。 第 10 题(8 分)10-1 以下两种生物碱可以在室温下相互转化,在达到平衡态时,两者的比例为 3:2。画 出它们互相转换时中间体 A 的立体结构简式。 10-2 画出下面反应过程中合理的关键反应中间体的结构简式(3 个)。 5 6 7 8 9 10 11 12 13查看更多