- 2021-05-28 发布 |
- 37.5 KB |
- 53页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学:3-4-2《有机合成》课件(人教版选修5)
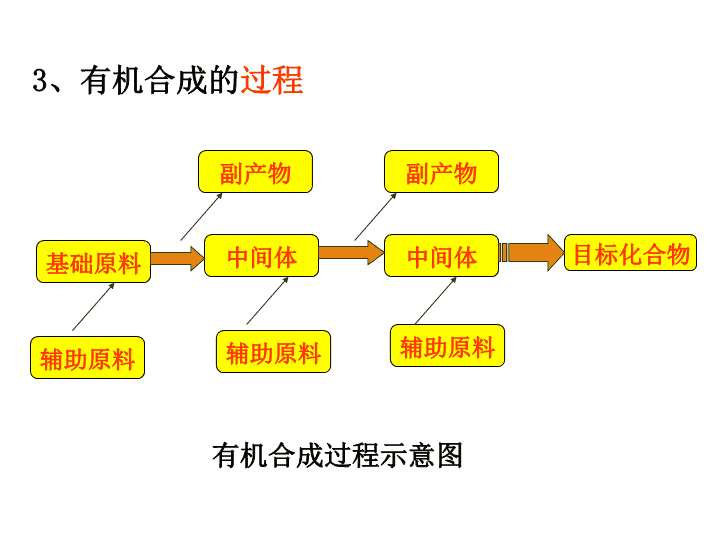
第四节 有机合成 第三章 烃的含氧衍生物 一、有机合成的过程 利用简单、易得的原料,通过有机反应, 生成具有特定结构和功能的有机化合物。 1、有机合成的概念 2、有机合成的任务 有机合成的任务包括目标化合物分子骨架 的构建和官能团的转化。 有机合成过程示意图 基础原料 辅助原料 副产物 副产物 中间体 中间体 辅助原料辅助原料 目标化合物 3、有机合成的过程 4、有机合成的设计思路 5、关键: 设计合成路线,即碳骨架的构建、官能团的引入和转化 。 6、有机物的相互转化关系:两碳有机物为例: CH3-CH3 CH3-CH2-Cl CH2=CH2 CH2Cl-CH2-Cl CHCH CH2=CHCl [ CH-CH ] n H Cl CH3-CH2-OH CH3-CHO CH3-COOH CH3COOC2H 5 CH3COON a 7、碳骨架的构建和官能团的引入 。 (1).碳骨架构建: 包括碳链增长和缩短 、成环和开环等。 构建方法会以信息形式给出。 (2.官能团的引入和转化: (1)官能团的引入: 思考与交流 1、引入碳碳双键的三种方法: 卤代烃的消去;醇的消去;炔烃的不完全加成。 2、引入卤原子的三种方法: 醇(或酚)的取代;烯烃(或炔烃)的加成; 烷烃(或苯及苯的同系物)的取代。 (2)官能团的转化: 包括官能团种类变化、数目变化、位置变化等。 3、引入羟基的四种方法: 烯烃与水的加成;卤代烃的水解;酯的水解;醛的还 原。 a.官能团种类变化: CH3CH2-Br 水解 CH3CH2- OH 氧化CH3-CHO b.官能团数目变化: CH3CH2-Br消去 CH2=CH2 加Br2 CH2Br-CH2Br c.官能团位置变化: CH3CH2CH2-Br消去 CH3CH=CH2 加HBrCH3CH-CH3 Br 二、有机合成的方法 1、有机合成的常规方法 (1)官能团的引入 ①引入双键(C=C或C=O) 1)某些醇的消去引入C=C CH3CH2 OH 浓硫酸 170℃ CH2==CH2↑ +H2O 醇 △ CH2=CH2↑+ NaBr+ H2O CH3CH2Br +NaOH 2)卤代烃的消去引入C=C 3)炔烃加成引入C=C 4)醇的氧化引入C=O ②引入卤原子(—X) 1)烃与X2取代 CH4 +Cl2 CH3Cl+ HCl光照 2CH3CH2OH+O2 2CH3CHO+2H2O催化剂 △ CH≡CH + HBr CH2=CHBr 催化剂 △ 3)醇与HX取代 CH2==CH2+Br2 CH2BrCH2Br 2)不饱和烃与HX或X2加成 ③引入羟基(—OH) 1)烯烃与水的加成 CH2==CH2 +H2O CH3CH2OH 催化剂 加热加压 2)醛(酮)与氢气加成 CH3CHO +H2 CH3CH2OH 催化剂 Δ C2H5OH + HBr C2H5Br + H2O△ 3)卤代烃的水解(碱性) C2H5Br +NaOH C2H5OH + NaBr 水 △ 4)酯的水解 稀H2SO4 CH3COOH+C2H5OHCH3COOC2H5 + H2O △ (2)官能团的消除 ①通过加成消除不饱和键 ②通过消去或氧化或酯化或取代等消除羟基 ③通过加成或氧化消除醛基 ④通过消去反应或水解反应可消除卤原子 (3)官能团的衍变 2、正向合成分析法 此法采用正向思维方法,从已知原料入手, 找出合成所需要的直接可间接的中间产物,逐步 推向目标合成有机物。 基础原料 中间体 中间体 目标化合物 正向合成分析法示意图 3、逆向合成分析法 是将目标化合物倒退一步寻找上一步反应的 中间体,该中间体同辅助原料反应可以得到目标 化合物。 基础原料中间体 中间体目标化合物 逆向合成分析法示意图 所确定的合成路线的各步反应,其反应条件 必须比较温和,并具有较高的产率,所使用物基 础原料和辅助原料应该是低毒性、低污染、易得 和廉价的。 2 C2H5OH C—OC2H5 C—OC2H5 O O C—OH C—OH O O + 草酸二乙酯的合成 H2C—OH H2C—OH H2C—Cl H2C—Cl CH2 CH2 C—H C—H O O 练习:用2-丁烯、乙烯为原料设计 的合成路线 认目标 巧切断 再切断 …… 得原料 得路线O O O O NaOH C2H5O H O O O O 1、逆合成分析: C OH C OH O O + C H C H O O CH2 CH2 OH OH CH2 CH2 Br Br CH2 CH2 NaOH 水 2、合成路线: CH2 CH2 Br2CH2 CH2 Br Br CH2 CH2 OH OH O2 Cu C H C H O O O2 C OH C OH O O 浓H2SO4 OH OH Br Br Br Br Br2Br Br Br2 Br BrNaOH 水 OH OH O O O O 第四节 有机合成(第二课时) 【预备知识回顾】 1、烷烃、烯烃、炔烃的制法及其主要化学性质 产物还有CH2Cl2、CHCl3、CCl4等。烷 烃及烷烃基的主要化学性质,注意反应条 件为光照 减少C原 子的方法 2 【预备知识回顾】 1、烷烃、烯烃、炔烃的制法及其主要化学性质 A—B为X2、HX、H2、H—OH、H—CN等 3 【预备知识回顾】 1、烷烃、烯烃、炔烃的制法及其主要化学性质 C=C和X2加成:往相邻碳上引入2个卤素原子; C=C和HX加成:引入1个卤素原子; C=C和水加成:引入一个羟基(—OH); C=C和HCN加成:增长碳链。 4 【预备知识回顾】 1、烷烃、烯烃、炔烃的制法及其主要化学性质 化学性质: 和HX、X2、H2、H2O、HCN等加成 5 【预备知识回顾】 1、烷烃、烯烃、炔烃的制法及其主要化学性质 炔烃不完全加成:引入C=C。如:乙炔和 HCl反应生成CH2=CHCl,既引入了C=C 也引入了—X原子; CH≡CH和水加成产物为乙醛:引入醛基 (或酮基) 。 6 【预备知识回顾】 2、苯及其同系物的化学性质 写出苯与液溴、浓硝酸和浓硫酸混合 液、浓硫酸、氢气反应的化学方程式。 思考: 如何往苯环上引入— X原子、—NO2、 —SO3H?如何将苯环转化为环己基? 7 2、苯及其同系物的化学性质 写出甲苯与浓硝酸和浓硫酸混合液反应的 化学方程式。 甲苯可以被酸性KMnO4溶液氧化为苯甲酸 此为往苯环上引入—COOH的方法 8 【预备知识回顾】 3、卤代烃的制取及其主要化学性质 引入一个卤 素(—X)原子往相邻碳上引 入2个卤素原子 9 【预备知识回顾】 3、卤代烃的制取及其主要化学性质 思考: 1、如何引入C=C? 2、如何引入羟基(—OH)? 化学性质: 请写出溴乙烷分别和NaOH水溶液、 NaOH醇溶液混合加热的化学方程式, 并指出其反应类型。 10 【预备知识回顾】 3、卤代烃的制取及其主要化学性质 一卤代烃的消去反应引入C=C、 一卤代烃的水解引入—OH 11 【预备知识回顾】 4、醇、醛、羧酸、酯的相互转化及其化学性质 请以乙醇为例写出上述转化的化学方程式: 思考:如何引入醇羟基、醛基、羧基、酯基 12 【预备知识回顾】 4、醇、醛、羧酸、酯的相互转化及其化学性质 乙醇的其它化学性质(写出化学方程式): 和金属钠的反应(置换反应) : 分子间脱水生成二乙醚(取代反应): 和HX的反应(取代反应) : 2Na + 2C2H5OH → 2C2H5ONa + H2↑ 2C2H5OH ——→ C2H5OC2H5 + H2O 浓硫酸 140℃ HBr + C2H5OH → C2H5Br + H2O 引入卤素原子 的方法之一 13 【预备知识回顾】 4、醇、醛、羧酸、酯的相互转化及其化学性质 乙醛的其它化学性质(写出化学方程式): 和银氨溶液的反应: 和新制Cu(OH)2悬浊液的反应: CH3CHO + 2Cu(OH)2 ——→ CH3COOH + Cu2O + 2H2O CH3CHO + 2Ag(NH3)2OH ——→ CH3COONH4 + 2Ag + 3NH3 + H2O 此两反应为将 醛基氧化为羧 基的方法之一 14 5、酚的主要化学性质(写出化学方程式): 苯酚与NaOH溶液的反应(酸碱中和): 苯酚钠溶液中通入CO2气体: 15 C6H5OH+NaOH → C6H5ONa+H2O C6H5ONa+CO2+H2O → C6H5OH+NaHCO3 【预备知识回顾】 (较强酸 制取 较弱酸) 5、酚的主要化学性质(写出化学方程式): 苯酚与FeCl3溶液反应,显特征的紫色 酚羟基可与羧酸反应生成酯,如:CH3COOC6H5 16 苯酚与溴水的反应(取代反应): 【预备知识回顾】 【归纳总结及知识升华 】 思考: 1、至少列出三种引入C=C的方法: 2、至少列出三种引入卤素原子的方法: 3、至少列出四种引入羟基(—OH)的方法: 4、在碳链上引入醛基和羧基的方法有: 5、如何增加或减少碳链? 17 【归纳总结及知识升华 】 思考: 1、至少列出三种引入C=C的方法: (1) 卤代烃消去 (2) 醇消去 (3) C≡C不完全加成等 18 【归纳总结及知识升华 】 思考: 2、至少列出三种引入卤素原子的方法: (1) 醇(或酚)和HX取代 (2) 烯烃(或炔烃)和HX、X2加成 (3) 烷烃(苯及其同系物)和X2的取代等 19 【归纳总结及知识升华 】 思考: 3、至少列出四种引入羟基(—OH)的方法: (1) 烯烃和水加成 (2) 卤代烃和NaOH水溶液共热(水解) (3) 醛(或酮)还原(和H2加成) (4) 酯水解 (5) 醛氧化(引入—COOH中的—OH)等 20 【归纳总结及知识升华 】 思考: 4、在碳链上引入醛基和羧基的方法有: 醛基: (1) R—CH2OH氧化 (2) 乙炔和水加成 (3) RCH=CHR‘ 适度氧化 (4) RCHX2水解等 21 【归纳总结及知识升华 】 思考: 4、在碳链上引入醛基和羧基的方法有: 羧基: (1) R—CHO氧化 (2) 酯水解 (3) RCH=CHR' 适度氧化 (4) RCX3水解等 22 【归纳总结及知识升华 】 思考: 5、如何增加或减少碳链? 增加: ① 酯化反应 ② 醇分子间脱水(取代反应)生成醚 ③加聚反应 ④缩聚反应 ⑤ C=C或C≡C和HCN加成等 23 【归纳总结及知识升华 】 思考: 5、如何增加或减少碳链? 减少: ① 水解反应:酯水解,糖类、 蛋白质(多肽)水解 ② 裂化和裂解反应; ③ 脱羧反应; ④ 烯烃或炔烃催化氧化(C=C或C≡C断开)等 24 【学以致用——解决问题 】 问题一 阅读课本,以乙二酸二乙酯为例,说明 逆推法在有机合成中的应用。 分析: C — O — C2H5 C — O — C2H5 O O HO— HO— H H CH2—OH CH2—OH CH2—Br CH2—Br 请课后在学案中完成上述化学方程式 +H2O 25 【学以致用——解决问题 】 问题二 写出由乙烯制备乙酸乙酯的设计思路,并 写出有关的化学方程式 : 乙烯 乙醇 乙醛 乙酸 乙酸乙酯 请课后在学案中完成相应的化学方程式 26 问题三 化合物A最早发现于酸牛奶中,它是人体内糖代谢 的中间体,A的钙盐是人们喜爱的补钙剂之一。A在某 催化剂的存在下进行氧化,其产物不能发生银镜反应。 在浓硫酸存在下,A可发生如下图所示的反应: 试写出: (1) 化合物A、B、C的结构简式: 、 、 。 (2) 化学方程式:A→D ,A→E 。 (3) 反应类型:A→D ,A→E 。 27 问题三 分析: 题中说“A的钙盐”,可知A含—COOH; 结合A的分子式,由A→C知,A还含有—OH, 由A在催化剂作用下被氧化的产物不能发生银 镜反应可知:A的—OH不在碳链的末端;3个 碳的碳链只有一种:C—C—C,—OH只能在中 间碳上。综上:A的结构简式为:CH3—CH—COOH OH 28 问题三 分析: A的结构简式为:CH3—CH—COOH OH 则B的结构简式为:CH3—CH—COOC2H5 OH 则C的结构简式为:CH3—CH—O—C—CH3 COOH O 29 问题三 分析: A的结构简式为:CH3—CH—COOH OH 则A→D的化学方程式为: CH3—CH—COOH OH 浓硫酸 H2O+CH2=CHCOOH 反应类型:消去反应 30 问题三 分析: A的结构简式为:CH3—CH—COOH OH 对比A和E的分子式,我们发现E的C原子 个数是A的2倍,推断可能是2分子的A反应生 成E,再对比H和O原子发现: 2A—E=2H2O, 结合A的结构简式,很明显是它们的羧基和醇 羟基相互反应生成酯基。所以: 31 问题三 分析: 将A的结构简式改写为: 则A生成E可表示为: O CH3—CH—C—OH O HO CH3—CH—C—OH O H HO—C—CH—CH3 O O H H2O H2O 即: CH—C CH3 O O C—CH CH3O O C C CC O O 32 问题三 分析: 则A→E的化学方程式为: 2CH3—CH—COOH OH 浓硫酸 2H2O + CH—C CH3 O O C—CH CH3O O 反应类型: 酯化反应 33 【学以致用——解决问题 】 习题1、以2-丁烯为原料合成: 1) 2-氯丁烷 H3C C H C H CH3 +HCl H3C H C H2 C CH3 Cl2) 2-丁醇H3C C H C H CH3 +H2O H3C H C H2 C CH3 OH 3) 2,3-二氯丁烷 H3C C H C H CH3 +Cl2 H3C H C H C CH3 Cl Cl4) 2,3-丁二醇 H3C C H C H CH3 +Cl2 H3C H C H C CH3 Cl Cl H3C H C H C CH3 Cl Cl +2H2O H3C H C H C CH3 OH NaOH 加热 OH +2HCl 5) 1,3-丁二烯 H3C C H C H CH3 +Cl2 H3C H C H C CH3 Cl Cl H3C H C H C CH3 Cl Cl +2NaOH C2H5OH 加热 H2C C H C H CH2 +2NaCl +2H2O 2、 1) + Cl2 光照 Cl + HCl 2) Cl + NaOH C2H5OH 加热 + NaCl +H2O 3) + Cl2 Cl Cl 4) Cl Cl C2H5OH 加 热 + 2NaCl+ 2H2O+ 2NaOH 5) + Br2 Br Br 6)Br Br + H2 Br Br 催化剂 7)Br Br 加热 + 2NaBr+ 2NaOH H2O HO OH 8) + 2CH3COOH HO OH 浓硫酸 加热 H3CCOO OOCCH3 +2H2O查看更多