- 2021-05-26 发布 |
- 37.5 KB |
- 14页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江苏省高考化学 冲刺训练 5.2 探究性实验
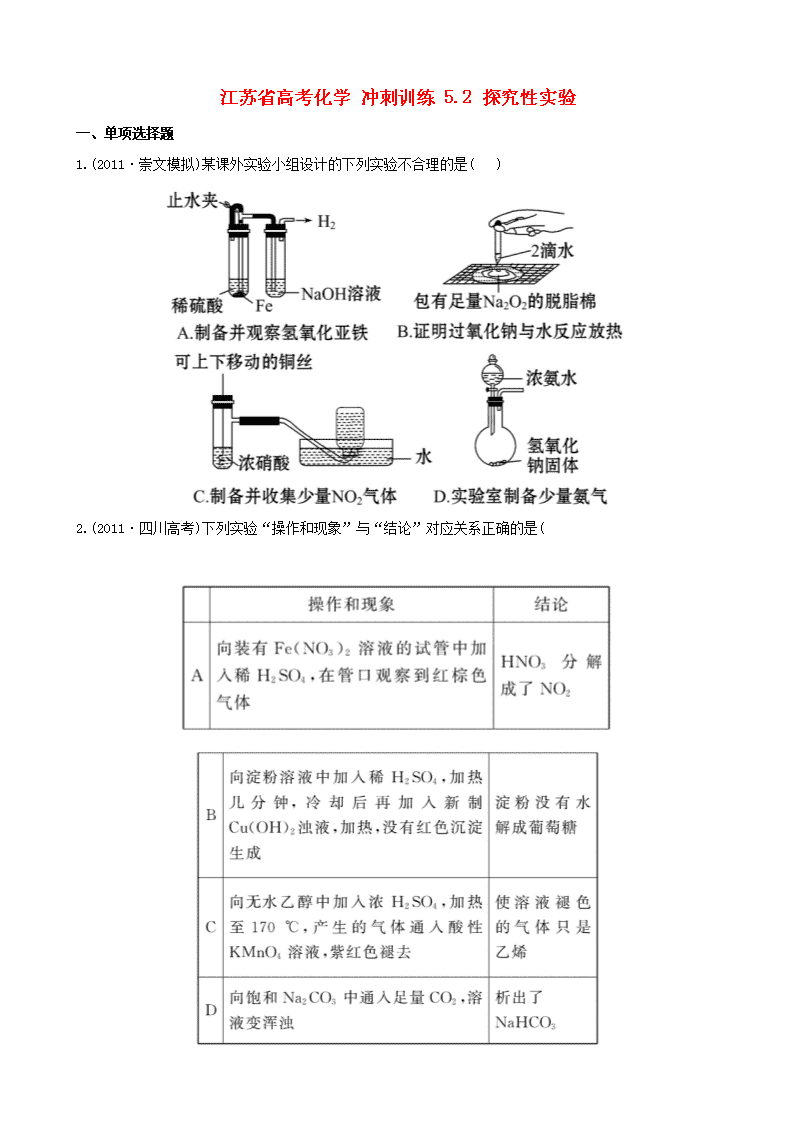
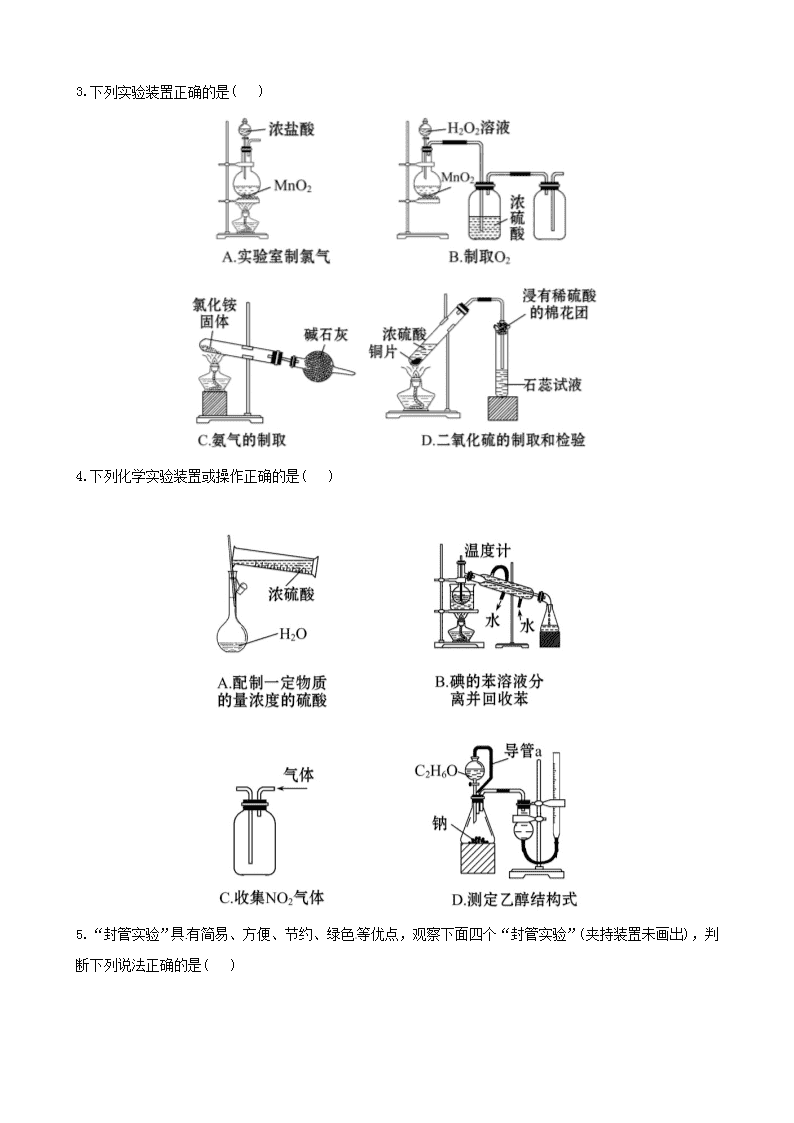
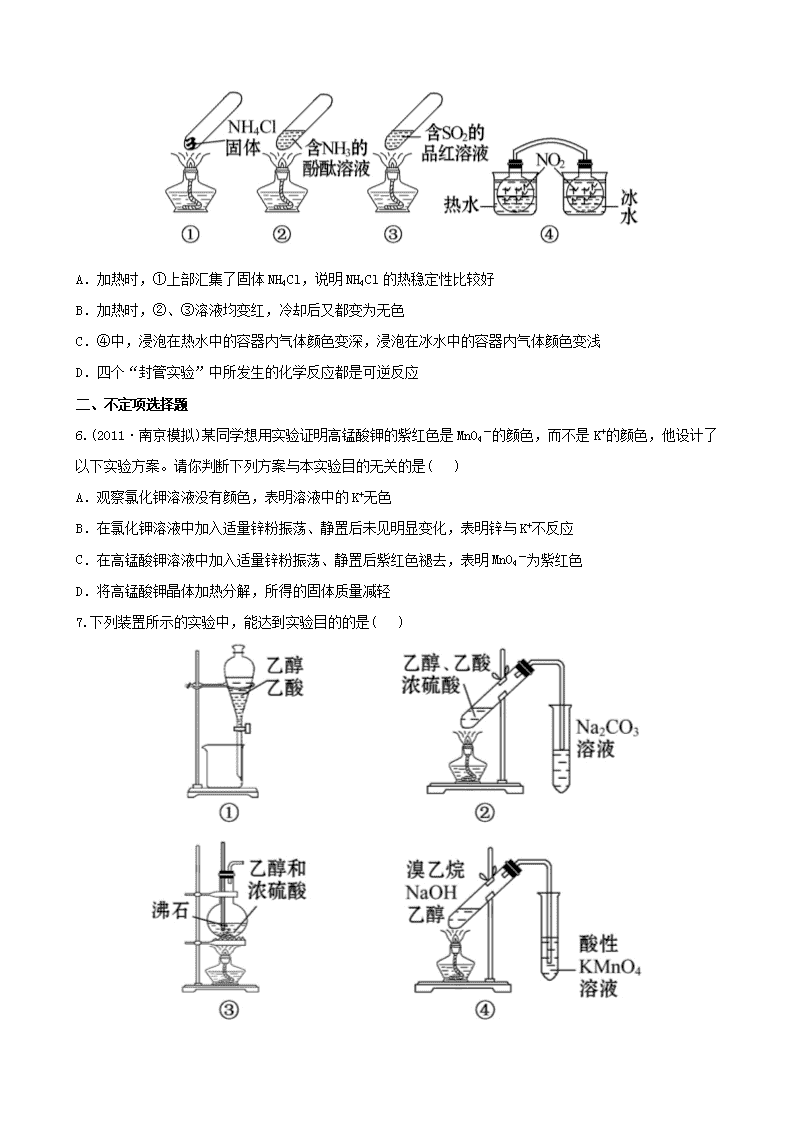
江苏省高考化学 冲刺训练 5.2 探究性实验 一、单项选择题 1.(2011·崇文模拟)某课外实验小组设计的下列实验不合理的是( ) 2.(2011·四川高考)下列实验“操作和现象”与“结论”对应关系正确的是( 3.下列实验装置正确的是( ) 4.下列化学实验装置或操作正确的是( ) 5.“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判 断下列说法正确的是( ) A.加热时,①上部汇集了固体 NH4Cl,说明 NH4Cl 的热稳定性比较好 B.加热时,②、③溶液均变红,冷却后又都变为无色 C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 D.四个“封管实验”中所发生的化学反应都是可逆反应 二、不定项选择题 6.(2011·南京模拟)某同学想用实验证明高锰酸钾的紫红色是 MnO4 -的颜色,而不是 K+的颜色,他设计了 以下实验方案。请你判断下列方案与本实验目的无关的是( ) A.观察氯化钾溶液没有颜色,表明溶液中的 K+无色 B.在氯化钾溶液中加入适量锌粉振荡、静置后未见明显变化,表明锌与 K+不反应 C.在高锰酸钾溶液中加入适量锌粉振荡、静置后紫红色褪去,表明 MnO4 -为紫红色 D.将高锰酸钾晶体加热分解,所得的固体质量减轻 7.下列装置所示的实验中,能达到实验目的的是( ) A.装置①可用于乙醇与乙酸的分离 B.装置②可用于实验室中制取少量的乙酸乙酯 C.装置③可用于实验室制取少量的乙烯 D.装置④可用于证明溴乙烷与 NaOH 醇溶液共热生成乙烯 8.(2011·无锡模拟)下列相关实验不能达到预期目的的是( ) 三、非选择题 9.(2010·江苏高考)高纯 MnCO3 是制备高性能磁性材料的主要原料。实验室以 MnO2 为原料制备少量高纯 MnCO3 的操作步骤如下: (1)制备 MnSO4 溶液: 在烧瓶中(装置见下图)加入一定量 MnO2 和水,搅拌,通入 SO2 和 N2 混合气体,反应 3 h。停止通入 SO2,继 续反应片刻,过滤(已知 MnO2+H2SO3====MnSO4+H2O)。 ①石灰乳参与反应的化学方程式为_____________________________________。 ②反应过程中,为使 SO2 尽可能转化完全,在通入 SO2 和 N2 比例一定、不改变固液投料的条件下,可采取的 合理措施有____________________、____________________。 ③若实验中将 N2 换成空气,测得反应液中 Mn2+、SO4 2-的浓度随反应时 间 t 变化如图。 导致溶液中 Mn2+、SO4 2-浓度变化产生明显差异的原因是__________。 (2)制备高纯 MnCO3 固体:已知 MnCO3 难溶于水、乙醇,潮湿时易被 空气氧化, 100 ℃开始分解;Mn(OH)2 开始沉淀时 pH=7.7。请补充由(1)制得的 MnSO4 溶液制备高纯 MnCO3 的操作步骤[实 验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。 ①__________;②__________;③__________;④__________;⑤低于 100 ℃干燥。 10.[问题提出] 教材中在检验 Cu 与稀硝酸反应的还原产物时,实验直接在试管中进行,由于试管中有 空气,开始往往看到的是红棕色气体,导致实验现象与实验原理无法吻合。某校化学活动小组对这一实验 进行了研究,并提出改进措施。 [研究目的与要求 ] (1)克服教材实验的缺点,并能证明 Cu 与稀硝酸反应生成的是 NO。NO 不溶于水,可以与 O2 反应产生红棕 色的 NO2。 (2)改进后的实验必须达到的要求:节约药品、操作简便、现象明显、减少污染。 [实验过程] 实验方案一: (1)按图 1 所示接好仪器 检查装置气密性的方法是_________________________ ___________________________________________________________________。 (2)根据你对装置和研究目的的理解,请补充制取 NO 并验证 NO 不溶于水的实验操作: _______________________________________________________________ ___________________________________________________________________。 (3)验证 NO 和 O2 生成 NO2 的实验操作和现象是______________________________ ___________________________________________________________________。 实验方案二: (4)按图 2 所示连接装置,检查气密性后,在干燥管内加入 3.2 g 铜片 ,在烧杯中加入适量经过预热的稀 硝酸。 (5)打开止水夹,用注射器快速抽空干燥管内的空气,使稀硝酸充满整个干燥管,然后关闭止水夹。观察 到的现象是______________________________________。 (6)反应停止后,打开止水夹,用注射器将抽取的空气慢慢推入干燥管内,发现干燥管内的气体变成红棕 色,且液面缓缓上升,Cu 和稀硝酸反应继续进行。不断充入 O2,直至加入的 3.2 g Cu 完全反应,则共消 耗的氧气在标准状况下的体积为__________L。 11.(2011·天津高考)某研究性学习小组为合成 1-丁醇,查阅资料得知一条合成路线: CH3CH=CH2+CO+H2 一定条件 CH3CH2CH2CHO 2H Ni,△ CH3CH2CH2CH2OH; CO 的制备原理:HCOOH 2 4H SO浓 △ CO↑+H2O,并设计出原料气的制备装置(如图)。 请填写下列空白: (1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化 学反应方程式:_________________,_______________。 (2)若用以上装置制备干燥纯净的 CO,装置中 a 和 b 的作用分别是__________,____________________;c 和 d 中盛装的试剂分别是____________________,____________________。 若用以上装置制备 H2,气体发生装置中必需的玻璃仪器名称是__________;在虚线框内画出收集干燥 H2 的装置图。 (3)制丙烯时,还产生少量 SO2、CO2 及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺 序是__________ (填序号)。 ①饱和 Na2SO3 溶液 ②酸性 KMnO4 溶液 ③石灰水 ④无水 CuSO4 ⑤品红溶液 (4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用 的适宜反应条件是__________。 a.低温、高压、催化剂 b.适当的温度、高压、催化剂 c.常温、常压、催化剂 d.适当的温度、常压、催化剂 (5)正丁醛经催化加氢得到含少量正丁醛的 1-丁醇粗品。为纯化 1-丁醇,该小组查阅文献得知:①R— CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚 34 ℃,1-丁醇 118 ℃,并设计出如下提纯路线: 试剂 1 为__________,操作 1 为__________,操作 2 为__________,操作 3 为__________。 12.已知,室温下存在反应 3HNO2====HNO3+2NO↑+H2O;在酸性溶液中,NO2 -可将 MnO4 -还原为 Mn2+且无气 体生成。某化学兴趣小组设计了如下探究实验: 请回答下列问题: (1)装置 A 的试管中发生反应的化学方程式是____________________。 (2)B 瓶中可以观察到的现象是____________________,C 瓶出来的气体是____________________。 (3)实验时观察到 D 管内固体颜色逐渐变为白色。据此甲同学认为 D 管中生成物是 NaNO3,而乙同学则认为 D 管中生成的是 NaNO2,请设计实验证明乙同学的观点正确。 (4)E 装置的作用是______________________________。 (5)该小组的同学经讨论认为上述装置仍有缺陷,为了避免 D 管中生成 NaOH,你认为应该进行的改进是 _______________________________________________ ___________________________________________________________________。 高考创新预测 1.下列有关实验原理、装置、操作或结论的描述中,不正确的是(有关装置中的夹持仪器略去) ( ) 2.某校化学研究性学习小组查阅资料了解到以下内容: 乙二酸(HOOC—COOH,可简写为 H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于 碳酸,其熔点为 101.5 ℃,在 157 ℃升华。为探究乙二酸的部分化学性质,进行了如下实验: (1)向盛有 1 mL 饱和 NaHCO3 溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方 程式为______________________________________。 (2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的 KMnO4 溶液,振荡,发现其溶液的紫红色褪去,说 明乙二酸具有__________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式: __________MnO4 -+__________H2C2O4+__________H+====__________Mn2++____CO2↑+__________H2O (3)将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出): 实验发现:装置 C、G 中澄清石灰水变浑浊,B 中 CuSO4 粉末变蓝,F 中 CuO 粉末变红。据此回答: 上述装置中,D 的作用是_______________________________________________。 乙二酸分解的化学方程式为___________________________________________。 (4)该小组同学将 2.52 g 乙二酸晶体(H2C2O4·2H2O)加入到 100 mL 0.2 mol·L-1 的 NaOH 溶液中充分反应, 测得反应后溶液呈酸性,其原因是__________________ ___________________________________________________(用文字简单表述)。 (5)以上溶液中各离子的浓度由大到小的顺序为:__________________________ (用离子符号表示)。 答案解析 1.【解析】选 C。A 项,生成的 H2 能将体系中的 O2 排出,观察到 Fe(OH)2 白色沉淀;B 项,脱脂棉燃烧,能 说明 Na2O2 与水反应放热;C 项,不能用排水法收集 NO2 气体;D 项,NaOH 溶于水放热,且提供 OH-,抑制 NH3·H2O 的电离,能用于制备少量 NH3。 2.【解析】选 D。A 项会发生反应:3Fe2++4H++NO3 -====3Fe3++NO↑+2H2O, 2NO+O2====2NO2,NO2 是红棕色气体, 由此可知 NO2 不是 HNO3 分解产生的,故 A 错误;B 项淀粉水解后未加 NaOH 溶液调成碱性环境,故 B 错误; C 项产生的气体除乙烯外,还含有 SO2,因此使酸性 KMnO4 溶液褪色的不能确定只是乙烯,故 C 错误;D 项 发生的反应为:Na2CO3+CO2+H2O====2NaHCO3,析出了 NaHCO3,由此可知 D 项正确。 3.【解析】选 A。 A 项是实验室制取氯气的装置;B 项收集氧气应该“长进短出”;C 项氯化铵固体分解生 成氨气和氯化氢,氨气和氯化氢在试管口又化合成氯化铵固体,得不到氨气,甚至可能会堵塞导管;D 项 浸有稀硫酸的棉花团不能吸收 SO2,应改为“浸有 NaOH 溶液的棉花团”。 4.【解析】选 D。浓硫酸稀释不能在容量瓶中进行,更不能将浓硫酸倒入水中,A 项错;蒸馏时温度计水 银球应在蒸馏烧瓶支管口下沿相切处,B 项错;收集比空气密度大的 NO2 气体应长进短出,C 项错,所以答 案为 D。 5.【解析】选 C。加热时 NH4Cl 分解为 NH3 和 HCl,在封管上部遇冷 NH3 和 HCl 又化合成 NH4Cl,说明 NH4Cl 的热稳定性差,故 A 项错误;加热时②溶液变无色,冷却后变为红色,加热时③溶液变为红色,冷却后变 为无色,故 B 项错误;由于 2NO2 N2O4 为放热反应,浸泡在热水中的容器内气体颜色变深,浸泡在冰 水中的容器内气体颜色变浅,故 C 项正确;封管①中发生的化学反应不是可逆反应,故 D 项错误。 6.【解析】选 D。氯化钾在水中完全电离,溶液无色,则 K+无色,A 正确;由 B、C 两项对比分析可知,锌 不与 K+反应,紫红色褪去只能是锌与 MnO4 -反应,则证明 MnO4 -为紫红色,B、C 两项正确;高锰酸钾晶体加 热分解,所得固体质量减轻不能达到实验目的,D 不正确。 7.【解析】选 B、C。装置①中乙酸与乙醇互溶,不能用分液法分离,A 错;装置④应该在两装置间添加除 乙醇装置,D 错。 8.【解析】选 A、C。温度、浓度对反应速率也有影响,因此欲探究接触面积对化学反应速率的影响必须控 制其他条件均相同;蔗糖在稀硫酸溶液中水解后,应加入 NaOH 溶液中和掉硫酸,使溶液呈碱性,否则加 入新制 Cu(OH)2 悬浊液并加热时,得不到 Cu2O 红色沉淀,也无法探究蔗糖水解产物具有还原性。 9.【解析】本题主要考查的是实验的基本操作、实验仪器的选择、实验误差分析。因此实验基础的考查依 然是以后学习和复习的重点。(1)①石灰乳参与反应主要是与 SO2 的反应。②为使 SO2 尽快转化,在比例不 变的情况下,可以通过控制温度或控制气体的流速以确保反应的充分进行;③从图中可以看出,c(Mn2+)减 少,c(SO4 2-)增加,可以认为 Mn2+在 O2 与 H2SO3 反应中起了催化作用;(2)根据题给信息,可以得出制备高纯 MnCO3 的操作流程:加入 NaHCO3 溶液,同时控制溶液的 pH<7.7→过滤、洗涤→检验 SO4 2-是否被除去→为了 降低 MnCO3 的损耗,用 C2H5OH 洗涤→低温干燥。 答案:(1)①Ca(OH)2+SO2====CaSO3+H2O ②控制适当的温度 缓慢通入混合气体 ③Mn2+催化 O2 与 H2SO3 反应生成 H2SO4 (2)①边搅拌边加入 NaHCO3(Na2CO3 ),并控制溶液 pH<7.7 ②过滤,用少量水洗涤 2~3 次 ③检验 SO4 2- 是否被洗涤除去 ④用少量 C2H5OH 洗涤 (凡合理答案均可) 10.【解析】题干已经指出教材实验的不足,并提出了改进实验方案的要求,要克服教材实验的缺点,必 须使反应在无 O2 的环境中进行。 实验方案一: (1)根据实验装置图 1 可以确定检查装置气密性的方法是关闭活塞,从 U 形管的右端加水使两边产生液面 差,静置一会,观察液面差是否缩小。 (2)连接好装置,打开活塞,从 U 形管的右端快速注入稀硝酸,直到左端完全充满液体,关闭活塞,会发 现 U 形管中液面左降右升,这就证明了生成的 NO 不溶于水。 (3)打开分液漏斗的活塞,在压力作用下,NO 会进入分液漏斗内,与分液漏斗中的空气反应生成红棕色气 体 NO2。 实验方案二: (5)根据操作和装置知反应时铜片表面有气泡产生,液面下降,溶液变蓝等现象。 (6)根据电子守恒:2n(O2) =n(Cu)=3.2÷64=0.05(mol),V(O2)=0.56 L。 答案:(1)关闭活塞,从 U 形管的右端加水,使两边产生液面差,静置一会,观察液面差是否缩小 (2)连接好装置,打开活塞,从 U 形管的右端注入稀硝酸,直到左端完全充满液体,然后关闭活塞,观察 现象 (3)将活塞慢慢打开,观察到分液漏斗内有红棕色气体生成 (5)干燥管内铜片溶解,表面有气泡产生,干燥管内液面逐渐下降,溶液变成蓝色,当稀硝酸不与铜片接 触时,液面停止下降 (6)0.56 11.【解析】(1)选择锌和稀盐酸反应制氢气,2-丙醇在浓硫酸中发生消去反应制丙烯,反应方程式是 Zn+2HCl====ZnCl2+H2↑、 2 4H SOV 浓 CH3CH=CH2↑+H2O。 (2)导管 a 连通了分液漏斗上部和蒸馏烧瓶的上部,使二者压强相等,起到了保持恒压的作用,有利于分 液漏斗中的液体顺利滴下;锥形瓶 b 起到了安全瓶的作用,可以防倒吸;若用上述装置制取 H2,气体发生 装置中必需的玻璃仪器是分液漏斗和蒸馏烧瓶;要收集干燥的氢气必须用向下排空气法收集氢气。 (3)先通过使无水硫酸铜变蓝来检验水蒸气,检验丙烯之前必须先检验二氧化硫,因为二者都可以使酸性 高锰酸钾溶液褪色,用品红溶液来检验二氧化硫,检验完后用饱和亚硫酸钠溶液将二氧化硫除去,再检验 丙烯和二氧化碳(二者顺序可互换)。 (4)合成正丁醛的反应为放热反应,降温有利于平衡正向移动,但是温度越低反应速率越小,故温度不能 太高也不能太低,必须采用适当的温度;合成正丁醛的反应是气体体积减小的反应,故高压既有利于反应 正向移动又有利于提高反应速率;使用催化剂有利于提高反应速率。 (5)根据信息可知正丁醛会和饱和 NaHSO3 溶液反应得到钠盐沉淀,故试剂 1 为饱和 NaHSO3 溶液,操作 1 是 过滤;滤液是 1-丁醇的水溶液,加入乙醚进行萃取后分液,故操作 2 是萃取;有机层经过干燥之后,再利 用 1-丁醇和乙醚的沸点差异进行蒸馏分离。 答案:(1)Zn+2HCl====ZnCl2+H2↑ 2 4H SOV 浓 CH3CH=CH2↑+H2O。 (2)保持恒压 防倒吸 NaOH 溶液 浓 H2SO4 分液漏斗、蒸馏烧瓶 (3)④⑤①②③(或④⑤①③②) (4)b (5)饱和 NaHSO3 溶液 过滤 萃取 蒸馏 12.【解析】装置 A 的试管中发生的是 C 与浓硝酸的反应,生成的 CO2 和 NO2 混合气体进入 B 装置与水反应, 生成的硝酸与 Cu 反应,B 瓶中可以观察到的现象是:产生无色气体,溶液逐渐变蓝。C 瓶出来的气体是 NO。 要验证 D 管中生成的是否是 NaNO2,可通过以下方法来验证:一种方法是将生成物置于试管中,加入稀硫 酸,产生无色气体并在液面上方变为红棕色;另一种方法是将生成物置于试管中,加入酸性 KMnO4 溶液, 看溶液紫色是否褪去。E 装置的作用是吸收尾气,以免污染空气。为避免 D 管中生成 NaOH,可在 C、D 之 间增加一个干燥装置。 答案:(1)C+4HNO3(浓) △ CO2↑+4NO2↑+2H2O (2)产生无色气体,溶液逐渐变蓝 NO (3)将生成物置于试管中,加入稀硫酸 产生无色气体并在液面上方变为红棕色 3NO2 -+2H+====NO3 - +2NO↑+H2O、2NO+O2====2NO2(或将生成物置于试管中,加入酸性 KMnO4 溶液 溶液紫色褪去 5NO2 - +2MnO4 -+6H+====5NO3 -+2Mn2++3H2O) (4)吸收尾气,以免污染空气 (5)在 C、D 之间增加一个盛浓硫酸的洗气瓶(或在 C、D 之间增加一个装无水 CaCl2 的干燥管) 高考创新预测 1.【解析】选 C。因碘在溶液中具有一定的溶解性,它不会从溶液中 析出,故无法用过滤的方法分离。 2.【解析】(1)由于题中强调足量的乙二酸,故反应后乙二酸转化为 HC2O4 -,若写成 C2O4 2-是错误的。 (2)中显然说明乙二酸具有还原性,把 MnO4 -还原为 Mn2+。 (3)由各物质的性质可推测 B 中 CuSO4 固体检验乙二酸分解产物中的水,C 装置检验乙二酸分解产物中的 CO2, D 装置的目的是为了除尽 CO 2,防止影响后续实验现象的判断,E 装置用来干燥气体,F、G 装置用来判断乙 二酸分解产物中有无 CO 生成。 (4)两者正好 1∶1 反应生成 NaHC2O4,溶液显酸性说明 HC2O4 -的电离程度大于其水解程度。(5)由(4)中原因 可得离子浓度间的大小关系。 答案:(1)HCO3 -+H2C2O4====HC2O4 -+CO2↑+H2O (2)还原性 2 5 6 2 10 8 (3)除去混合气体中的 CO2 H2C2O4 △ H2O+CO↑+CO2↑ (4)反应所得溶液为 NaHC2O4 溶液,由于 HC2O4 -的电离程度比水解程度大,导致溶液中 c(H+)>c(OH-),所以溶 液呈酸性 (5)Na+>HC2O4 ->H+>C2O4 2->OH-查看更多