- 2021-05-26 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学冲刺素养提升专项练八含解析
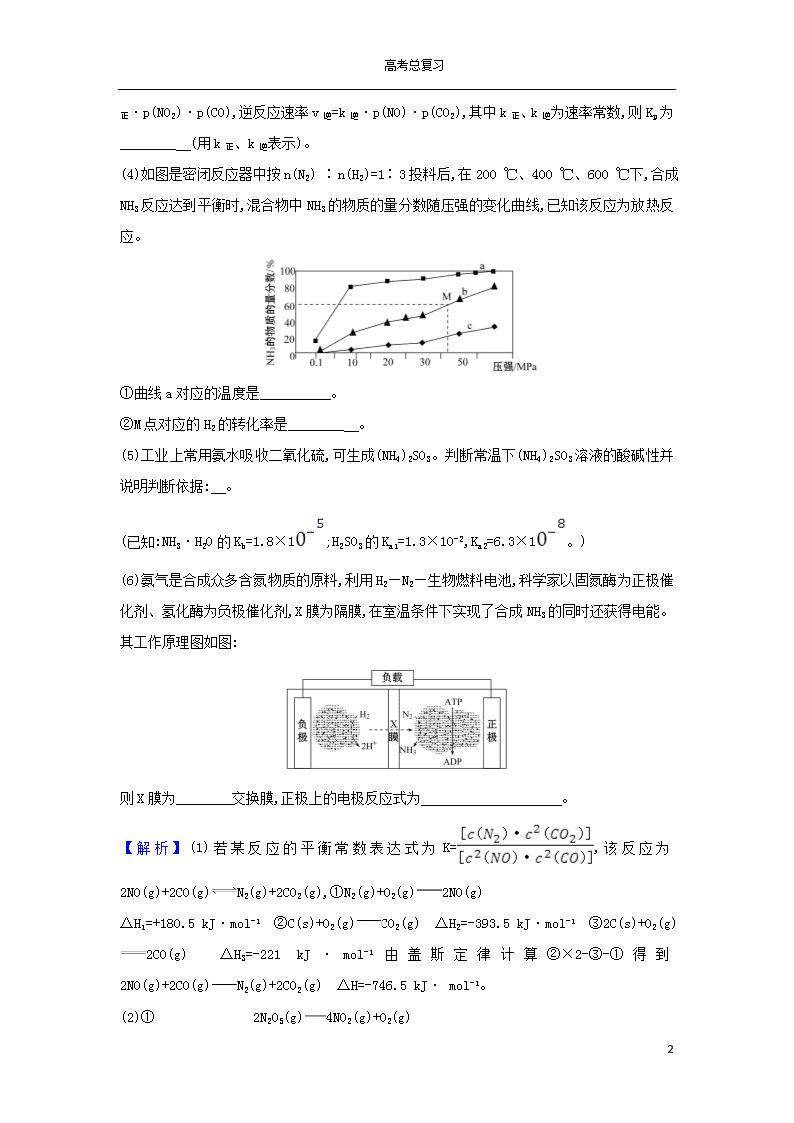
高考总复习 素养提升专项练 (八) (建议用时50分钟) 1.“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题: (1)已知:N2(g)+O2(g)2NO(g) ΔH1=+180.5 kJ·mol-1 C(s)+O2(g)CO2(g) ΔH2=-393.5 kJ·mol-1 2C(s)+O2(g)2CO(g) ΔH3=-221 kJ·mol-1 若某反应的平衡常数表达式为K=,则此反应的热化学方程式为 。 (2)N2O5在一定条件下可发生分解:2N2O5(g)4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表: t/min 0 1 2 3 4 5 c(N2O5)/ (mol·L-1) 1.00 0.71 0.50 0.35 0.25 0.17 ①反应开始时体系压强为p0,第2 min时体系压强为p1,则p1∶p0=________ 。2~5 min内用NO2表示的该反应的平均反应速率为 。 ②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________ (填字母)。 a.NO2和O2的浓度比保持不变 b.容器中压强不再变化 c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变 (3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)NO(g)+CO2(g),该反应中正反应速率v正=k 15 高考总复习 正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为________ (用k正、k逆表示)。 (4)如图是密闭反应器中按n(N2) ∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。 ①曲线a对应的温度是________ 。 ②M点对应的H2的转化率是________ 。 (5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据: 。 (已知:NH3·H2O的Kb=1.8×1;H2SO3的Ka1=1.3×10-2,Ka2=6.3×1。) (6)氨气是合成众多含氮物质的原料,利用H2—N2—生物燃料电池,科学家以固氮酶为正极催化剂、氢化酶为负极催化剂,X膜为隔膜,在室温条件下实现了合成NH3的同时还获得电能。其工作原理图如图: 则X膜为________交换膜,正极上的电极反应式为 。 【解析】(1)若某反应的平衡常数表达式为K=,该反应为2NO(g)+2CO(g)N2(g)+2CO2(g),①N2(g)+O2(g)2NO(g) ΔH1=+180.5 kJ·mol-1 ②C(s)+O2(g)CO2(g) ΔH2=-393.5 kJ·mol-1 ③2C(s)+O2(g)2CO(g) ΔH3=-221 kJ·mol-1由盖斯定律计算②×2-③-①得到2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=-746.5 kJ· mol-1。 (2)① 2N2O5(g)4NO2(g)+O2(g) 15 高考总复习 开始(mol·L-1) 1.00 0 0 反应(mol·L-1) 0.5 1 0.25 2 min(mol·L-1) 0.5 1 0.25 反应前后气体的压强之比等于其物质的量之比,所以p1∶p0=(0.5+1+0.25) mol∶1.00 mol=7∶4(或1.75∶1),2~5 min内用NO2表示的该反应的平均反应速率为v(NO2)==0.22 mol·L-1·min-1;②NO2和O2的浓度比始终保持不变,不能确定反应是否达到化学平衡状态,a项错误;该反应是气体体积增大的反应,容器中的压强不断地发生变化,当容器中压强不再变化,反应已达到化学平衡状态,b项正确;v正(NO2)=2v逆(N2O5)才表明达到化学平衡状态,c项错误;在恒容的条件下,该反应气体的密度始终保持不变,不能确定反应是否达到化学平衡状态,d项错误。(3)平衡时正逆反应速率相等,由正反应速率v正= k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),联立可得Kp=。(4)①合成氨反应放热,温度越低氨气的百分含量越高,所以,曲线a对应的温度是 200 ℃。 ②按1 mol N2与3 mol H2反应,设N2反应的物质的量为x N2(g)+3H2(g)2NH3(g) 反应前(mol) 1 3 0 反应(mol) x 3x 2x 平衡时(mol) 1-x 3-3x 2x 据题意M点时:=60%,x=,则氢气的转化率为×100%=75%。(5)铵根离子水解使溶液显酸性,亚硫酸根离子水解使溶液显碱性,铵根离子水解得到氨水,亚硫酸根离子水解得到亚硫酸氢根离子,亚硫酸根离子是H2SO3的第二步电离,由于Kb(NH3·H2O)>Ka2,说明氨水比亚硫酸氢根离子的电离能力强,根据越弱越水解,铵根离子的水解程度小于亚硫酸根离子的水解程度,故溶液显碱性。 (6)由图知,正极上N2转化为NH3时需要结合氢离子,故负极上生成的H+应移向正极,X膜为质子交换膜或阳离子交换膜,N2在正极上得到电子后转化为NH3。 答案:(1)2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=-746.5 kJ· mol-1 (2)①7∶4(或1.75∶1) 15 高考总复习 0.22 mol·L-1·min-1 ②b (3) (4)①200 ℃ ②75% (5)显碱性,因为Kb(NH3·H2O)>Ka2(H2SO3),所以S水解程度大(或其他合理解释) (6)质子 N2+6e-+6H+2NH3 2.(2020·惠州模拟)氮的化合物在生产生活中广泛存在。 键能/ (kJ·mol-1) 391 243 191 431 化学键 N-H Cl-Cl N-Cl H-Cl (1)①氯胺(NH2Cl)的电子式为____________。可通过反应NH3(g)+Cl2(g)NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示,则上述反应的ΔH=________ 。 ②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。 (2)用焦炭还原NO的反应为2NO(g)+C(s)N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400 ℃、400 ℃、T ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示: t/min 0 40 80 120 160 n(NO)(甲容器, 400 ℃)/mol 2.00 1.50 1.10 0.60 0.60 n(NO)(乙容器, 400 ℃)/mol 1.00 0.80 0.65 0.53 0.45 n(NO)(丙容器, T ℃)/mol 2.00 1.00 0.50 0.50 0.50 ①该正反应为____ (填“放热”或“吸热”)反应。 ②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)=____ 。 (3)用焦炭还原NO2的反应为2NO2(g)+2C(s)N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示: 15 高考总复习 ①A、B两点的浓度平衡常数关系:Kc(A)________Kc(B)(填“<”“>”或“=”)。 ②A、B、C三点中NO2的转化率最低的是 (填“A”“B”或“C”)点。 ③计算C点时该反应的压强平衡常数Kp(C)=________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。 【解析】(1)①氯胺(NH2Cl)为共价化合物,电子式为;反应热ΔH=反应物的键能之和-生成物的键能之和=(3×391+243)-(2×391+191+431) =+12(kJ·mol-1); ②NH2Cl与水反应生成氨气和具有强氧化性的次氯酸,可作长效缓释消毒剂,反应的化学方程式为NH2Cl+H2ONH3+HClO; (2)①根据数据,甲、丙容器中NO的起始量相同, T ℃反应先达到平衡,则T ℃>400 ℃,达到平衡时,T ℃ NO的量小于400 ℃时NO的量,说明温度升高,平衡正向移动,该反应为吸热反应; ②根据2NO(g)+C(s)N2(g)+CO2(g)可知,该反应前后气体体积不变,相同温度下,甲与乙为等效平衡,故乙平衡时NO的物质的量为甲平衡时的一半,为0.3 mol,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)== 0.003 5 mol·L-1·min-1; (3)①A、B两点的温度相同,平衡常数只与温度有关; ②该反应是一个气体体积增大的反应,增大压强,平衡逆向移动,故A、B、C三点中NO2的转化率最低的是B点; ③设生成二氧化碳2x mol,由题意建立如下三段式: 2NO2(g)+2C(s)N2(g)+2CO2(g) 起始物质的量: 1 0 0 转化物质的量: 2x x 2x 平衡物质的量: 1-2x x 2x 15 高考总复习 C点时NO2和CO2浓度相等,则1-2x=2x,解得:x=0.25,因C点时NO2和CO2浓度相等,则NO2和CO2的分压也相等,即Kp(NO2)=Kp(CO2),20×=8 MPa, Kp(N2)=20×=4 MPa, Kp(C)= =Kp(N2)=4 MPa; 答案:(1)① +12 kJ·mol-1 ②NH2Cl+H2ONH3+HClO (2)①吸热 ②0.003 5 mol·L-1·min-1 (3) ①= ② B ③4 MPa 3.(2019·北京高考)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。 (1)甲烷水蒸气催化重整是制高纯氢的方法之一。 ①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是 。 ②已知反应器中还存在如下反应: ⅰ.CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1 ⅱ.CO(g)+H2O(g)CO2(g)+H2(g) ΔH2 ⅲ.CH4(g)C(s)+2H2(g) ΔH3 …… ⅲ为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用________反应的ΔH。 ③反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于初始反应的化学计量数之比,目的是____ (选填字母序号)。 a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成 ④用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如下图所示。 15 高考总复习 从t1时开始,H2体积分数显著降低,单位时间CaO消耗率________(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,结合化学方程式解释原因: 。 (2)可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。 ①制H2时,连接________。产生H2的电极反应式是 。 ②改变开关连接方式,可得O2。 ③结合①和②中电极3的电极反应式,说明电极3的作用: 。 【解析】(1)①由于生成物为H2和CO2,其物质的量之比为4∶1,反应物是甲烷和水蒸气,因而反应方程式为CH4+2H2O4H2+CO2。 ②ⅰ-ⅱ可得CH4(g)+CO2(g)2CO(g)+2H2(g),设为ⅳ,用ⅳ-ⅲ可得C(s)+ CO2(g)2CO(g),因此还需利用C(s)+CO2(g)2CO(g)反应的焓变[或计算可得CH4(g)+2H2O(g)CO2(g)+4H2(g),设为ⅳ,用ⅳ-ⅲ可得C(s)+2H2O(g)CO2(g)+2H2(g)]。 ③初始反应n(H2O)∶n(CH4)=4∶1,说明加入的水蒸气过量,又反应器中反应都存在一定可逆性,根据反应ⅰ知水蒸气浓度越大,甲烷的转化率越高,a正确;根据反应ⅱ知水蒸气浓度越大,CO的转化率越高,b正确;ⅰ和ⅱ产生氢气,使得氢气浓度变大,抑制反应ⅲ,积炭生成量减少,c正确。 ④t1时CaO消耗率曲线斜率减小,因而单位时间内CaO的消耗率降低。(2)①电极生成H2时,根据电极放电规律可知H+得到电子变为氢气,因而电极须连接负极,因而制取H2时,连接K1, 15 高考总复习 该电池在碱性溶液中,由H2O提供H+,电极反应式为2H2O+2e-H2↑+2OH-。③制H2时,电极3发生反应:Ni(OH)2+OH--e-NiOOH+H2O。制O2时,上述电极反应逆向进行,使电极3得以循环使用。 答案:(1)①CH4+2H2O4H2+CO2 ②C(s)+2H2O(g)CO2(g)+2H2(g)[或C(s)+CO2(g)2CO(g)] ③a、b、c ④降低 CaO+CO2CaCO3,CaCO3覆盖在CaO表面,减少了CO2与CaO的接触面积 (2)①K1 2H2O+2e-H2↑+2OH- ③制H2时,电极3发生反应:Ni(OH)2+OH--e-NiOOH+H2O。制O2时,上述电极反应逆向进行,使电极3得以循环使用 4.(2020·唐山模拟)某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知: 物质 BaSO4 BaSO3 AgI AgCl 溶解度/g (20 ℃) 2.4×10-4 1.4×10-3 3.0×10-7 1.5×10-4 (1)探究BaCO3和BaSO4之间的转化,实验操作: ①实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后, ________________。 ②实验Ⅱ中加入稀盐酸后发生反应的离子方程式是____________________。 ③实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因: 。 (2)探究AgCl和AgI之间的转化,实验Ⅲ: 15 高考总复习 实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。 装置 步骤 电压表 读数 Ⅰ.如图连接装置并加入试剂,闭合K a Ⅱ.向B中滴入AgNO3(aq),至沉淀完全 b Ⅲ.再向B中投入一定量NaCl(s) c Ⅳ.重复Ⅰ,再向B中加入与Ⅲ等量NaCl(s) a 注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。 ① 实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是________(填序号)。 a. AgNO3溶液 b. NaCl溶液 c. KI溶液 ② 实验Ⅳ的步骤Ⅰ中,B中石墨上的电极反应式是 。 ③ 结合信息,解释实验Ⅳ中b查看更多