- 2021-05-26 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习苏教版无机非金属元素及其化合物教案
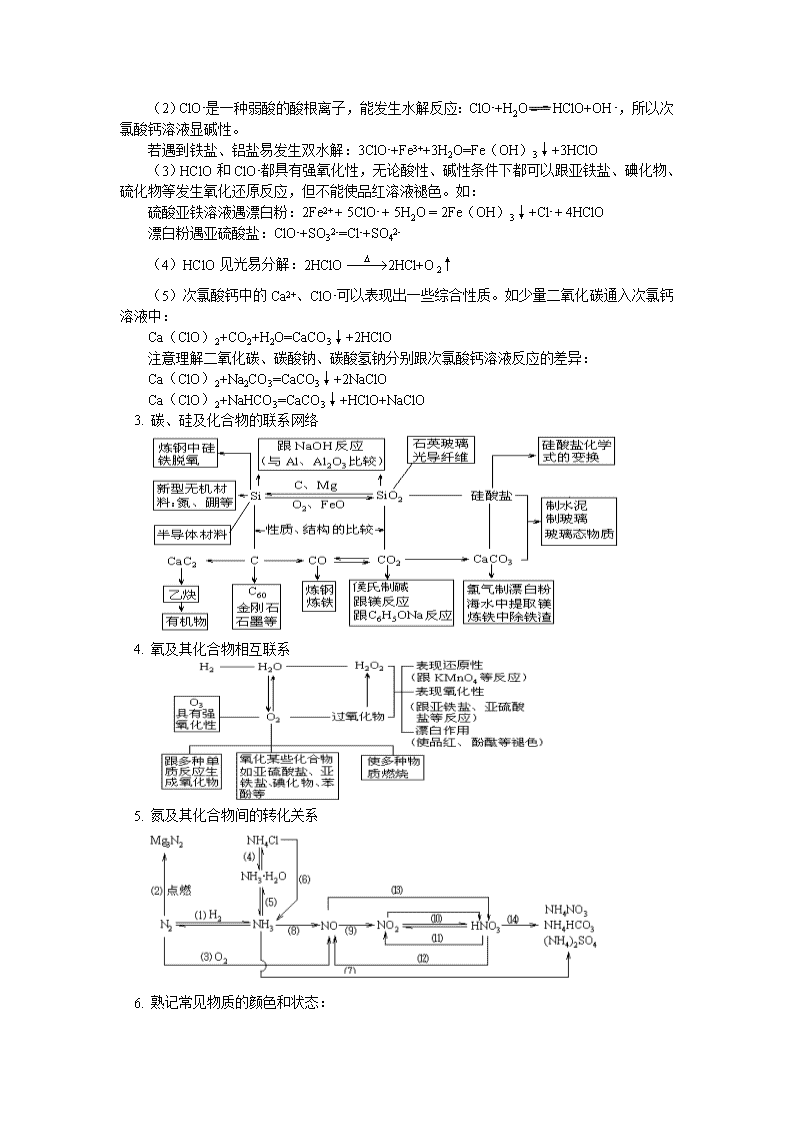
年 级 高三 学 科 化学 版 本 苏教版 内容标题 无机非金属元素及其化合物 【本讲教育信息】 一. 教学内容: 无机非金属元素及其化合物 二. 教学目标 掌握氯、氧、硫、氮、磷、碳、硅所在主族元素性质的相似性、递变规律和特殊性; 重点掌握几种常见典型物质的物理性质和化学性质; 掌握硫酸、硝酸的化学性质; 掌握氯气、二氧化硫、一氧化氮、二氧化氮、二氧化碳、氨气、氢气的实验室制法和气体的收集与尾气的吸收。 三. 教学重点、难点 常见非金属元素的性质及相互关系 四. 教学过程: 元素化合物是高中化学的主体,这部分内容与基本概念、基本理论相互渗透,与化学实验、化学计算联系紧密。复习元素化合物,要运用规律、把握关键、抓住重点、联系实际、编织元素化合物的科学体系。 元素化合物知识复习中要注意相似、相近内容的总结归纳。如SO2、CO2、SO3、P2O5、SiO2等都是酸性氧化物,它们的性质有相似之处也有相异点。高考命题时常会把这种关系编入试题中。近几年的高考试题中这种趋向比较明显,值得大家重视。 说明: 1. 氯元素的知识网络 2. 次氯酸、漂白粉的性质 HClO分子的结构式为H-O-Cl(氧处于中心),所以电子式为。次氯酸、次氯酸钙等有多方面的性质,经常用到以下几方面性质: (1)HClO是一种弱酸,与碳酸比较电离能力有如下关系:H2CO3>HClO>HCO3-,请分析下列反应: 少量二氧化碳通入NaClO溶液中:NaClO + CO2+H2O=NaHCO3+HClO 氯气通入碳酸氢钠溶液中: Cl2+NaHCO3=NaCl+CO2↑+HClO (2)ClO-是一种弱酸的酸根离子,能发生水解反应:ClO-+H2OHClO+OH-,所以次氯酸钙溶液显碱性。 若遇到铁盐、铝盐易发生双水解:3ClO-+Fe3++3H2O=Fe(OH)3↓+3HClO (3)HClO和ClO-都具有强氧化性,无论酸性、碱性条件下都可以跟亚铁盐、碘化物、硫化物等发生氧化还原反应,但不能使品红溶液褪色。如: 硫酸亚铁溶液遇漂白粉:2Fe2+ + 5ClO- + 5H2O = 2Fe(OH)3↓+Cl- + 4HClO 漂白粉遇亚硫酸盐:ClO-+SO32-=Cl-+SO42- (4)HClO见光易分解:2HClO2HCl+O2↑ (5)次氯酸钙中的Ca2+、ClO-可以表现出一些综合性质。如少量二氧化碳通入次氯钙溶液中: Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 注意理解二氧化碳、碳酸钠、碳酸氢钠分别跟次氯酸钙溶液反应的差异: Ca(ClO)2+Na2CO3=CaCO3↓+2NaClO Ca(ClO)2+NaHCO3=CaCO3↓+HClO+NaClO 3. 碳、硅及化合物的联系网络 4. 氧及其化合物相互联系 5. 氮及其化合物间的转化关系 6. 熟记常见物质的颜色和状态: 7. 常见物质的毒性。 (1)有毒的单质:氯气、溴、氟气、Hg、As等 (2)有毒的气体或蒸气:氯气、氟气、溴蒸气、一氧化碳、一氧化氮、二氧化氮、二氧化硫、三氧化硫(熔点:16.8℃)、甲醛、苯蒸气、硝基苯 (3)有毒的离子:重金属阳离子,如Cu2+、Ag+ 、Pb2+ 、Hg2+等。 8. 常温下,呈液态的物质有:H2O、Br2、Hg、乙醇、乙醛(沸点20.8℃)、乙酸(熔点16.6℃)、苯、四氯化碳、氯仿等。 9. 气体中极易溶于水的气体有:氟化氢、氨、氯化氢、碘化氢、二氧化硫、二氧化氮。 10. 常见物质的漂白性: (1)氧化漂白型:HClO、Ca(ClO)2、Na2O2、H2O2、HNO3、O3等,漂白过程不可逆。 (2)化合漂白型:SO2、H2SO3等,漂白过程可逆。 说明:a:漂白性是指化学变化。活性炭为疏松、多孔的物质,具有较大的表面积,可以吸附一些有色物质而使之褪色,是物理变化。 b:漂白一般是指使有机物褪色,即使使无机物褪色也不叫漂白,如二氧化硫使碘水褪色。 c:两种不同的漂白剂混合可能失去漂白作用,如二氧化硫和氯气按1:1的体积比混合,生成了盐酸和硫酸,不再具有漂白性。 11. 离子检验中的注意事项: (1)检验Ag+:加入Cl-,产生白色沉淀,沉淀不溶于稀硝酸(不能加盐酸或硫酸)。 (2)检验SO42-:加入Ba2+,产生白色沉淀,沉淀不溶于稀盐酸(不能加硝酸或硫酸)。最佳方法是先加盐酸,无气体或无沉淀产生,再加Ba2+,有白色沉淀产生。既要防止SO32-的干扰,又要防止Ag+的干扰。 (3)加入不同的酸可能产生的气体有:氢气、二氧化碳、二氧化硫、硫化氢、一氧化氮、二氧化氮等。 (4)加入强碱产生的气体有:氨气、氢气(铝或硅与氢氧化钠反应)。 12. 掌握硝酸、硫酸、盐酸与不同金属的反应规律。 13. 掌握常见的几个连续氧化规律(反应条件略): (1)NH3→ NO →NO2 (2)H2S →S→SO2→SO3 (3)Na→Na2O→Na2O2 (4)C→CO→CO2 14. 推断题中千万不能忽视的几种物质(因为它们不满足同主族的最高正价或最低负价):FeS2、Na2O2、H2O2、CaC2、Fe3O4、N2O等。 【典型例题】 例1. 氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是 A. HI和HClO B. HCl和HIO C. HClO3和HIO D. HClO和HIO 解析:氯气与水反应的方程式为Cl2+H2O =HCl+HClO 反应可看做Cl-Cl+H-OH互相交换形成HCl+HClO。氯化碘与水反应可认为是ICl+H-OH →HCl+IHO,将IHO改成HIO。选项B符合题意。Cl2与水反应是氧化还原反应,而ICl与水反应不是氧化还原反应。 答案:B 例2. 可以验证硫元素的非金属性比氯元素弱的事实是 ①硫和氢气在加热条件下能形成H2S、H2S受热300℃左右分解。氯气和氢气在点燃或光照下生成氯化氢,氯化氢很难分解。 ②向氢硫酸溶液中滴入氯水有单质硫生成 ③硫、氯气分别与铜和铁反应的产物是 FeS、Cu2S、FeCl3、CuCl2 ④高氯酸(HClO4)的酸性强于硫酸 A. ①②③④ B. 有①② C. 只有②③④ D. 只有③④ 解析:元素非金属性强弱的比较有很多方法。常用的方法有: ①形成气态氢化物难易程度,易形成气态氢化物者,非金属性强。通常气态氢化物稳定的非金属性强。 ②相同条件下,最高价氧化物的水化物酸性强的非金属性强。 ③非金属单质甲可以在溶液中置换出非金属单质乙,则甲的非金属性强于乙。 ④同种变价金属与不同非金属反应时,生成高价金属化合物时,该非金属性强于生成低价金属化合物对应的非金属,如题中③。综上所述选项A符合题意。 在理论上还有:①易得到电子的非金属单质,其非金属性强。②同周期元素在右侧(稀有气体除外),同主族元素在上方非金属性强。 答案:A 例3. A、B、C是在中学化学中常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质.这些化合物和单质之间存在如下的关系: 据此判断: (1)在A、B、C这三种化合物中,必定含有乙元素的是 。(用A、B、C字母填写) (2)单质乙必定是 (填“金属”或“非金属”),其理由是 。 (3)单质乙的分子式可能是 ,则化合物B的分子式是 。 解析:(1) 根据题意,可转化为如下三个反应① 甲+乙→A,② 甲+B→ A+C, ③A+B→乙+C,由①可知化合物A中一定含有乙元素,由②A中含乙元素,一定来源于化合物B,所以A、B均含有乙元素。 (2)由③ 看出,该反应一定是氧化还原反应,乙为单质,A、B中又都含有乙元素,所以乙元素在A、B中必有一个显正价,另一个显负价。在中学化学中只有非金属元素显负价,因而乙一定是非金属元素。 (3)单质乙可能是S,B的化学式为H2S,A的化学式为SO2,因此可写出下列(左)反应关系,也可认为乙是N2,可以写出如下(右)反应关系 答案:(1)A、B均含有乙元素;(2) 乙一定是非金属元素,乙元素在A、B中必有一个显正价,另一个显负价,而在中学化学中只有非金属元素显负价。 (3)单质乙可能是S,B的化学式H2S,A的化学式为SO2;也可以是N2、NH3和NO 例4. A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应。 ⑴若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是____________________________________。 ⑵若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是_________________________;已知1 g D与F反应生成B时放出92.3 kJ热量,写出该反应的热化学方程式________________________________。 ⑶若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成, 则C的电子式是________________,反应③的化学方程式是_________________________________________。 ⑷若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,则反应④的化学方程式是_________________________________________。 解析: ⑴题给信息是A、D、F都是非金属单质,且A、D所含元素同主族,反应①是置换反应,所以,先考虑A、D要么是氯、溴,要么是碳、硅,而F又是非金属,对照框图分析,确定应是碳、硅。 ⑵由于A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,A+F反应生成E,C+F也生成E,说明A金属有可变价态,A是Fe,B是HCl,C是FeCl2,D是H2, E是FeCl3,F是Cl2。 ⑶关键是抓住B、C、F都是气态单质,且B有毒,反应②需要放电才能发生, A、D相遇有白烟生成,不难看出A是NH3,B是Cl2,C是N2,,D是HCl,E是NO,F是O2。 ⑷若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,自然会使人想起元素Mg和C符合,再根据“③和④两个反应中都有红棕色气体生成”这一信息,可以确定有HNO3参加反应,最后确定A是Mg,B是CO2,C是MgO,D是C,E是Mg(NO3), F是HNO3。 答案 :⑴SiO2+2CSi+2CO↑ ⑵2Fe2++Cl2=2Fe3++2Cl- H2(g)+Cl2(g)=2HCl(g);ΔH=-184.6 kJ·mol-1 ⑶∶NN∶ 4NH3+5O24NO+6H2O ⑷C+4HNO3 CO2↑+4NO2↑+2H2O 例5. 为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。 请回答下列问题: (1)实验前欲检查装置A的气密性,可以采取的操作是 ; (2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是 (用操作编号填写) ①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊B中充入一定量气体时,停止加热; ②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b; ③打开止水夹a和c,关闭止水夹b; (3)实验时,装置C中的现象为 ; (4)当D中产生 (多选不得分)现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2; A. 进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变 B. 脱脂棉上蓝色均变浅 C. 脱脂棉上蓝色褪去 装置D的作用为 。 解析:实验装置中接了一个储气的气囊,这是课本实验中没有见到过的。但试题主要还是考查卤族和氧族元素化合物的基础知识、实验基本操作等。 答案:(1)关闭分液漏斗的活塞,打开止水夹a和b,关闭止水夹c,用手捂热(或微热)圆底烧瓶A,若C中有气泡冒出,移开手掌(或热源)后,C处导管内有水上升,则证明A装置的气密性良好。 (2)③①② (3)品红溶液褪色。 (4)A;除去SO2并检验SO2已被除净。 例6. 设X、Y、Z、A、B分别代表五种短周期元素,已知:①Ym-和Zn-两种离子具有相同的电子层结构;②Y和X可以形成原子个数比为1:1的化合物甲和原子个数比为1:2的化合物乙,甲和乙都是共价化合物;③Z和X可以形成原子个数比为1:1的化合物丙,其分子与乙的分子所含质子数相同;④Y和A是同周期相邻的两种元素,Y和B是同主族相邻的两种元素;⑤Y、A、B三种元素的原子序数之和为31。据此,请回答: (1)Y的元素符号是 ;A的元素符号是 ; B的元素符号是 。 (2)化合物甲的结构式是 。 (3)Z单质与化合物乙反应的化学方程式是 。 (4)化合物丙与NaOH溶液反应的离子方程式是 。 (5)X、A、Y可组成原子个数比为4:2:3的化合物,其水溶液呈酸性,原因是(用离子方程式表示) 。 (6)若把甲看成二元弱酸,请写出常温下甲与乙组成的混合物中存在的带负电荷的微粒 。 (7)化合物甲与酸性高锰酸钾溶液反应的现象有 ① ;② 。 解析:本题考查的是元素周期表与元素及其化合物的知识。根据①Ym-和Zn-两种离子具有相同的电子层结构;②Y和X可以形成原子个数比为1:1的化合物甲和原子个数比为1:2的化合物乙,甲和乙都是共价化合物;③Z和X可以形成原子个数比为1:1的化合物丙,其分子与乙的分子所含质子数相同;④Y和A是同周期相邻的两种元素,Y和B是同主族相邻的两种元素;⑤Y、A、B三种元素的原子序数之和为31。可知:A为N、B为S、X为H、Y为O、Z为F。则化合物甲为H2O2,结构式为:H-O-O-H,Z单质与化合物乙反应的化学方程式为:2F2 + 2H2O = 4HF + O2;化合物丙为HF,与NaOH溶液反应的离子方程式:HF + OH-= F- + H2O,X、A、Y可组成原子个数比为4:2:3的化合物为:NH4NO3,其水溶液显酸性的原因:NH4+ + H2ONH3·H2O + H+,H2O2属于二元弱酸,其电离方程式为:H2O2H++HO2-、HO2-H++O22-,再加上由水电离产生的OH-,则溶液中带负电荷的离子有:HO2-、O22-、OH-,H2O2与酸性高锰酸钾溶液反应的方程式为:2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+8H2O+5O2↑,现象为:①有无色气体产生 ②溶液紫色褪去 答案:(1)O N S (2)H-O-O-H (3)2F2 + 2H2O = 4HF + O2 (4)HF + OH-= F- + H2O (5)NH4+ + H2ONH3·H2O + H+ (6)HO2-、O22-、OH- (7)①有无色气体产生 ②溶液紫色褪去 查看更多