- 2021-05-26 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习化学反应速率及影响因素作业(1)
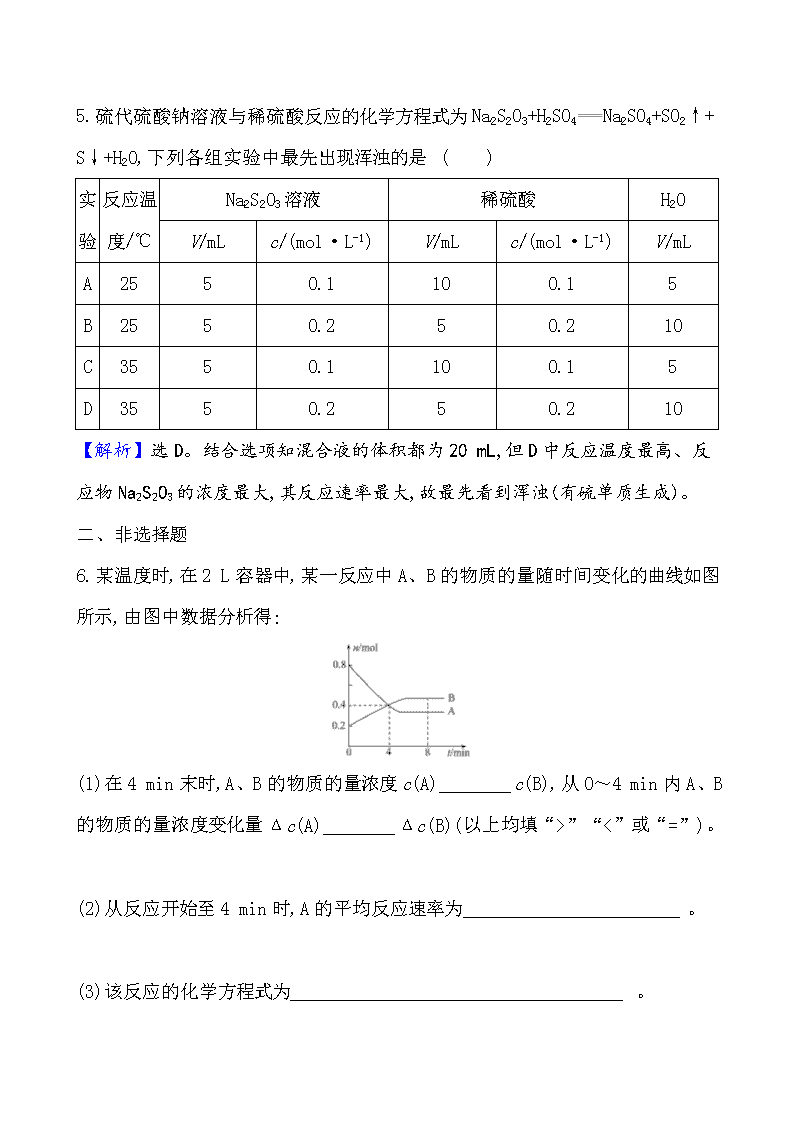
课时分层提升练 二十一 化学反应速率及影响因素 一、选择题 1.(2019·海口模拟)某温度下,体积一定的密闭容器中进行如下反应:2X(g)+ (g)Z(g)+W(s) ΔH>0,下列叙述正确的是 ( ) A.在容器中加入氩气,反应速率不变 B.加入少量W,逆反应速率增大 C.升高温度,正反应速率增大,逆反应速率减小 D.将容器的体积压缩,可增大活化分子的百分数,有效碰撞次数增大 【解析】选A。在容器中加入氩气,压强增大,但物质的浓度不变,所以反应速率不变,A正确;W是固体,所以加入少量W,正、逆反应速率均不变,B不正确;升高温度,正、逆反应速率均增大,C不正确;将容器的体积压缩,可增大单位体积内活化分子数,有效碰撞次数增大,反应速率加快,但活化分子的百分数不变,D不正确。 2.(2019·浏阳模拟)在2升的密闭容器中,发生以下反应: 2A(g)+B(g)2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是( ) A.1.6 mol B.2.8 mol C.2.4 mol D.1.2 mol 【解析】选B。根据速率之比等于化学计量数之比,所以v(B)=0.5v(A)=0.5× 0.12 mol·L-1·s-1=0.06 mol·L-1·s-1,所以Δc(B)=0.06 mol·L-1·s-1×10 s= 0.6 mol·L-1,所以Δn(B)=0.6 mol·L-1×2 L=1.2 mol,故10秒钟时容器中B的物质的量为4 mol-1.2 mol=2.8 mol。 3.在下列四种反应条件下,锌和盐酸反应速率最快的是 ( ) A.20 ℃时,将锌片放入0.01 mol·L-1的稀盐酸中 B.20 ℃时,将锌片放入0.1 mol·L-1的稀盐酸中 C.50 ℃时,将锌片放入0.01 mol·L-1的稀盐酸中 D.50 ℃时,将锌片放入0.1 mol·L-1的稀盐酸中 【解析】选D。对于锌与盐酸反应,温度越高,H+浓度越大,反应速率越快。 4.可逆反应:2A(g)+B(g)3C(g) ΔH>0,在一定条件下达到平衡状态。在t1时刻改变反应条件,化学反应速率与时间关系如图,下列符合曲线变化的条件是 ( ) A.恒温恒容下,t1时刻同时充入A(g)和B(g) B.恒容条件下,t1时刻升高温度 C.恒温条件下,t1时刻缩小容器体积 D.维持温度和压强不变,t1时刻加入催化剂 【解析】选B。同时充入A(g)和B(g)的瞬间,v(正)增大,而v(逆)不变,A项错误;该反应是吸热反应,升高温度正、逆速率均增大,且v(正)>v(逆),B项正确;缩小容器体积,相当于增大压强,由于反应前后气体物质的量不变,正、逆速率均增大且增大倍数相同,即v(正)=v(逆),C项错误;加入催化剂正、逆速率仍相等,D项错误。 5.硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4Na2SO4+SO2↑+ S↓+H2O,下列各组实验中最先出现浑浊的是 ( ) 实 验 反应温 度/℃ Na2S2O3溶液 稀硫酸 H2O V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL A 25 5 0.1 10 0.1 5 B 25 5 0.2 5 0.2 10 C 35 5 0.1 10 0.1 5 D 35 5 0.2 5 0.2 10 【解析】选D。结合选项知混合液的体积都为20 mL,但D中反应温度最高、反应物Na2S2O3的浓度最大,其反应速率最大,故最先看到浑浊(有硫单质生成)。 二、非选择题 6.某温度时,在2 L容器中,某一反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得: (1)在4 min末时,A、B的物质的量浓度c(A)________c(B),从0~4 min内A、B的物质的量浓度变化量Δc(A)________Δc(B)(以上均填“>”“<”或“=”)。 (2)从反应开始至4 min时,A的平均反应速率为 ______________________。 (3)该反应的化学方程式为_____________________________________。 【解析】(1)由图可以看出,在4 min末n(A)=n(B)=0.4 mol,又因体积相等,所以c(A)=c(B),从0到4 min内Δc(A)=0.2 mol·L-1,Δc(B)=0.1 mol·L-1。 (2)v(A)=0.05 mol·L-1·min-1。 (3)参加反应的各物质的物质的量之比为n(A)∶n(B)=0.4 mol ∶0.2 mol =2∶1,4 min后的一段时间A、B的物质的量不再改变,证明该反应达到化学平衡,此反应为可逆反应。 答案:(1)= > (2)0.05 mol·L-1·min-1 (3)2AB 7.用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答: (1)实验过程如下图所示,分析判断:________段化学反应速率最快,其原因可能____________________________________________。 (2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是 ( ) A.蒸馏水 B.氯化钠固体 C.氯化钠溶液 D.浓盐酸 【解析】(1)曲线斜率大小决定反应速率大小,斜率越大,反应速率越快,所以EF段反应速率最快;EF段速率突然加快,碳酸钙由块状变成粉末,温度升高。 (2)碳酸钙与稀盐酸反应的实质:CaCO3+2H+Ca2++H2O+CO2↑,影响反应速率的因素有:碳酸钙的表面积、H+ 的浓度及反应体系的温度等。加入蒸馏水,盐酸浓度减小,反应速率减慢,A项正确;加入氯化钠固体,反应物浓度基本不变,反应速率不变,B项错误;加入NaCl溶液,氢离子浓度减小,反应速率减慢,C项正确;加入浓盐酸,氢离子浓度增大,反应速率加快,D项错。 答案:(1)EF 碳酸钙由块状变成粉末,温度升高 (2)A、C 8.向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题: (1)用A的浓度变化表示的该反应0~10 min内的平均反应速率v(A)=________。 (2)根据图示可确定x∶y=________。 (3)0~10 min容器内压强________(填“增大”“不变”或“减小”)。 (4)推测第10 min引起曲线变化的反应条件可能是 __________(填序号,下同);第16 min引起曲线变化的反应条件可能是________。 ①减小压强 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂 【解析】(1)v(A)==0.02 moL·L-1·min-1。 (2)根据图象及反应的物质的量之比等于化学计量数之比得x∶y=1∶2。 (3)根据(2)可知,正反应气体体积增大,故容器内压强变大。 (4)10 min后化学反应速率加快直到达化学平衡状态,反应条件可能为升温或加催化剂,故选④⑥。16 min后化学平衡逆向移动,结合正反应是放热反应,故反应条件可能是升温,故选④。 答案:(1)0.02 moL·L-1·min-1 (2)1∶2 (3)增大 (4)④⑥ ④ 一、选择题 1.(2019·天水模拟)在密闭容器中,合成氨的反应N2+3H22NH3,开始时N2浓度为8 mol·L-1,5 min后N2浓度为6 mol·L-1,则用N2浓度变化表示的反应速率为 ( ) A.0.4 moL·L-1·min-1 B.0.2 moL·L-1·min-1 C.0.8 moL·L-1·min-1 D.1.2 moL·L-1·min-1 【解析】选A。开始时N2浓度为8 mol·L-1,5 min后N2浓度为6 mol·L-1,则用N2浓度变化表示的反应速率为=0.4 moL·L-1·min-1。 【加固训练】 实验是研究化学的基础,下列图中所示的实验方法、装置和操作均正确的是 ( ) A.图①可以用来制取Fe(OH)2沉淀 B.图②可以用来测定化学反应速率 C.图③可以用来收集一瓶纯净的SO2 D.图④可以用来分离水和乙醇的混合溶液 【解析】选A。由于空气中的氧气,能迅速将Fe(OH)2氧化,①中液面加苯阻止了空气进入,因而能较长时间看到白色沉淀,故A正确;应用分液漏斗,否则会导致气体逸出,故B错误;碱石灰也可以吸收SO2,故C错误;乙醇和水互溶,不能用分液法分离,故D错误。 2.100 mL 6 mol·L-1 H2SO4与过量锌粉反应,一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的 ( ) A.Na2SO4(s) B.NaOH(s) C.K2SO4(aq) D.(NH4)2SO4(s) 【解析】选C。加适量的Na2SO4(s),对反应速率无影响,A错误;加适量的NaOH(s)与酸反应,生成氢气的量减少,B错误;加适量的K2SO4溶液,相当于稀释,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,C正确;加适量的(NH4)2SO4(s),Zn与铵根离子水解生成的氢离子反应生成氢气,反应速率加快,氢气的量增大,D错误。 3.(2019·临沂模拟)在Ag+催化作用下,Cr3+被S2氧化为Cr2的机理为 S2+2Ag+2S+2Ag2+ 慢 2Cr3++6Ag2++7H2O6Ag++14H++Cr2快 下列有关说法正确的是 ( ) A.反应速率与Ag+浓度有关 B.Ag2+也是该反应的催化剂 C.Ag+能降低该反应的活化能和焓变 D.v(Cr3+)=v(S2) 【解析】选A。A项,反应速率由第一步(慢)决定,因此反应速率与Ag+浓度有关,正确;B项,Ag2+是中间产物,不是催化剂,错误;C项,Ag+是该反应的催化剂,能够降低该反应的活化能,但不改变反应热,错误;D项,由第一个反应×3+第二个反应,可得该反应的总反应式为2Cr3++3S2+7H2OCr2+6S+14H+,v(Cr3+) =v(S2),错误。 4.在一定温度下,10 mL 0.40 mol·L-1 H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。 t/min 0 2 4 6 8 10 v(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9 下列叙述不正确的是(溶液体积变化忽略不计) ( ) A.0~6 min的平均反应速率: v(H2O2)=3.3×10-2 mol·L-1·min-1 B.6~10 min的平均反应速率: v(H2O2)<3.3×10-2 mol·L-1·min-1 C.反应到6 min时,c(H2O2)=0.30 mol·L-1 D.反应到6 min时,H2O2分解了50% 【解析】选C。2H2O22H2O+O2↑。0~6 min产生的氧气的物质的量n(O2)= =0.001 mol,n(H2O2)=2n(O2)=0.002 mol,v(H2O2)=≈3.3 ×10-2 mol·L-1·min-1,A正确;0~6 min内每分钟平均生成氧气= 3.73 mL,6~10 min内每分钟平均生成氧气=1.88 mL,3.73 mL >1.88 mL,故单位时间内产生的氧气,0~6 min大于6~10 min,故6~10 min的平均反应速率:v(H2O2)<3.3×10-2 moL·L-1·min-1,B正确;6 min时,c(H2O2)= 0.40 mol·L-1-=0.20 mol·L-1,C错误;6 min时,H2O2分解的分解率为:×100%=50%,D正确。 5.对于反应H++CN-HCN,常温下按以下情况进行反应: ①20 mL溶液中含H+、CN-各0.01 mol ②50 mL溶液中含H+、CN-各0.05 mol ③0.1 mol·L-1的H+、CN-溶液各10 mL ④0.5 mol·L-1的H+、CN-溶液各50 mL 四者反应速率的大小关系是 ( ) A.②>①>④>③ B.④>③>②>① C.①>②>④>③ D.①>②>③>④ 【解析】选A。①中c(H+)=c(CN-)==0.5 mol·L-1; ②中c(H+)=c(CN-)==1 mol·L-1; ③中c(H+)=c(CN-)==0.05 mol·L-1; ④中c(H+)=c(CN-)==0.25 mol·L-1; 在其他条件一定的情况下,浓度越大,反应速率越大,所以反应速率由大到小的顺序为:②>①>④>③。 【加固训练】 下列关于化学反应速率的说法正确的是 ( ) ①恒温时,增大压强,化学反应速率一定加快 ②其他条件不变,温度越高,化学反应速率越快 ③ 使用催化剂可改变反应速率,从而改变该反应过程中吸收或放出的热量 ④ 3 mol·L-1·s-1的反应速率一定比1 mol·L-1·s-1的反应速率大 ⑤升高温度能使化学反应速率增大,主要原因是增大了反应物分子中活化分子的百分数 ⑥有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 ⑦增大反应物浓度,可增大活化分子的百分数,从而使单位时间内有效碰撞次数增多 ⑧催化剂不参与反应,但能降低活化能增大活化分子的百分数,从而增大反应速率 A.②⑤⑧ B.②⑥⑧ C.②③⑤⑦⑧ D.①②④⑤⑧ 【解析】选A。①恒温时,增大压强,如没有气体参加反应,化学反应速率不加快,故错误;②其他条件不变,温度越高,活化分子百分数越大,化学反应速率越快,故正确;③使用催化剂不能改变反应热,故错误;④速率未指明是哪种物质的,则3 mol·L-1·s-1的反应速率不一定比1 mol·L-1·s-1的反应速率大,故错误;⑤升高温度能增大反应物分子中活化分子的百分数,使化学反应速率增大,故正确; ⑥有气体参加的化学反应,增大压强(即缩小反应容器的体积),活化分子百分数不变,故错误;⑦增大反应物浓度,活化分子的百分数不变,故错误;⑧催化剂不参与反应,但能降低活化能增大活化分子的百分数,从而增大反应速率,故正确。 二、非选择题 6.(2019·邯郸模拟)草酸与高锰酸钾在酸性条件下能够发生如下反应: Mn+H2C2O4+H+——Mn2++CO2↑+H2O(未配平) Ⅰ.甲同学研究外界因素对反应速率影响,设计如下实验方案: 用4 mL 0.001 mol·L-1 KMnO4溶液与2 mL 0.01 mol·L-1 H2C2O4溶液反应,研究不同条件对化学反应速率的影响。改变的条件如下: 组别 10%硫酸体积/mL 温度/℃ 其他物质 A 2 mL 20 B 2 mL 20 10滴饱和 MnSO4溶液 C 2 mL 30 D 1 mL 20 V1 mL蒸馏水 E 0.5 mL 20 V2 mL蒸馏水 (1)完成上述实验方案设计,其中:V1=____________,V2=________; (2)如果研究温度对化学反应速率的影响,使用实验________和________; (3)甲同学在做A组实验时,发现反应开始时速率较慢,随后加快。他分析认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快;从影响化学反应速率的因素看,你猜想还可能是_____________________________; Ⅱ.乙同学利用如图装置测定反应速率 回答下列问题 (4)实验时要检查装置的气密性,简述操作的方法是 ____________________; (5)乙同学通过生成相同体积的CO2来表示反应的速率,需要________来记录数据。 【解析】(1)研究硫酸浓度对反应速率的影响,需要草酸浓度相同,故混合后溶液体积相同,所以V1=1 mL,V2=1.5 mL;(2)研究温度变化需要改变温度探究反应速率变化,需要其他条件相同,选择实验A和C;(3)KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用,所以猜想还可能是催化剂的作用;(4)根据气压原理检验气密性,首先关闭分液漏斗的活塞,形成密闭体系,把注射器的柄向外拉一段距离,观察柄是否能恢复到原来的位置,若能恢复,则气密性良好;故答案为:关闭分液漏斗的活塞,把注射器的柄向外拉一段距离后松开,观察柄是否能恢复到原来的位置,若能恢复,则气密性良好,若不能恢复,则气密性不好;(5)产生相同体积的二氧化碳,应看反应的快慢,即需要记录时间,故需要秒表。 答案:(1)1 mL 1.5 mL (2)A C (3)Mn2+起催化作用 (4)关闭分液漏斗的活塞,把注射器的柄向外拉一段距离后松开,观察柄是否能恢复到原来的位置,若能恢复,则气密性良好,若不能恢复,则气密性不好 (5)秒表 7.在一密闭容器中发生反应N2+3H22NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。 回答下列问题: (1)处于平衡状态的时间段是________(填选项,下同)。 A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6 (2)t1、t3、t4时刻分别改变的一个条件是什么? A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氮气 t1时刻________;t3时刻________;t4时刻________。 【解析】(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态。 (2)t1时,v正、v逆同时增大,且v逆增大得更快,平衡向逆反应方向移动,所以t1时改变的条件是升温。t3时,v正、v逆同时增大且增大量相同,平衡不移动,所以t3时改变的条件是加催化剂。t4时,v正、v逆同时减小,但平衡向逆反应方向移动,所以t4时改变的条件是减小压强。 答案:(1)ACDF (2)C E B 关闭Word文档返回原板块查看更多