- 2021-05-25 发布 |
- 37.5 KB |
- 9页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学一轮复习化学实验常见物质的制备习题
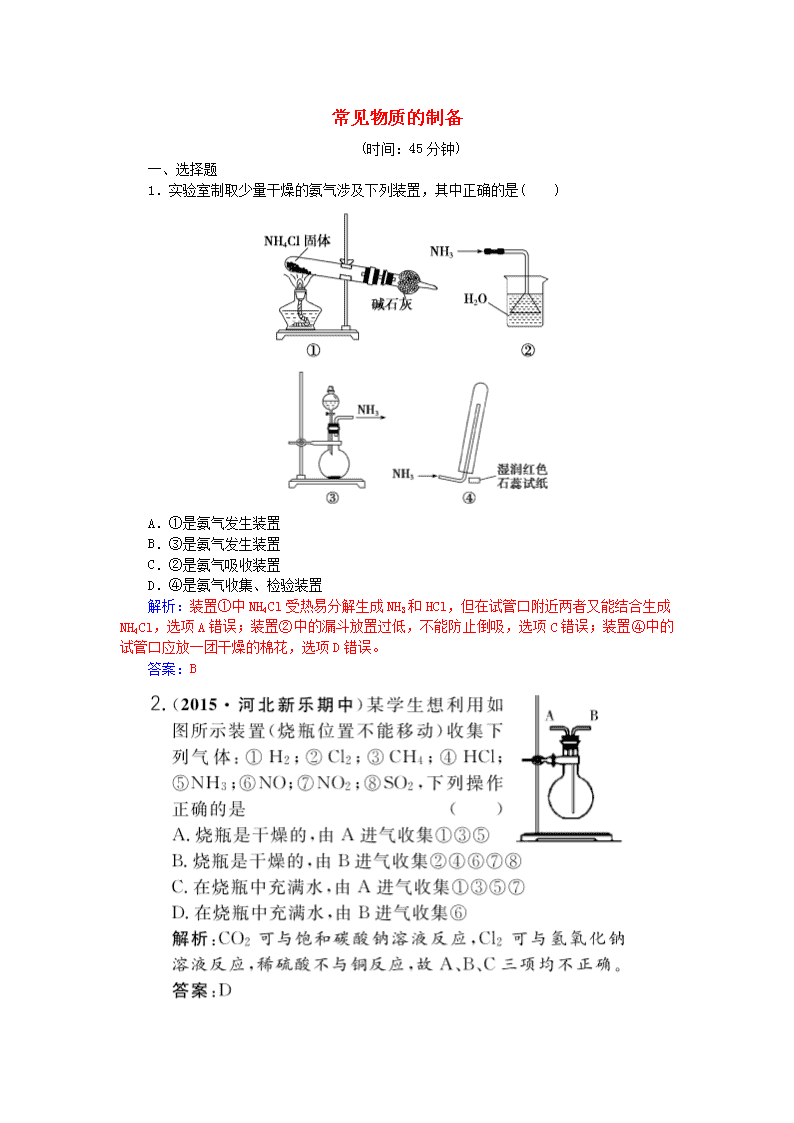
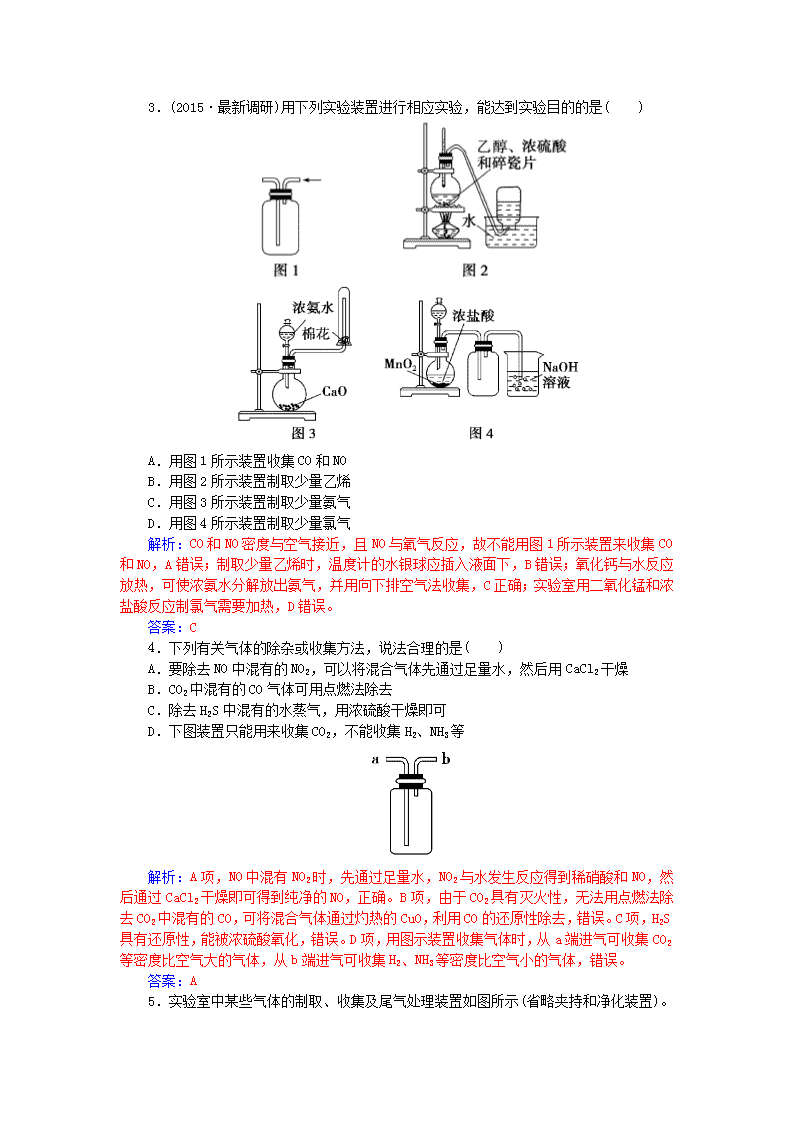
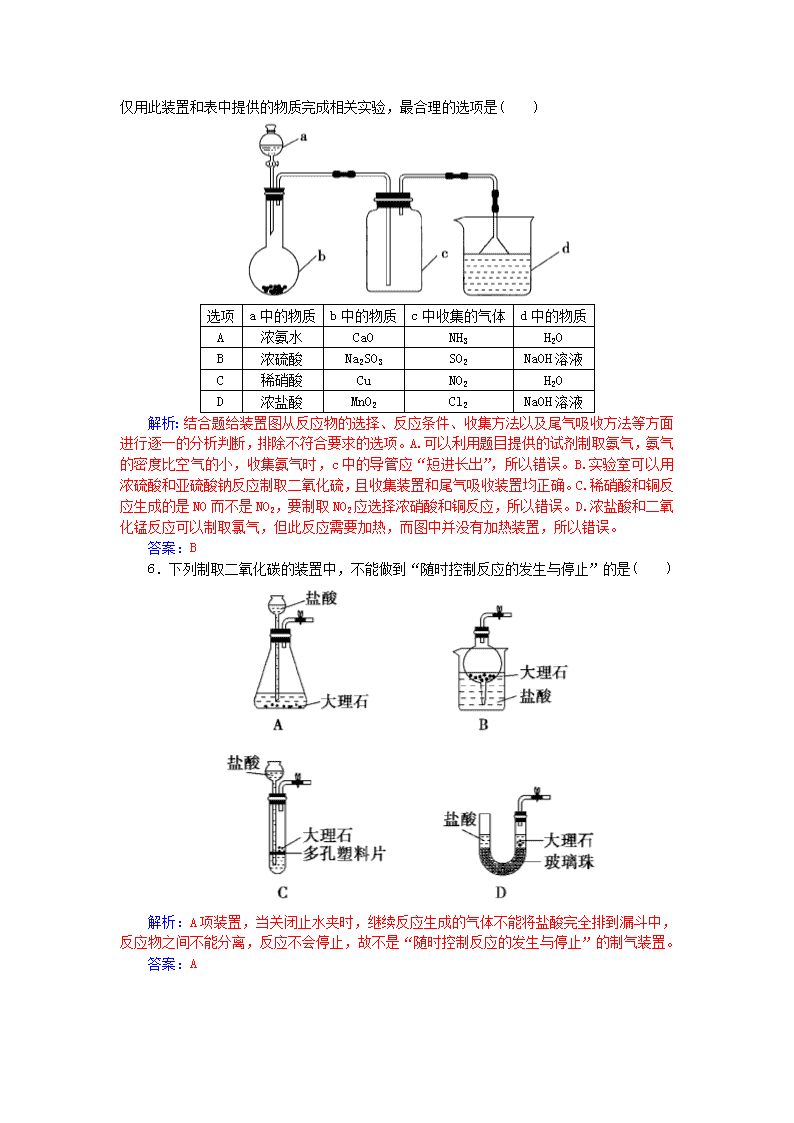
常见物质的制备 (时间:45分钟) 一、选择题 1.实验室制取少量干燥的氨气涉及下列装置,其中正确的是( ) A.①是氨气发生装置 B.③是氨气发生装置 C.②是氨气吸收装置 D.④是氨气收集、检验装置 解析:装置①中NH4Cl受热易分解生成NH3和HCl,但在试管口附近两者又能结合生成NH4Cl,选项A错误;装置②中的漏斗放置过低,不能防止倒吸,选项C错误;装置④中的试管口应放一团干燥的棉花,选项D错误。 答案:B 3.(2015·最新调研)用下列实验装置进行相应实验,能达到实验目的的是( ) A.用图1所示装置收集CO和NO B.用图2所示装置制取少量乙烯 C.用图3所示装置制取少量氨气 D.用图4所示装置制取少量氯气 解析:CO和NO密度与空气接近,且NO与氧气反应,故不能用图1所示装置来收集CO和NO,A错误;制取少量乙烯时,温度计的水银球应插入液面下,B错误;氧化钙与水反应放热,可使浓氨水分解放出氨气,并用向下排空气法收集,C正确;实验室用二氧化锰和浓盐酸反应制氯气需要加热,D错误。 答案:C 4.下列有关气体的除杂或收集方法,说法合理的是( ) A.要除去NO中混有的NO2,可以将混合气体先通过足量水,然后用CaCl2干燥 B.CO2中混有的CO气体可用点燃法除去 C.除去H2S中混有的水蒸气,用浓硫酸干燥即可 D.下图装置只能用来收集CO2,不能收集H2、NH3等 解析:A项,NO中混有NO2时,先通过足量水,NO2与水发生反应得到稀硝酸和NO,然后通过CaCl2干燥即可得到纯净的NO,正确。B项,由于CO2具有灭火性,无法用点燃法除去CO2中混有的CO,可将混合气体通过灼热的CuO,利用CO的还原性除去,错误。C项,H2S具有还原性,能被浓硫酸氧化,错误。D项,用图示装置收集气体时,从a端进气可收集CO2等密度比空气大的气体,从b端进气可收集H2、NH3等密度比空气小的气体,错误。 答案:A 5. 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( ) 选项 a中的物质 b中的物质 c中收集的气体 d中的物质 A 浓氨水 CaO NH3 H2O B 浓硫酸 Na2SO3 SO2 NaOH溶液 C 稀硝酸 Cu NO2 H2O D 浓盐酸 MnO2 Cl2 NaOH溶液 解析:结合题给装置图从反应物的选择、反应条件、收集方法以及尾气吸收方法等方面进行逐一的分析判断,排除不符合要求的选项。A.可以利用题目提供的试剂制取氨气,氨气的密度比空气的小,收集氨气时,c中的导管应“短进长出”,所以错误。B.实验室可以用浓硫酸和亚硫酸钠反应制取二氧化硫,且收集装置和尾气吸收装置均正确。C.稀硝酸和铜反应生成的是NO而不是NO2,要制取NO2应选择浓硝酸和铜反应,所以错误。D.浓盐酸和二氧化锰反应可以制取氯气,但此反应需要加热,而图中并没有加热装置,所以错误。 答案:B 6.下列制取二氧化碳的装置中,不能做到“随时控制反应的发生与停止”的是( ) 解析:A项装置,当关闭止水夹时,继续反应生成的气体不能将盐酸完全排到漏斗中,反应物之间不能分离,反应不会停止,故不是“随时控制反应的发生与停止”的制气装置。 答案:A 二、非选择题 8.实验室可由多条途径制备SO2。 (1)Na2SO3固体与较浓硫酸(加热)反应可以制得SO2,需用下列哪个装置________(填编号)。 (2)铜与浓硫酸反应可以制得SO2,其反应方程式为(能写离子反应方程式的只写离子反应方程式,不能的话只写化学方程式)_______________________________________________________。 (3)如果要在实验室制取SO2,选用上述两种方法中的哪种更合理,你的理由是___________________(答出一点即可)。 (4)工业上硫酸工厂的废气含有的SO2不仅污染大气,还会浪费资源,请用化学方程式表示用氨水回收SO2的原理:____________、 ________________。 解析:(1)该反应属于固体与液体加热制备气体,选装置丁。 (2)浓硫酸中物质的主要存在形式是分子,只能写化学方程式,注意硫酸要注明“浓”,有加热符号。 (3)可从节省原料、操作简单等方面考虑。 (4)二氧化硫是酸性氧化物,可以与氨水反应生成盐,亚硫酸铵属于弱酸盐,可与硫酸反应回收二氧化硫。 答案:(1)丁 (2)Cu+2H2SO4(浓)Cu2++SO+SO2↑+2H2O (3)方法(1)更合理;制备等量的二氧化硫消耗的硫酸少(合理即可) (4)2NH3·H2O+SO2===(NH4)2SO3+H2O (NH4)2SO3+H2SO4===(NH4)2SO4+SO2↑+H2O 9.(2015·海南卷)工业上,向500~600 ℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行试验。 回答下列问题: (1)制取无水氯化铁的实验中,A中反应的化学方程式为______________________,装置B中加入的试剂是________。 (2)制取无水氯化亚铁的实验中,装置A用来制取________。 尾气的成分是____________。若仍用D的装置进行尾气处理,存在的问题是_____________。 (3)若操作不当,制得的FeCl2会含有少量FeCl3,检验FeCl3常用的试剂是____________。欲制得纯净的FeCl2,在实验操作中应先__________________,再____________。 解析:(1)制取无水氯化铁的实验中,A装置为氯气的制备装置,发生的反应为MnO2+4HCl(浓)MnCl2+Cl2+2H2O,装置B的作用是除去氯气中的水蒸气,B中装的是浓硫酸。 (2)根据题目信息制取无水氯化亚铁的实验中,装置A用来制取HCl,尾气是HCl和H2;若用D装置进行尾气处理,氯化氢气体极易溶于水,氢气与氢氧化钠溶液不反应。则可能发生倒吸,而氢气不能被吸收。 (3)检验FeCl3常用的试剂是KSCN溶液;欲制得纯净的FeCl2,应当防止装置中的氧气干扰,在实验操作中应先点燃A处的酒精灯,利用产生的氯化氢气体排出装置中的空气,在点燃处的酒精灯。 答案:(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 浓硫酸 (2)HCl HCl和H2 发生倒吸、可燃性气体H2不能被吸收 (3)KSCN溶液 点燃A处的酒精灯 点燃C处的酒精灯 10.(2015·东北大联考)三氯化硼(BCl3)是一种重要的化工原料,可用于制取乙硼烷(B2H6),也可作有机合成催化剂。某兴趣小组拟选用下列装置制备BCl3(已知BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;2B+6HCl2BCl3↑+3H2↑。 请回答下列问题: (1)装置A中发生反应的离子方程式为__________________。 (2)按气流方向连接各装置的接口,顺序为_____________。 (3)装置E的两个作用是_____________、____________;实验中若不用装置C,可能产生的危险是_______________。 (4)BCl3遇水产生大量的白雾同时生成硼酸(H3BO3),其反应的化学方程式为_____________。 解析:实验过程为制备氯气(装置A)→净化氯气(装置C、F)→发生装置(B装置)→收集装置(D装置)→尾气处理装置(E装置)。实验中若不用装置C,则氯气中混有的氯化氢能与B发生反应生成H2,氢气与氯气反应可发生爆炸。BCl3与水反应属于广义的水解,生成B(OH)3(即H3BO3)和HCl。 答案:(1)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O (2)aedjkbc(或cb)fg(或gf)h (3)防止空气中的水蒸气进入U形管、吸收多余氯气 B与HCl反应生成H2,H2、Cl2混合受热发生爆炸 (4)BCl3+3H2O===3HCl+H3BO3 12.(2014·福建卷)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验: 实验一 焦亚硫酸钠的制取 采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。 (1)装置Ⅰ中产生气体的化学方程式为_____________。 (2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是________。 (3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填编号)。 实验二 焦亚硫酸钠的性质 Na2S2O5溶于水即生成NaHSO3。 (4)证明NaHSO3溶液中HSO的电离程度大于水解程度,可采用的实验方法是________(填字母)。 a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测 (5)检验Na2S2O5晶体在空气中已被氧化的实验方案是 __________________________________________________________。 实验三 葡萄酒中抗氧化剂残留量的测定 (6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下: (已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI) ①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。 ②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。 解析:(1)装置Ⅰ中发生的是实验室制备SO2的反应,采用的原理是强酸制备弱酸,故化学方程式为Na2SO3+H2SO4===Na2SO4+SO2↑+H2O。 (2)将焦亚硫酸钠晶体从溶液中分离出来应该采取过滤的方法。 (3)实验产生的尾气主要是SO2气体,a装置是密闭的环境,SO2通不进去,b装置中食盐水吸收SO2的效果不如d好,且易引起倒吸,c装置浓H2SO4不吸收SO2,SO2是一种酸性氧化物,因此用NaOH溶液吸收最好,且d装置还不易引起倒吸。 (4)HSO发生电离:HSO H++SO,同时会发生水解:HSO+H2OH2SO3+OH-,若HSO的电离大于HSO的水解,则溶液显酸性,故答案a、e正确。 (5)Na2S2O5中S元素的化合价为+4价,因此在空气中易被氧化为+6价的SO,因此本题就转化为SO的检验,故取固体先加盐酸酸化,排除其他离子的干扰,再加BaCl2溶液,看是否有白色沉淀产生即可。 (6)①根据反应方程式:SO2+I2+2H2O===H2SO4+2HI,可知n(SO2)=n(I2)=0.010 00 mol·L-1×0.025 L=2.5×10-4 mol,由于葡萄酒样品为100.00 mL,因此样品中抗氧化剂的残留量为2.5×10-4 mol×64 g·mol-1÷0.100 0 L=0.16 g·L-1。 ②若部分HI被空气氧化,则测得消耗的I2会减少,故测得的SO2会减少,结果偏低。 答案:(1)Na2SO3+H2SO4===Na2SO4+SO2↑+H2O(或Na2SO3+2H2SO4===2NaHSO4+SO2↑+H2O) (2)过滤 (3)d (4)ae (5)取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成 (6)①0.16 ②偏低查看更多